Содержание статьи
Введение
Папилломавирусная инфекция (ПВИ) — инфекционное заболевание человека, вызываемое вирусами папилломы человека (ВПЧ). ВПЧ — большая и гетерогенная группа вирусов, являющихся инициирующим фактором для формирования ряда патологических процессов шейки матки и кожи — цервикальных интраэпителиальных неоплазий, рака шейки матки, кондиломатоза; кроме этого, персистенция ВПЧ способствует длительному, вялотекущему воспалительному процессу в органах малого таза с дальнейшим развитием репродуктивных и перинатальных нарушений — бесплодия, невынашивания беременности, фетоплацентарной недостаточности, преэклампии и многих других [1]. До настоящего времени остается неясным, почему в одних случаях происходит спонтанная элиминация ВПЧ, а в других наблюдается длительная персистенция вируса и его реактивация.
Особенностью ВПЧ является то, что, находясь внутриэпителиально, он не распознается антигенпрезентирующими клетками. Интеграция и репликация вируса происходят в клетках, которые будут вскоре отторгнуты. В связи с этим при попадании в организм человека нет специфических признаков виремии, цитолиза и воспаления [2]. Одним из первых механизмов защиты репродуктивного тракта женщины является врожденный мукозальный иммунитет, который, в свою очередь, включает патогенетические механизмы против ВПЧ, усиливая в первую очередь выработку важных цитокинов — интерферонов (ИФН) [2–4].
Нами было выдвинуто предположение, что существенная роль в патогенезе инфекций и нарушений фертильности (синдрома потери плода) при вирусных процессах принадлежит дисфункции в системе ИФН, при этом все их 3 типа остаются малоизученными у пациенток в прегравидарном периоде. Поэтому нами принято решение определить ИФН локально, в цервикальной слизи, так как именно их присутствие отражает состояние мукозального иммунного ответа.
Цель исследования: провести сравнительный анализ интерферонового профиля мукозального иммунитета у пациенток с ПВИ в ассоциациях с герпетической и хламидийной инфекциями.
Материал и методы
В исследование было включено 149 пациенток в возрасте 25–44 лет (средний возраст 27±2,7 года). Пациентки были разделены на 4 группы в зависимости от наличия инфекций: I группа — с ПВИ (n=21), II группа — с ПВИ и герпесвирусной инфекцией (ГВИ) (n=47), III группа — с ПВИ и хламидийной инфекцией (n=39) и IV группа — контрольная (30 практически здоровых женщин, сопоставимых по возрасту).
Комплексное клинико-лабораторное исследование проводили в амбулаторных условиях по единой программе, включающей клинико-функциональное, биохимическое и иммунологическое обследование с целью детализации патофизиологических механизмов ПВИ в урогенитальном тракте. Определение в цервикальной слизи уровня ИФН: ИФН-β, ИФН-γ, ИФН-λ1 (ИЛ-29), ИФНλ3
(ИЛ-28B) — проведено методом твердофазного иммуноферментного анализа с использованием специфических реактивов фирмы R&D Diagnostic Inc. (США).
Статистическая обработка данных выполнена с использованием программы IBM SPSS® v.22. Внутри- и межгрупповые различия оценивали с помощью критерия Манна — Уитни с поправкой Бонферрони. При ненормальном распределении и малом числе наблюдений показатели представляли в виде медианы (Ме), нижнего и верхнего квартилей (Q21; Q3). Для проверки взаимосвязи или независимости между величинами определяли коэффициент корреляции Спирмена. Статистически значимыми считали различия при p<0,05.
Результаты исследования
При исследовании уровня ИФН I, II и III типов в цервикальной слизи были выявлены общие закономерности и ряд различий в группах (см. таблицу).
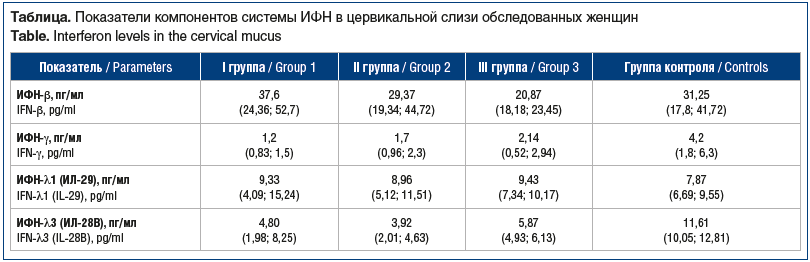
Уровень ИФН-β в I и II группах находился в пределах референсных величин, в то время как в III группе его уровень был статистически значимо снижен как по сравнению с группой контроля (p<0,05), так и по сравнению с I (p=0,022) и II (p=0,037) группами.
Уровень ИФН-γ был снижен в 2–4 раза у пациенток всех 3 групп по сравнению с группой контроля (p<0,05). Однако значения в группах изменялись в разной степени. Так, в I группе было зарегистрировано наиболее выраженное понижение в сравнении с II и III группами (p=0,043 и p=0,032 соответственно).
Уровень ИФН-λ1 не имел статистически значимой разницы между основными группами и в сравнении с группой контроля (p>0,05). В то же время уровень ИФН-λ3 был снижен в 2–3 раза во всех исследуемых группах по сравнению с референсными величинами (p<0,01). Межгрупповые различия также были статистически значимыми. Так, в группе с ассоциациями вирусных инфекций показатель был более низким в сравнении с I (p=0,04) и III (p=0,026) группами.
Анализ полученных результатов показал, что у пациенток всех основных групп выявлен дефицит ИФН-γ и ИФН-λ3. Анализируя особенности в этих группах, можно констатировать, что при ПВИ ведущим нарушением был дефицит ИФН-γ. Во II группе, с ассоциациями вирусных инфекций, задокументирован максимально низкий уровень ИФН-λ3. В группе с ассоциацией вирусной и бактериальной инфекций выявлен дефицит продукции ИФН-β.
Обсуждение
Система ИФН эволюционно представляет собой один из наиболее значимых механизмов контроля и клиренса вирусных возбудителей в организме человека, особенно на локальном уровне. Ввиду этого истощение данной защитной системы становится очевидным при развитии клинически значимого инфекционного процесса. Вызывает интерес тот факт, что вирусная эвазия способна подавлять как продукцию ИФН, так и их взаимодействие между собой и другими цитокинами путем модификации и ингибирования сигнальных путей, а также влияния на возможность процессинга антигенов [5, 6].
ИФН I типа не только обладают выраженным противовирусным действием, но и важны для правильной регуляции всей системы в период инфекционного процесса. Снижение концентрации ИФН-β в группе с хламидийной инфекцией может свидетельствовать о нарушении взаимодействия с мембранными рецепторами, что клинически может проявляться образованием фиброзной ткани [7]. В отличие от лейкоцитарного ИФН-α, ИФН-β образуется в стимулированных фибробластах, что предполагает наибольшее его снижение при ассоциации вирусной и бактериальной инфекций, это приводит к нарушению пролиферации фибробластов и дальнейшему формированию соединительной ткани в просвете маточной трубы, способствуя спаечному процессу и репродуктивным нарушениям в виде бесплодия [8]. Регуляторную функцию ИФН-β способен реализовывать через модуляцию TLR-зависимого иммунного ответа, запуская каскад противовирусных реакций. Это послужило формированию мнения, что изолированный дефицит данного звена интерфероновой системы не играет клинически значимой роли при инфекционном поражении [9]. Основываясь на результатах нашего исследования, можно сделать вывод, что, несмотря на большее изменение уровня ИФН-β в группе с ПВИ и хламидийной инфекцией, уровень ИФН-γ в данной группе изменялся в меньшей степени, что, безусловно, требует дальнейшего изучения с позиции перекрестных взаимодействий ИФН.
ИФН II типа наиболее изучены с позиции иммунорегуляции, а не прямого противовирусного эффекта. Индукция синтеза ИФН-γ крайне зависима от активации ИФН-зависимых сигнальных путей (ИНФ I типа), однако в то же время существует возможность нарушения и ИФН-γ-сигнальной активности, которая может приводить к рецидивирующему течению ГВИ при нормализации уровня ИФН-γ [10]. Подобная картина характерна и для пациенток с ПВИ при наличии определенной формы мутации в гене ИФН-γ: полиморфизм +874T/A характеризуется большей восприимчивостью к ПВИ, чем +874А/A, однако именно у носителей АА-варианта уровень ИФН-γ был ниже [10]. Оценивая полученные нами результаты с позиции современных знаний о роли ИФН-γ, мы можем предположить, что его дефицит является характерным проявлением вирусной эвазии, однако существующих данных недостаточно, чтобы однозначно судить о влиянии степени дефицита на клиническую картину заболевания, это подводит нас к рассмотрению возможности рутинго генотипирования пациенток с вирусными инфекциями для решения вопроса об индивидуализации терапии.
ИФН III типа представляют в настоящее время особый интерес для исследователей вирусных заболеваний. Обладая всеми положительными сторонами ИФН I типа, они лишены ряда их негативных сторон, когда мы оцениваем их как потенциальные мишени или инструменты терапевтиче¶ 1кого взаимодействия. Учитывая меньшую эффекторную широту экспрессии рецепторов, активация ИФН-λ способна обеспечивать как противовирусную защиту на ранних стадиях инфекции, так и контроль реактивации вирусов [6, 11]. При ПВИ и ГВИ ИФН III типа имели разнонаправленные изменения: определено снижение уровня ИФН-λ3, в то время как уровень ИФН-λ1 оставался без изменений. Существует мнение о том, что инфицирование высокоонкогенными типами ВПЧ ассоциировано со сниженным уровнем ИФН-λ1, а сочетанная вирусная инфекция, вероятно, провоцирует интерферонодефицит, таким образом, снижая противоопухолевую функцию данного ИФН [12, 13]. Уровень ИФН-λ3 демонстрирует картину, которую сложно оценить однозначно. Известно о возможности вирус-зависимой индукции экспрессии генов ИФН III типа, при этом ее уровень и скорость различаются при разной локализации вирусного поражения. Вероятно, подобные результаты ассоциированы с генетическим полиморфизмом, однако это требует дополнительного изучения [7, 14]. Дисбаланс ИФН в цервикальной слизи у женщин свидетельствует о нарушении противовирусной защиты еще на локальном уровне в результате процессов активного потребления и, вероятно, нарушения их продукции [15, 16].
Заключение
В результате проведенного нами исследования выявлено развитие разноуровневого интерферонодефицита у всех пациенток как с моновариантной ПВИ, так и в сочетании с ГВИ или хламидийной инфекцией. Патогенетическое значение имеет не только выявленный дефицит преимущественно ИФН II и III типов, но и их дисрегуляция, которая является как проявлением стратегии иммунной эвазии возбудителей, так и, вероятно, генетической особенностью макроорганизма, повышающей восприимчивость к патогенам. Дальнейшее комплексное изучение уровня ИФН, их рецепторов и генов, а также функционирования ИФН-зависимых сигнальных путей является объективной необходимостью и обязательным шагом для разработки новых терапевтических и профилактических подходов у пациенток с вирусными и бактериальными инфекциями.
Сведения об авторах:
Маркелова Елена Владимировна — д.м.н., профессор, заведующая кафедрой нормальной и патологической физиологии ФГБОУ ВО ТГМУ Минздрава России; 690002, Россия, г. Владивосток, пр-т Острякова, д. 2; ORCID iD 0000-0001-5846-851X.
Тулупова Марина Сергеевна — к.м.н., главный врач ООО «Парацельс»; 690005, Россия, г. Владивосток, ул. Новоивановская, д. 4А; ORCID iD 0000-0003-1017-6299.
Невежкина Татьяна Андреевна — ассистент кафедры акушерства и гинекологии, ассистент кафедры нормальной и патологической физиологии ФГБОУ ВО ТГМУ Минздрава России; 690002, Россия, г. Владивосток, пр-т Острякова, д. 2; ORCID iD 0000-0002-9165-3511.
Матюшкина Людмила Семеновна — к.м.н., доцент, заведующая кафедрой акушерства и гинекологии ФГБОУ ВО ТГМУ Минздрава России; 690002, Россия, г. Владивосток, пр-т Острякова, д. 2; ORCID iD 0000-0002-5404-4215.
Черникова Мария Анатольевна — аспирант кафедры нормальной и патологической физиологии ФГБОУ ВО ТГМУ Минздрава России; 690002, Россия, г. Владивосток, пр-т Острякова, д. 2; заведующая отделением лабораторной диагностики ООО «Асклепий»; 690033, Россия, г. Владивосток, ул. Гамарника, д. 3-Б; ORCID iD 0000-0002-6556-7118.
Кныш Сергей Васильевич — к.м.н., доцент кафедры нормальной и патологической физиологии ФГБОУ ВО ТГМУ Минздрава России; 690002, Россия, г. Владивосток, пр-т Острякова, д. 2; ORCID iD 0000-0003-4571-1749.
Контактная информация: Невежкина Татьяна Андреевна, e-mail: www.tanya.ru9292@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 01.02.2022.
Поступила после рецензирования 25.02.2022.
Принята в печать 24.03.2022.
About the authors:
Elena V. Markelova — Dr. Sc. (Med.), Professor, Head of the Department of Normal and Pathological Physiology, Pacific State Medical University; 2, Ostryakov av., Vladivostok, 690002, Russian Federation; ORCID iD 0000-0001-5846-851X.
Marina S. Tulupova — C. Sc. (Med.), Head Doctor, JSC «Paratsels»; 4A, Novoivanovskaya str., Vladivostok, 690005, Russian Federation; ORCID iD 0000-0003-1017-6299.
Tatyana A. Nevezhkina — assistant of the Department of Obstetrics and Gynecology, assistant of the Department of Normal and Pathological Physiology, Pacific State Medical University; 2, Ostryakov av., Vladivostok, 690002, Russian Federation; ORCID iD 0000-0002-9165-3511.
Lyudmila S. Matyushkina — C. Sc. (Med)., Associate Professor, Head of the Department of Obstetrics and Gynecology, Pacific State Medical University; 2, Ostryakov av., Vladivostok, 690002, Russian Federation; ORCID iD 0000-0002-5404-4215.
Maria A. Chernikova — postgraduate student of the Department of Normal and Pathological Physiology, Pacific State Medical University; 2, Ostryakov av., Vladivostok, 690002, Russian Federation; Head of the Department of Lab Diagnostics, JSC «Asklepiy», 3B, Gamarnik str., Vladivostok, 690033, Russian Federation; ORCID iD 0000-0002-6556-7118.
Sergey V. Knysh — C. Sc. (Med.), associate professor of the Department of Normal and Pathological Physiology, Pacific State Medical University; 2, Ostryakov av., Vladivostok, 690002, Russian Federation; ORCID iD 0000-0003-4571-1749.
Contact information: Tatyana A. Nevezhkina, e-mail: www.tanya.ru9292@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 01.02.2022.
Revised 25.02.2022.
Accepted 24.03.2022.
.
Информация с rmj.ru






