Эффективность межфасциальных блокад поперечного пространства живота в комплексной анестезии в плановой лапароскопической хирургии
Содержание статьи
Введение
Невозможно представить современную плановую хирургию без применения лапароскопических методик. Так, лапароскопический доступ давно стал «золотым стандартом» при лечении паховых грыж [1]. Несмотря на значительное уменьшение площади разреза даже для обширных абдоминальных операций, при проведении лапароскопических вмешательств обезболивание места стояния троакаров и манипуляций в брюшной полости требует внимания со стороны анестезиолога как в интра-, так и в послеоперационном периоде [2].
В связи с этим методики анестезии также должны отвечать требованиям быстрого восстановления и адекватного контроля послеоперационного болевого синдрома [3].
Стратегия интра- и послеоперационного обезболивания при выполнении лапароскопических герниопластик зачастую базируется на методах, применяемых при открытых операциях (например, эпидуральная аналгезия). Однако применение этих методов имеет некоторые ограничения. Например, пациентам, получающим антикоагулянтную терапию, устанавливать эпидуральный катетер нежелательно в связи с высоким риском возникновения эпидуральной гематомы [4]. Наличие множества неблагоприятных побочных эффектов у опиатных анальгетиков — основных препаратов, используемых в купировании болевого синдрома — побудило к поиску альтернативного метода обезболивания и популяризации регионарной анестезии, а именно блокады поперечного пространства живота (Transversus Abdominis Plane Block, TAP-блок) под УЗ-контролем [5]. Методика основана на ультразвуковом сопровождении продвижения иглы между поперечной мышцей живота и внутренней косой мышцей с целью блокады передних ветвей нижних 6 грудных нервов (Th7–12) и первого поясничного нерва (L1) [6].
Каковы преимущества введения местного анестетика межфасциально? Прежде всего, контроль над болевым синдромом, значительное снижение потребности в опиатных анальгетиках, назначение которых может сопровождаться рядом побочных эффектов [7, 8]. Применение регионарных методик укладывается в концепцию протокола ускоренного выздоровления (Enhanced Recovery After Surgery, ERAS), одной из целей применения которого служит адекватный контроль над послеоперационной болью и раннее восстановление [9].
Обзор литературных данных
Впервые ТАР-блок как методика анестезии был описан в 2001 г. Rafi, который использовал в качестве ориентира треугольник Пти [10, 11]. В дальнейшем эта техника была усовершенствована путем внедрения УЗ-контроля положения иглы [11, 12]. Например, выполнение данной методики стало возможным и субкостально. Анестезия нервов, исходящих из Th6–Th10, позволяет делать разрез выше уровня пупка. В составе мультимодальной аналгезии применение ТАР-блоков описано в хирургии верхнего и нижнего этажей брюшной полости. Во многих публикациях представлены хорошие результаты в обеспечении послеоперационной аналгезии у большого числа пациентов после открытого хирургического вмешательства [13, 14]. Kim et al. (2017) [15] отметили не только простоту выполнения ТАР-блока под УЗ-контролем, но и небольшое число осложнений, а также низкую себестоимость процедуры.
В ряде исследований описано применение данной методики анестезии в качестве однокомпонентной даже при открытых гастростомиях (Niraj et al., 2009; Hasan et al., 2011), но выборки были небольшими (по 5 пациентов), поэтому целесообразность применения ТАР-блока в качестве одного компонента при выполнении открытых операций остается дискутабельной [16, 17]. Регионарные методики анестезии безопасны и эффективны у пациентов пожилого и старческого возраста с сопутствующей соматической патологией. Так, Bihani P. et al. (2017) описали случай применения субкостального ТАР-блока у пациента с низкой фракцией выброса (30%) при выполнении герниопластики по поводу пупочной грыжи [18]. Успешное применение ТАР-блока у пациентки в возрасте 81 года, получавшей антикоагулянтную терапию, описано Nagata et al. (2017) [19].
При использовании TAP-блока в составе мультимодальной аналгезии при хирургических вмешательствах по поводу злокачественных опухолей толстой кишки Tikuisis et al. (2016) [20] отметили значительное снижение выраженности боли и потребности в анальгетиках (фентанил и кеторолак) в послеоперационном периоде, а также уменьшение длительности пребывания пациентов в стационаре. Chesov et al. (2017) [21], применявшие TAP-блок, также регистрировали не только снижение интенсивности болевого синдрома в послеоперационном периоде, но и уменьшение интраоперационной потребности в опиатных анальгетиках. Авторы также установили, что в течение 24 ч после операции в группах с применением ТАР-блока и без отсутствовали различия в частоте развития побочных эффектов опиоидов (тошнота, рвота). В то же время результаты некоторых исследований ставят под сомнение универсальность регионарной анестезии. Oh et al. (2017) [22] не выявили существенных различий в интенсивности болевого синдрома, потребности в опиатных анальгетиках, количестве случаев послеоперационной тошноты и длительности пребывания в стационаре при использовании ТАР-блока или плацебо у пациентов, оперированных по поводу онкологических заболеваний толстой кишки.
При сравнении использования ТАР-блока в сочетании с инфильтрацией раневой поверхности местным анестетиком и только инфильтрации раневой поверхности
без применения регионарной анестезии Pedrazzani et al. (2016) [23] обнаружили, что в первом случае отмечалось снижение потребности в опиатных анальгетиках и частоты послеоперационной тошноты и рвоты (ПОТР), восстановление функций ЖКТ происходило также в ранние сроки (в т. ч. переход к диетическому питанию). В то же время Rashid et al. (2017) не выявили существенных различий в выраженности болевого синдрома при использовании ТАР-блока или инфильтрации мест стояния троакаров [24]. Kwikiriza et al. (2019) [25] при обследовании 130 пациенток, перенесших кесарево сечение, пришли к выводу, что применение билатерального ТАР-блока (по 15 мл анестетика на каждую сторону) влияло на выраженность послеоперационного болевого синдрома по сравнению со спинальной анестезией (гипербарический раствор местного анестетика в сочетании с интратекальным введением морфина).
Несмотря на противоречивые результаты исследований, большинство авторов считают целесообразным рутинное применение межфасциальных блокад.
Описание методики
Навыки работы с УЗ-навигацией позволяют сделать методику TAP-блока более простой и безопасной, однако даже наличие визуализации не исключает риски потенциальных осложнений, таких как гематомы вследствие повреждения сосудов, повреждение мышц, брюшины и кишки. В связи с этим существует ряд исследований, в которых выполнение ТАР-блока проводилось не только с УЗ-контролем, но и при визуализации со стороны брюшной полости с участием хирургической бригады [26, 27].
Хотя множество исследований показали потенциальные положительные эффекты плоскостных блоков, результативность методики зависит от места выполнения и техники. По существу, ТАР-блок — периферический блок, затрагивающий передние ветви нервов, исходящих из Th6–L1, которые иннервируют переднюю брюшную стенку. Однако висцеральный компонент боли сохраняется, что может обеспечивать выраженный болевой синдром, например в колоректальной хирургии. Как правило, ТАР-блок выполняется в области треугольника Пти, при необходимости устанавливается катетер для пролонгированного введения местного анестетика. Субкостальное выполнение ТАР-блока обеспечивает аналгезию более высоких дерматомов надпупочной области. По этой методике игла вводится субкостально по косой линии от мечевидного отростка до подвздошной ости. Введение иглы по средней подмышечной линии с латеральной стороны к медиальной более применимо для постановки катетера и потенциального места входа троакаров. Важно не забывать, что расположение дерматомов вариабельно, в связи с чем результаты выполнения разных видов ТАР-блоков могут существенно различаться [15, 28].
Относительно времени выполнения блокады не существует определенных четких рекомендаций. Стандартное время выполнения — за 30–40 мин до разреза. Bourgouin et al. (2017) [29] рекомендовали выполнять УЗ-ассистированный ТАР-блок за 50 мин до разреза. В условиях интенсивного потока оперативных вмешательств применение межфасциального блока одним специалистом за 1 ч до операции практически невозможно с точки зрения организационных аспектов, поэтому ТАР-блок может быть выполнен и непосредственно на операционном столе [24].
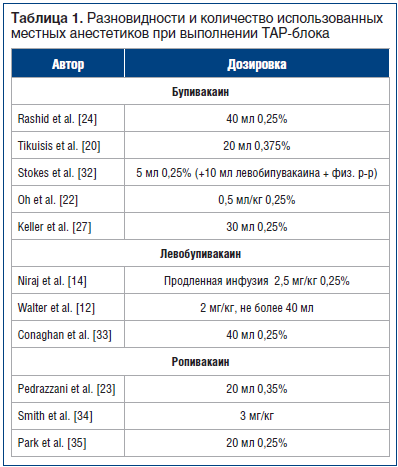
При выполнении ТАР-блока предпочтение отдается бупивакаину, левобупивакаину и ропивакаину. Стоит отметить, что концентрации и количество вводимых анестетиков, по данным литературы, вариабельны (табл. 1). Поскольку ропивакаин обладает меньшей кардиотоксичностью, чем бупивакаин, его использование наиболее предпочтительно. К примеру, длительность блокады при введении ропивакаина может составлять от 12 до 24 ч, в зависимости от концентрации [30]. Однако в литературе нет сведений о наличии или отсутствии эффективности большей концентрации этого местного анестетика при выполнении межфасциальных блоков. Остаются открытыми вопросы эффективности и адъювантов, а также системной токсичности местных анестетиков в условиях ТАР-блока [31].
На основании изученной литературы группой исследователей было принято решение определить, насколько рационально рутинное использование межфасциальных блоков для многопрофильного городского стационара.
Цель исследования: изучить эффективность и безопасность применения 0,5% концентрации ропивакаина при выполнении ТАР-блока в лапароскопической хирургии в условиях многопрофильного городского стационара.
Материал и методы
Исследование одобрено этическим комитетом ГБУЗ ГКБ им. Ф.И. Иноземцева ДЗМ.
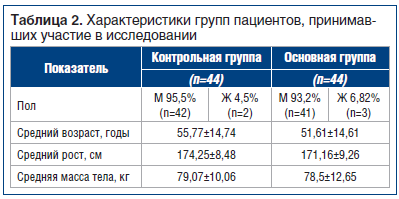
В рандомизированное методом закрытых конвертов исследование было включено 88 человек, которым проведена лапароскопическая двусторонняя герниопластика в период с февраля 2018 г. по март 2019 г. (табл. 2). Пациенты были разделены на 2 группы (n=44) в зависимости от особенностей анестезиологического пособия: 1-я группа (контрольная) — ингаляционная анестезия севофлураном, 2-я группа (основная) — ингаляционная анестезия севофлураном и выполнение ТАР-блока под УЗ-навигацией. Концентрация ропивакаина была выбрана на основании данных литературы и имеющихся сведений о зависимости действия местного анестетика от концентрации [30].
Все пациенты были госпитализированы накануне оперативного вмешательства, премедикацию не получали. Методика ингаляционной анестезии и послеоперационного ведения были идентичны с целью снижения вероятности возникновения различий между группами.
Критерии включения:
впервые выявленная двусторонняя паховая грыжа без признаков ущемления;
возраст от 24 до 80 лет;
ИМТ не более 35 кг/см2.
Критерии исключения:
сахарный диабет вне зависимости от типа;
подтвержденная документально аллергия на местные анестетики амидного типа;
противопоказания к выполнению лапароскопической герниопластики;
хирургическое вмешательство менее 6 нед. назад;
наличие в анамнезе хронического болевого синдрома или постоянного применения наркотических анальгетиков;
беременность.
Использовалась стандартная техника анестезии — индукция анестезии проводилась внутривенным введением раствора пропофола в дозе 2–2,5 мг/кг. Интубацию трахеи выполняли после миоплегии рокуронием 0,6 мг/кг. ИВЛ проводили в режиме SIMV-PS кислородно-воздушной смесью в соотношении 1:1 и потоком «свежего» воздуха 1 л/мин, с поддержанием нормокапнии (etCO2 35–45 мм рт. ст.) наркозно-дыхательным аппаратом DatexAvance по полузакрытому контуру. Интраоперационно вводили фентанил на интубацию в дозе 1–2 мкг/кг с дальнейшим введением болюсной дозы 1 мкг/кг при необходимости.
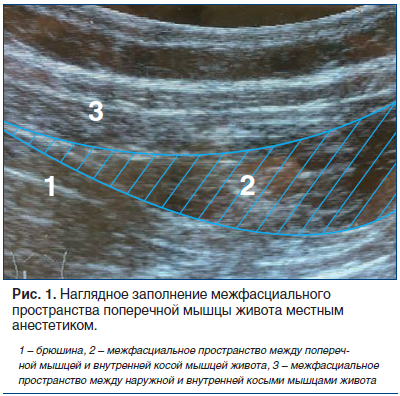
ТАР-блок пациентам 2-й (основной) группы выполнял один специалист сразу после индукции в анестезию до кожного разреза. В асептических условиях под УЗ-навигацией по среднеподмышечной линии в средней точке между нижним краем ребра и крылом подвздошной кости кончик иглы 20 G продвигали до фасции, разделяющей внутреннюю косую и поперечные мышцы живота. Введением 1–2 мл раствора верифицировали правильное стояние иглы, после чего вводили 20 мл 0,5% раствора ропивакаина (рис. 1). Вмешательство проводили с двух сторон.
После пробуждения и экстубации пациентов обеих групп транспортировали в палату пробуждения.
Хирургическая тактика была стандартизированной для всех пациентов и включала в себя инсуффляцию углекислого газа в брюшную полость с дальнейшим выполнением лапароскопического вмешательства через умбиликальный порт с введением 2 дополнительных троакаров, которые располагались в правом и левом нижних квадрантах.
Период исследования начинался с момента индукции анестезии и продолжался 24 ч после операции или до выписки из стационара, если она проходила в течение 24 ч после операции.
УЗ-навигация проводилась аппаратом EZONO 3000 (Германия) с использованием конвексного датчика в стерильных условиях в операционной.
Для оценки эффективности TAP-блока сравнивали потребность в наркотических анальгетиках интраоперационно и в послеоперационном периоде, выраженность болевого синдрома через 2 и 4 ч после операции у пациентов контрольной и основной групп. Выраженность болевого синдрома определяли с помощью визуально-аналоговой шкалы (ВАШ). Уровень седации пациента во время пробуждения и через 2 ч после операции оценивали с помощью шкалы седации Ramsey (1 балл — пациент бодрствует, беспокоен, взволнован, нетерпелив; 6 баллов — пациент спит и не реагирует на раздражители). Для оценки безопасности TAP-блока сравнивали изменения гемодинамических параметров и частоту ПОТР и аллергических реакций у пациентов обеих групп. Гемодинамические параметры оценивали при поступлении пациента в операционную, через 3 мин после интубации, на этапе начала фиксации сетки (что приблизительно соответствовало середине операции) и после экстубации.
Статистическая обработка полученных данных проводилась с использованием методов вариационной статистики с помощью программ MicrosoftExcel и MedCalc. Определяли значение среднего арифметического (M) ± стандартное отклонение (δ), медиану. Достоверность различий определяли с помощью t-критерия Стьюдента для малых рядов наблюдения, значимыми считали различия при р≤0,05.
Статистической обработке подвергались следующие параметры:
количество используемых наркотических анальгетиков интраоперационно;
потребность в наркотических анальгетиках в послеоперационном периоде;
выраженность болевого синдрома в конечных точках: после экстубации, через 2 ч и 4 ч после операции;
частота ПОТР и других последствий анестезиологического пособия;
изменения гемодинамических параметров интраоперационно.
Результаты исследования
Хирургическая тактика у всех пациентов была единообразной, не отмечено ни одного случая ее изменения или интраоперационной конверсии. Среднее время операции в 1-й группе составило 94,95±33,98 мин, во 2-й группе — 78,16±22,35 мин. Различия в длительности оперативного вмешательства не имели связи с анестезиологическим пособием и определялись во многом организационными моментами. Время пробуждения в контрольной группе составило 12,13±3,14 мин, в основной — 10,07±3,32 мин (р=0,014). Однако разница около 2 мин в среднем не имеет клинического значения и линейной корреляции с количеством вводимых опиатных анальгетиков.
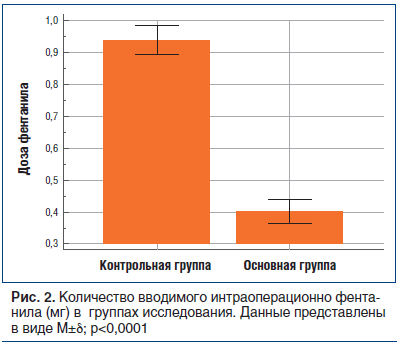
Как показано на рисунке 2, количество интраоперационно введенного фентанила в основной группе было статистически значимо ниже, чем в контрольной группе (0,4±0,019 мг против 0,94±0,023 мг, р<0,0001). Корреляции с длительностью оперативного вмешательства определено не было.
Оценка по шкале Ramsay после экстубации составила у пациентов контрольной и основной групп 2,0±0,4 и 2,4±0,1 балла соответственно (р=0,0009); через 2 ч после операции данный показатель у пациентов контрольной группы составил 2,0±0,4 балла, у пациентов основной группы — 2,3±0,1 балла (р=0,0314).
Основные гемодинамические параметры приведены в таблице 3.
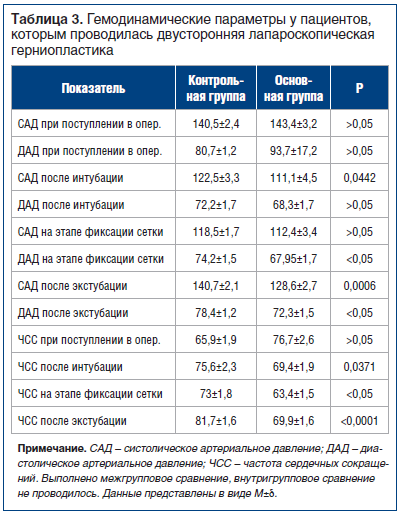
Медиана для САД на этапе фиксации сетки в контрольной группе составила 120 мм рт. ст., в опытной группе — 110 мм рт. ст., после экстубации медиана для САД в контрольной группе равнялась 140 мм рт. ст., в основной группе — 130 мм рт. ст.
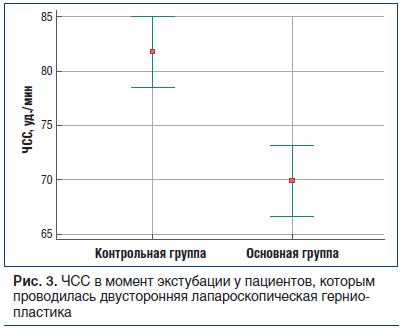
ЧСС в момент экстубации была статистически значимо (р<0,0001) ниже у пациентов основной группы по сравнению с данным показателем у пациентов контрольной группы (рис. 3). Отсутствие тенденции к тахикардии у пациентов основной группы свидетельствовало, вероятно, об успешном развитии ТАР-блока и отсутствии выраженного болевого синдрома.
При наблюдении в течение 24 ч было установлено, что 3 пациентам контрольной группы понадобилось введение наркотических анальгетиков, в то время как пациентам основной группы и остальным пациентам контрольной группы по требованию внутримышечно вводили НПВП.
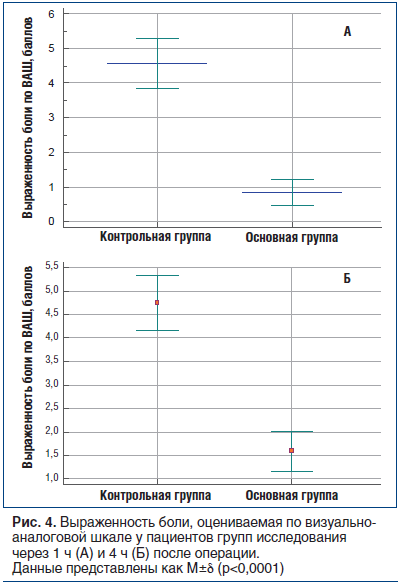
Как показано на рисунке 4А, через 1 ч после операции выраженность боли по ВАШ была статистически значимо ниже у пациентов основной группы по сравнению с данным показателем у пациентов контрольной группы (0,8±0,2 против 4,6±0,4 балла, p<0,0001). Через 4 ч после операции выраженность боли по ВАШ увеличивалась у пациентов обеих групп (рис. 4Б). У пациентов основной группы выраженность боли по ВАШ через 4 ч после операции составила 1,6±0,2 балла, что было статистически значимо (p<0,0001) ниже, чем у пациентов контрольной группы (4,8±0,3 балла).
Количество пациентов, у которых развивались ПОТР в послеоперационном периоде, статистически достоверно не различалось между группами и составило в контрольной группе 10 (22,7%) человек, в основной — 7 (15,9%) человек. Аллергических реакций в ходе исследования не зарегистрировали.
Обсуждение результатов
Так зачем анестезиологу тратить время на выполнение межфасциального блока перед индукцией в анестезию? Главной целью интраоперационного применения ТАР-блока является уменьшение количества вводимых опиатных анальгетиков. Мы показали, что проведение процедуры непосредственно перед разрезом статистически значимо снизило количество фентанила, использованного интраоперационно. Корреляции с длительностью оперативного вмешательства определено не было. С учетом зависимости силы действия ропивакаина от концентрации можно сделать вывод о том, что применение 0,5% раствора за 10–15 мин до операции позволяет получить желаемый эффект от применения межфасциального блока, сократив время пребывания пациента в операционной или предоперационной до оперативного вмешательства.
Оценка по шкале Ramsay показала, что пробуждение пациентов основной группы происходило с меньшей ажитацией и тревожностью, что, в свою очередь, могло быть обусловлено отсутствием выраженного болевого синдрома.
Известно, что при лапароскопических операциях в условиях карбоксиперитонеума даже у пациентов без сопутствующих соматических заболеваний развиваются изменения основных гемодинамических параметров, связанные с изменением положения пациента и повышением давления в брюшной полости, не считая хирургических манипуляций.
Контрольными точками фиксации изменения гемодинамических параметров были выбраны 4 периода: поступление в операционную, параметры 3 мин после интубации, на этапе фиксации сетки (что приблизительно соответствовало середине операции) и после экстубации. Полученные данные подтверждают доказанное положительное влияние регионарных методик анестезии на тенденции в интраоперационных изменениях гемодинамических параметров. Изменения основных показателей в группе ТАР-блока подвергались меньшим колебаниям и статистически значимо различались в исследуемых группах (рис. 2). Внутригрупповое сравнение показателей АД и ЧСС не проводилось в связи с отсутствием целесообразности. Стабильность показателей гемодинамики в основной группе также косвенно свидетельствует об отсутствии токсического воздействия 0,5% ропивакаина в дозе 200 мг, вводимого межфасциально. Поскольку контроль над параметрами гемодинамики у пациентов с хроническими заболеваниями (не только со стороны сердечно-сосудистой системы) является целевым показателем эффективности проводимого анестезиологического пособия, отсутствие выраженных колебаний параметров гемодинамики можно отнести к несомненному преимуществу межфасциальных блоков.
Другой важной задачей применения ТАР-блока является контроль послеоперационного болевого синдрома. Контрольными точками были выбраны следующие временные интервалы: 1-й и 4-й ч послеоперационного периода. В обоих случаях применение TAP-блока статистически значимо уменьшало выраженность болевого синдрома (p<0,0001). Регионарные методики анестезии обеспечивают эффективный контроль послеоперационного болевого синдрома, что еще раз подтвердили полученные данные.
Количество пациентов, у которых в послеоперационном периоде развивались ПОТР, в контрольной группе составило 10 (22,7%) человек, в ТАР-группе — 7 (15,9%) человек. Группы не различались по данному показателю. Убедительных данных о том, что частота ПОТР в послеоперационном периоде была связана с применением наркотических анальгетиков, не получено.
Применение регионарных методик с внедрением УЗ-навигации упрощает выполнение манипуляции, сокращает время выполнения процедуры, что особенно важно в ургентных условиях.
Выводы
Выполнение TAP-блока с использованием 0,5% раствора ропивакаина билатерально по 20 мл эффективно уменьшает потребность в наркотических анальгетиках в интра- и послеоперационном периоде при проведении лапароскопической двусторонней герниопластики. Применение TAP-блока статистически значимо уменьшает выраженность болевого синдрома через 1 и 4 ч после операции (p<0,0001) по сравнению с данным показателем у пациентов контрольной группы, которым TAP-блок не выполняли. Использование TAP-блока не влияет на частоту ПОТР и не приводит к угнетению гемодинамических параметров, что имеет существенное значение для пациентов пожилого и старческого возраста с сопутствующей сердечно-сосудистой патологией. Межфасциальные блокады, несомненно, эффективны в качестве компонента анестезиологического пособия. Широкое внедрение межфасциальных блокад в анестезиологическую практику при лапароскопических операциях в условиях многопрофильного городского стационара укладывается в концепцию ERAS-протокола, способствуя более быстрому восстановлению в послеоперационном периоде.
Информация с rmj.ru





