Введение
Известно, что под синдромом «голубых склер» подразумевают большую группу состояний с различными механизмами возникновения. Согласно данным англоязычной литературы в настоящее время описано не менее 66 генетически обусловленных синдромов, 8 системных расстройств негенетической природы и 4 медикаментозно индуцированных пигментаций [1]. Многообразие вариантов данной патологии, разновременность появления ее основных симптомов, сочетания с различными системными изменениями зачастую способны затруднить своевременную диагностику заболевания, принять правильное решение о тактике ведения пациентов.
Причины, факторы риска и основные клинические проявления синдрома «голубых склер»
Голубое окрашивание склер возможно в результате применения высоких доз антибиотика группы тетрациклина — миноциклина. Обычно подобная пигментация склеры сопровождается обесцвечиванием ногтей и приобретением ими серо-синего оттенка, иногда изменением цвета кожи, слизистой оболочки полости рта и пр. [2, 3]. Имеются отдельные сообщения о появлении синих склер после приема противосудорожного средства эзогабина/ретигабина, цитостатика митоксантрона и глюкокортикоида преднизона [4–6]. Однако установление причинно-следственной связи при подозрении на фармакологически индуцированную пигментацию склеры для большинства практикующих врачей бывает достаточно затруднительным [1].
Среди генетически независимой системной патологии голубизна наружной оболочки глаза чаще всего встречается при железодефицитной анемии [7, 8]. По данным L. Kalra et al. [9] и M. Beghetti et al. [10], среди небольших групп госпитализированных пациентов частота возникновения голубых склер колебалась от 56,3 до 85,1%.
Наличие данного симптома было отмечено и при другой патологии, например при приобретенном синдроме POEMS (полинейропатия, органомегалия, эндокринопатия, М-протеин, кожные изменения) [7], аргирии [11], синдроме Каплана [12], гипергомоцистеинемии [13], миастении гравис [14], невусе Ота [15].
Вместе с тем подавляющее большинство вариантов синдрома «голубых склер» обусловлено генетически. Наиболее распространенный тип наследования данных синдромов — аутосомно-рецессивный (47%) [16]. На наследование по аутосомно-доминантному, Х-сцепленному либо неустановленному типам приходится 30,3% клинических случаев [1].
Изменение цвета склеры связывают с первичными дефектами склерального коллагена вследствие нарушения биосинтеза или деградации волокнистых структур соединительной ткани (СТ). Генетически измененный фибриллогенез внеклеточного матрикса обусловливает нарушение развития СТ в эмбриональном и постнатальном периодах. Морфологическое несовершенство склеры ведет к истончению наружной оболочки глаза и просвечиванию подлежащей сосудистой оболочки, что обусловливает появление склеральной голубизны, которая более интенсивна, чем у здоровых новорожденных, и не исчезает к 5–6 мес. жизни, как обычно. При этом размеры глаз не изменены.
Единственным из всех идентифицированных состояний, при которых синяя склера считается постоянным фенотипическим признаком, является несовершенный остеогенез (НО) 1-го типа [17, 18]. Это преимущественно аутосомно-доминантное заболевание, приводящее к снижению общей выработки коллагена I типа примерно на 50% [19]. Несмотря на то, что НО прежде всего характеризуется хрупкостью костей, он потенциально поражает все органы с высоким содержанием коллагена, включая органы зрения, слуха, зубочелюстной системы [1, 20, 21]. Ломкость костей (болезнь «хрустального человека») на разных сроках течения процесса отмечают почти у 2/3 пациентов. Часто нарушение оссификации сочетается со слабостью связочного аппарата и суставов, что обусловливает формирование различного рода вывихов и подвывихов. Истончение барабанной перепонки, наблюдаемое у 90% больных, связано с прогрессирующей тугоухостью. Кроме «голубой» барабанной перепонки у данных пациентов определяют вывихи и неправильное развитие слуховых косточек.
Помимо голубых склер при НО выявляют кератоглобус, кератоконус, эмбриотоксон, зонулярную или кортикальную катаракту, эктопию хрусталика, пятнистую дегенерацию роговицы и пр. A. Scott et al. [22] дополнили перечень изменений высокой частотой миопии и астигматизма, U. Pedersen et al. [23] — истончением роговицы по сравнению с ее толщиной у здоровых людей. В большинстве случаев патологию выявляют в детском возрасте.
Изучая нескелетные проявления НО среди 85 пациентов (средний возраст 44,9±15,9 года), J.D. Hald et al. [20] установили, что наименьшая толщина роговицы характерна для пациентов с НО 1-го типа — 461±32 мкм против контрольного значения в 550±30 мкм. У пациентов с НО 3-го и 4-го типов толщина роговицы в ее центральной зоне (ЦТР) составляла 510±29 и 500±40 мкм соответственно (p<0,001). Однако статистически значимого различия в величине этого показателя у пациентов с НО с синими и белыми склерами авторами не выявлено — 470±32 мкм против 497±46 мкм соответственно (p=0,69). Этими же исследователями у одного из 58 пациентов с НО 1-го типа была диагностирована первичная глаукома, 2 пациента были направлены под динамическое наблюдение по поводу вторичной глаукомы [20].
Синдром «голубых склер» и глаукома
Несмотря на имеющиеся сведения об ассоциации НО с глаукомой, убедительных доказательств такой связи до настоящего времени не представлено. Более 50 лет назад W.A. Manschot [24] описал результаты посмертного гистологического исследования глаз недоношенного ребенка с предполагаемым НО 2-го типа, с синей, истонченной до 1/3 от нормальной толщины склерой, тонкой роговицей, открытым углом передней камеры и аномально глубокой экскавацией диска зрительного нерва (ДЗН), которые, по мнению авторов, обусловлены недостаточным развитием склеральной решетчатой пластинки. Однако связь выявленных изменений с уровнем внутриглазного давления (ВГД) не рассматривалась [24, 25].
L. Berggren et al. [26] описали 5 случаев НО с голубыми склерами, нормальными показателями ее ригидности, с ВГД в диапазоне 10–14 мм рт. ст., высокими значениями показателя легкости оттока внутриглазной жидкости. Ни у одного из пациентов не было обнаружено глаукоматозных изменений ДЗН и периферического зрения. В 1989 г. A. Superti-Furga et al. [27] представили семью с НО (гипотетически 4-го типа) с патогенным вариантом в гене COL1A2, в которой у одного члена семьи диагностирована монолатеральная глаукома, но никаких дополнительных подробностей офтальмологического анамнеза, результатов дискоскопии или периметрии предоставлено не было.
Результаты продолжающейся дискуссии о генетически обусловленной тонкой роговице как факторе риска первичной открытоугольной глаукомы (ПОУГ) и в целом, и при НО также неоднозначны.
Несовершенный остеогенез 1, 2, 3 и 4-го типов вызван мутациями в генах, кодирующих α-коллагены I типа (COL1A1 или COL1A2) у 90% пациентов [28]. D.P. Dimasi et al. [29], измерив ЦТР у 28 пациентов с НО 1-го типа, обнаружили более низкие значения показателя по сравнению с контролем. Авторы также сообщили, что носительство общих однонуклеотидных вариантов в генах COL1A1 и COL1A2 связано с вариацией ЦТР среди здорового населения. При этом однонуклеотидные варианты rs2696297 и rs1046329, расположенные рядом с геном COL1A1, обусловливают истончение роговицы [29, 30].
Идентифицировав 2 новые мутации в гене COL1A1 (c.540_541insC и c.2452–2A>) у членов двух семей, страдающих НО 1-го типа в сочетании с ПОУГ, D.J. Wallace et al. [25] высказались о связи этих двух заболеваний как о новой фенотипической ассоциации. Доказательством послужили результаты секвенирования гена MYOC, ассоциированного с развитием глаукомы с высоким ВГД, которые продемонстрировали отсутствие каких-либо изменений нуклеотидной последовательности или патогенных вариантов у всех обследованных пациентов.
E. Doolan et al. [31], обследовав 8 членов семьи из двух поколений, выявили НО 1-го типа у 6 человек. При этом двое из них страдали ПОУГ. Изучив свойства роговицы больных НО и здоровых членов семьи, авторы сделали заключение об «аномальном коллагене» как факторе риска развития ПОУГ, реализующемся через изменение биомеханических характеристик тканей глаза, в частности через снижение показателей корнеальной толщины и корнеального гистерезиса.
При этом для европеоидной и азиатской популяций при ПОУГ наиболее вероятными изменениями, потенциально связанными с истончением роговицы, являются патогенные миссенс-варианты в генах COL8A1 и/или COL8A2 [30, 32, 33] и COL5A1 [25]. Эксперимент с целевой инактивацией генов COL8A1 и COL8A2 или точечной мутацией в COL8A2 продемонстрировал сниженную толщину роговицы в экспериментальной модели [34, 35]. T. Desronvil et al. [32] обнаружили миссенс-вариант в гене COL8A2 у пациентов с «запущенной» ПОУГ и тонкими роговицами. По данным S.E.I. Williams et al. [36], носительство патогенных вариантов в гене COL8A2 или его инактивация могут участвовать в снижении ЦТР при ПОУГ у чернокожих пациентов [30, 36].
Приведенные данные позволяют сделать вывод о необходимости и целесообразности дальнейшего изучения роли носительства вариантов генов коллагена при ПОУГ.
Систематизируя синдромальные глазные изменения, D.A. Balikov et al. [37] указывают на глаукому как на одно из глазных проявлений НО наряду с голубыми склерами, тонкой роговицей, низкой корнеосклеральной ригидностью, «короткими глазами», отслойкой сетчатки. Последняя чаще встречается при НО 3-го типа [38].
Исследователи полагают, что при НО измененная биомеханика фиброзной капсулы глаза обусловливает псевдонормальные результаты тонометрии и в ряде случаев позволяет глаукомному процессу остаться незамеченным в любой из возрастных групп [19, 39–41]. Офтальмогипертензию же чаще связывают с гониотрабекулодисгенезом, формирующим субоптимальный анатомо-функциональный эффект работы трабекулярной сети [41].
Другим генетически обусловленным синдромом «голубых склер», для которого характерно развитие глаукомы, является Osteoporosis pseudoglioma (синдром «остеопороз-псевдоглиома») — редкое заболевание, дебютирующее в младенчестве, характеризующееся, помимо хрупкости костей, витреоретинальной дисплазией, микрофтальмом, микрокорнеа, фтизисом глазного яблока, врожденной или младенческой слепотой. Глаукома при этом заболевании является вторичной [1].
В отечественной литературе триаду, включающую синие склеры, повышенную ломкость костей и различной степени тяжести снижение слуха, описывают в составе синдромов Эддовса, Ван дер Хове, Ван дер Хове — Клейна (Адаир — Дайгтона), Лобштейна, Фролика, Лобштейна — Ван дер Хуве, болезни Порака — Дуранта. Клинические проявления, как правило, носят двусторонний характер, в единичных случаях процесс может быть монолатеральным [42].
У многих пациентов с дисплазией СТ выявляют неврологические проявления в виде астенического синдрома (98%), тревоги (95%), вегетативной дисфункции (82%), а также когнитивных нарушений (47%) [43]. Данные неспецифические изменения нередко присутствуют и при другой патологии, в том числе при глаукоме [44–47].
Учитывая относительную редкость, многообразие клинических разновидностей и вариантов течения обсуждаемого синдрома, неоднозначность мнений о его сочетании с глаукомным процессом, приводим следующее клиническое наблюдение.
Клиническое наблюдение
Пациентка Л., 1967 г. р., впервые обратилась в КГБУЗ «ККОКБ им. профессора П.Г. Макарова» (далее ККОКБ) в 2002 г. в связи с периодическими подъемами ВГД в течение 2 лет.
При обращении жалобы отсутствовали. Наследственный анамнез по глаукоме сомнителен (не исключает использование старшими родственниками антиглаукомных капель). На момент первичного обследования острота зрения правого глаза (OD) составляла 0,5 с cyl (-)1,0 Д ax 900=1,0; левого глаза (OS) — 1,0. При биомикроскопии на обоих глазах определены атрофия радужки 1-й степени, частичное разрушение зрачковой пигментной каймы. Иных изменений переднего отдела глаз не обнаружено. На глазном дне правого глаза ДЗН бледно-розового цвета с сероватым оттенком, глубокая экскавация до 0,7 диаметра диска (ДД), границы четкие; на глазном дне левого глаза ДЗН бледно-розового цвета, умеренный сдвиг сосудистого пучка в назальную сторону.
Гониоскопия: на обоих глазах угол передней камеры широкий, умеренная экзогенная пигментация образований корнеосклеральной трабекулы. Ультразвуковое исследование структур органа зрения патологии не выявило. Длина передне-задней оси правого глаза — 25,93 мм, левого глаза — 25,49 мм.
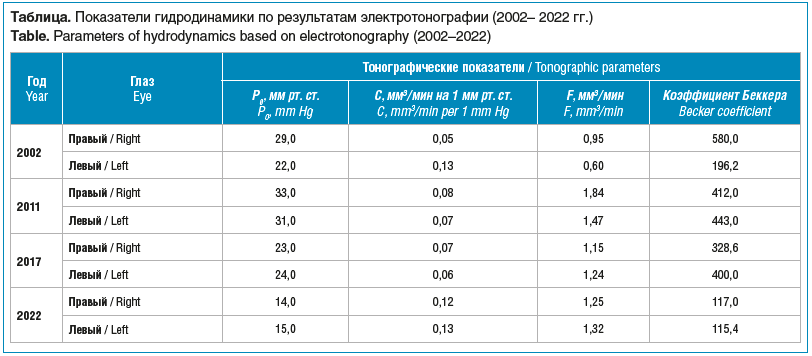
Внутриглазное давление правого глаза — 33 мм рт. ст., левого глаза — 26 мм рт. ст. Толерантное ВГД — 15–20 мм рт. ст. (артериальное давление — 90/70 мм рт. ст.). Гидродинамический баланс нарушен вследствие затруднения оттока внутриглазной жидкости (см. таблицу).
Согласно результатам кинетической периметрии границы периферического зрения обоих глаз в пределах нормы. По данным компьютерной статической периметрии в верхне-назальном квадранте поля зрения правого глаза относительная скотома больших размеров; в поле зрения левого глаза патологических изменений не выявлено.
На основании результатов обследования диагностирована открытоугольная 2С глаукома, простой миопический астигматизм правого глаза; открытоугольная 1А глаукома левого глаза. Рекомендовано оперативное лечение глаукомы правого глаза.
Второй визит в ККОКБ был в 2011 г. (на ранее рекомендованную операцию пациентка не явилась, у окулиста регулярно не наблюдалась, периодически использовала глазные капли тимолола малеата 0,5%). При осмотре жалоб не предъявляла, локальный статус и состояние остроты зрения прежние. Согласно данным компьютерной статической периметрии произошло увеличение степени дефекта в поле зрения правого глаза, появились относительные дефекты в поле зрения левого глаза. Сохранялись низкие значения коэффициента легкости оттока внутриглазной жидкости и повышенные значения коэффициента Беккера. При этом на левом глазу нарушение гидродинамики стало более выраженным (см. таблицу.). От повторно предложенного хирургического лечения пациентка отказалась. К лечению добавлены инстилляции латанопроста 0,005%. На следующий назначенный прием пациентка не пришла.
Третий визит к офтальмологу ККОКБ состоялся в 2017 г. Жалоб не предъявляла, сообщила, что лечится эпизодически, не наблюдается. В ходе беседы обращало на себя внимание снижение слуха, а также состояние эйфории, неадекватное отношение к своему состоянию — отрицание болезни, что не исключало наличие психоневрологической симптоматики.
Острота зрения OD 0,2 не корр., острота зрения OS 0,4 не корр., сужение границ поля зрения обоих глаз в верхне-носовых квадрантах, суммарно на 50–60°, ВГД обоих глаз на уровне 25–27 мм рт. ст., сохранялись гидродинамические изменения (см. таблицу).
При осмотре: склеры обоих глаз голубого цвета, определяется двусторонний иридо- и факодонез, остальные изменения прежние. На глазном дне обоих глаз ДЗН с четкими границами, серый, экскавация до 0,8 ДД. По данным гониоскопии определялось усиление пигментации зоны корнеосклеральной трабекулы. ЦТР на обоих глазах 401 мкм. Передне-задний размер правого глазного яблока — 26,32 мм, левого глазного яблока — 25,87 мм.
На вопрос о наличии переломов в детстве ответила положительно: 6 случаев переломов костей нижних конечностей в возрасте до 10 лет. Отмечала множественные переломы и тугоухость у 3 членов семьи из 3 поколений.
Изложенное позволило заподозрить наличие наследственной патологии СТ, в связи с чем рекомендовано обследование костной системы, молекулярно-генетическое тестирование, консультации сурдолога, невролога, а также гипотензивное хирургическое лечение правого глаза, от которых пациентка категорически отказалась.
В последующие 2 года наблюдения местная гипотензивная терапия оригинальной фиксированной комбинацией (ФК) биматопроста 0,3% и тимолола 0,5% позволяла сохранять целевой уровень ВГД, после чего развилась его стойкая субкомпенсация, в связи с чем была проведена двусторонняя селективная лазерная трабекулопластика.
В настоящее время на фоне использования ФК биматопроста 0,3% и тимолола 0,5% значения тонометрического ВГД на обоих глазах не превышают 17–18 мм рт. ст. Отмечается расширение экскавации ДЗН на обоих глазах до 0,9. По данным статической компьютерной периметрии в 2019 г. среднее отклонение суммарной световой чувствительности (MD) правого глаза -7,26 dB, левого глаза — -7,45 dB, в 2022 г. — -7,93 dB и -5,45 dB соответственно. Индексы PSD правого/левого глаза — 6,87 dB и 7,72 dB в 2019 г., 7,27 dB и 6,19 dB в 2022 г.
Вместе с тем, по данным литературы, при этой патологии наиболее целесообразно проведение хирургических гипотензивных вмешательств. D. Laroche et al. [49] сообщают о 57-летней пациентке с НО и ПОУГ, инстиллировавшей с гипотензивной целью 6 препаратов. Недостаточно сниженное ВГД (26 мм рт. ст.) побудило авторов к проведению комбинированной гониотомии с лезвием Кахука и формированию хирургического пути оттока внутриглазной жидкости из задней камеры в супрахориоидальное пространство, что привело к снижению ВГД до 13 мм рт. ст. через полгода наблюдения, а количество инстиллируемых средств уменьшилось с 6 до 3. По мнению ряда исследователей, при данной патологии оперативное вмешательство помимо гониотомии может включать трабекулотомию, трабекулэктомию или имплантацию трубных шунтов [37, 49, 50]. С учетом наличия у пациентки ультратонких роговиц, системной гипотонии, обусловливающей низкие значения целевого ВГД, неоднократных отказов от гипотензивной операции на настоящем этапе наблюдения к лечению добавлены инстилляции селективного α2-адреномиметика бримонидина 0,15%, что в дальнейшем не исключает проведения хирургического лечения, так как даже интенсивная местная гипотензивная терапия при рассматриваемой патологии может быть неэффективной [49].
Заключение
Несмотря на то, что клиническая картина наследственных системных поражений СТ, в том числе синдрома «голубых склер», достаточно хорошо описана в литературе, врач-офтальмолог, встретившись в своей клинической практике с редкими симптомами, малознакомыми понятиями, может потерять неоправданно много времени на установление диагноза. Затруднять диагностику может выявление новых синдромальных глазных проявлений и заболеваний, развивающихся на фоне диспластических процессов, распознавание ведущих клинических признаков болезни во взрослом состоянии ввиду их позднего манифестирования.
Надеемся, что представленная информация расширит представление о синдроме «голубых склер», поможет своевременной диагностике и выбору адекватной тактики ведения пациентов с данной наследственной патологией СТ, в том числе с привлечением врачей других специальностей.
Сведения об авторах:
Белецкая Татьяна Анатольевна — к.м.н., ассистент кафедры офтальмологии им. проф. М.А. Дмитриева с курсом ПО ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; врач-офтальмолог КГБУЗ «ККОКБ им. профессора П.Г. Макарова»; 660022, Россия, г. Красноярск, ул. Никитина, д. 1в; ORCID iD 0000-0002-9007-5086.
Козина Елена Владимировна — д.м.н., доцент, заведующая кафедрой офтальмологии им. проф. М.А. Дмитриева с курсом ПО ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0001-9002-0969.
Дмитренко Диана Викторовна — д.м.н., доцент, заведующая кафедрой медицинской генетики и клинической нейрофизиологии ИПО ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0003-4639-6365.
Гаврилова Юлия Игоревна — врач-офтальмолог КГБУЗ «ККОКБ им. профессора П.Г. Макарова»; 660022, Россия, г. Красноярск, ул. Никитина, д. 1в; ORCID iD 0000-0003-2111-347X.
Контактная информация: Гаврилова Юлия Игоревна, e-mail: j.gavrilova@bk.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 13.02.2022.
Поступила после рецензирования 11.03.2022.
Принята в печать 05.04.2022.
About the authors:
Tat’yana A. Beletskaya — C. Sc. (Med.), assistant of the Prof. M.A. Dmitriev Department of Ophthalmology with the Course of Postgraduate Education, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; Prof. P.G. Makarov Krasnoyarsk Regional Ophthalmological Clinical Hospital; 1V, Nikitin str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-9007-5086.
Elena V. Kozina — Dr. Sc. (Med.), Associate Professor, Head of the Prof. M.A. Dmitriev Department of Ophthalmology with the Course of Postgraduate Education, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0001-9002-0969.
Diana V. Dmitrenko — Dr. Sc. (Med.), Associate Professor, Head of Department of Medical Genetics and Clinical Neurophysiology of the Institute of Postgraduate Education, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0003-4639-6365.
Yuliya I. Gavrilova — ophthalmologist, Prof. P.G. Makarov Krasnoyarsk Regional Ophthalmological Clinical Hospital; 1V, Nikitin str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0003-2111-347X.
Contact information: Yuliya I. Gavrilova, e-mail: j.gavrilova@bk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 13.02.2022.
Revised 11.03.2022.
Accepted 05.04.2022.
материал rmj.ru
