Введение
Макулярные разрывы (МР) характеризуются высокой частотой встречаемости и являются распространенной причиной низкого зрения [1].
С 1997 г. стандартом в лечении МР являлась витрэктомия с удалением внутренней пограничной мембраны (ВПМ) сетчатки [2]. Позже в литературе стала появляться информация о разрушительном влиянии пилинга ВПМ на морфологию и физиологию сетчатки. Известны такие осложнения, как эктопия фовеолы к диску зрительного нерва (ДЗН), послеоперационный отек слоя нервных волокон сетчатки с последующей отдаленной диссоциацией слоя нервных волокон зрительного нерва, уменьшение толщины сетчатки, сокращение папиллофовеолярного расстояния [3–8]. Описано негативное влияние пилинга на светочувствительность (СЧ) сетчатки с формированием абсолютных скотом [9–13].
Для минимизации травмирующего воздействия на сетчатку были предложены способы лечения МР с неполным удалением ВПМ, формированием инвертируемого лоскута ВПМ при минимальной площади пилинга и сохранением точки зрительной фиксации (ТЗФ) [14–16].
Была предложена технология лечения сквозных МР без пилинга ВПМ [13]. Такая тактика лечения имеет ряд ограничений, несет повышенные риски отрицательного анатомического исхода хирургического вмешательства, подразумевает применение пролонгированной тампонады витреальной полости (газом или силиконовым маслом) и дополнительных ферментных препаратов.
В последние годы в хирургии МР активно стали применяться различные препараты на основе аутокрови (обогащенная тромбоцитами аутоплазма (platelet rich plasma — PRP), плазмин, цельная венозная кровь, аутологичная кондиционированная плазма крови), в частности, широкое распространение получила PRP [17–21]. Ряд авторов предложили применять PRP в сочетании с аппликацией перфторорганического соединения (ПФОС) на область МР с тампонадой витреальной полости или без нее [22, 23].
Разнообразие предложенных модификаций хирургических техник не исключает рисков травмирования сетчатки, последующих дегенеративных изменений в результате пилинга ВПМ, развития послеоперационной катаракты, а также рисков незакрытия МР и неудовлетворительных функциональных результатов.
Обозначенная проблема делает актуальным поиск и разработку новых эффективных и безопасных способов хирургического лечения МР с оптимизацией этапа пилинга ВПМ.
Цель исследования: разработка нового минимально травматичного способа хирургического лечения первичных сквозных МР сетчатки с применением комбинации инвертированного фрагмента ВПМ и PRP без тампонады витреальной полости, а также изучение его анатомо-функциональной эффективности.
Содержание статьи
Материал и методы
Под наблюдением находились 23 пациента (23 глаза) с первичными МР с минимальным диаметром от 152 до 623 (337,9±147,5) мкм. Из них женщин — 18, мужчин — 5, возраст пациентов — от 53 до 73 лет (64,4±4,9 года).
Критерии включения: первичные сквозные МР, давность жалоб не более 1 года. Критерии исключения: предшествующая хирургия сетчатки, вторичные МР, миопия высокой степени (более 6 дптр и/или длина глаза более 26,0 мм), серьезная офтальмологическая или тяжелая общесоматическая патология.
Методы обследования включали рефрактометрию, визометрию, биометрию, тонометрию, офтальмосканирование, а также микропериметрию и спектральную оптическую когерентную томографию (СОКТ).
При расчете средних величин остроты зрения данные, полученные по стандартным таблицам (децимальные), пересчитывали для таблиц ETDRS.
При помощи СОКТ (Optovue Solix, США) предоперационно в режиме Line измеряли минимальный диаметр МР (минимальное расстояние между его краями). Благодаря функции Followup в послеоперационном периоде проводили повторное сканирование по тем же оптическим срезам. Кроме того, использовали протокол Angio Retina в режиме En-Face, который обеспечил визуализацию положения лоскута ВПМ на поверхности сетчатки, изменения поверхностных слоев сетчатки, а также изменения фоторецепторного слоя в послеоперационном периоде на различных сроках наблюдения.
По данным микропериметрии (MAIA CenterVue, Италия) определяли общую СЧ (СЧо, 10 градусов от точки фиксации), центральную СЧ (СЧц, 6 градусов от точки фиксации), ТЗФ, а также стабильность фиксации.
Предоперационная максимальная корригированная острота зрения (МКОЗ) составляла 0,3±0,1 (от 0,1 до 0,5) или 55,1±6,7 буквы ETDRS, СЧо — 24,2±2,5 дБ (от 16,9 до 27,9 дБ), СЧц — 22,1±2,6 дБ (от 17,5 до 26,9 дБ). В центре фовеа во всех случаях регистрировалась абсолютная скотома. У 10 пациентов определялась относительно нестабильная фиксация, у 13 фиксация оставалась стабильной. ТЗФ у всех исследуемых пациентов визуализировалась по верхнему краю разрыва.
Всем пациентам выполнили хирургическое лечение МР с использованием разработанной в нашей клинике хирургической техники [24]. Все операции были выполнены одним хирургом.
Хирургическая техника. В начале операции у пациента осуществляли забор венозной крови. PRP получали с использованием пробирок YCELLBIO-KIT с добавлением 1,5 мл цитрата натрия путем центрифугирования крови в течение 8 мин при скорости 3600 оборотов/мин. После окончания центрифугирования проводили забор фракции с высоким содержанием лейкоцитов (Leukocyte-PRP — L-PRP), которую использовали в ходе хирургического вмешательства для фиксации инвертированного лоскута ВПМ к сетчатке [20, 21].
Выполняли 3-портовую 27G субтотальную витрэктомию с использованием Membran Blue для окрашивания ВПМ. Со стороны верхневисочной сосудистой аркады в 2–3 движения в горизонтальном направлении удаляли линейный участок ВПМ шириной 0,1–0,2 мм и длиной около 1,5 мм на расстоянии 2,0–2,5 мм от края МР, формируя верхний край лоскута ВПМ, который приподнимали и отделяли от сетчатки в направлении сверху вниз (в сторону нижневисочной сосудистой аркады), поочередно перехватывая край ВПМ микропинцетом с назальной и темпоральной стороны, чтобы минимизировать риск продольного разрыва лоскута к макулярному отверстию. Полученный инвертируемый однослойный фрагмент ВПМ отсепаровывали от сетчатки до горизонтальной линии, проходящей по касательной к верхнему краю ДЗН (линия инверсии), далее переворачивали его и внутренней стороной укладывали на МР, тем самым блокируя его (на данном этапе без ПФОС). Остальные участки сетчатки, в том числе в проекции папилломакулярного пучка, оставляли интактными. Далее выполняли замену жидкости на воздух. При подсушивании сетчатки контролировали правильное положение инвертированного лоскута ВПМ и его адгезию, наблюдая характерное бликование его поверхности в среде воздуха. Далее на поверхность инвертируемого лоскута ВПМ наносили 2–3 капли PRP. Выдерживали экспозицию в течение 1 мин для формирования фибриновой пленки [20]. Затем на поверхность инвертированного лоскута ВПМ вводили 1,5 мм3 ПФОС для создания равномерной клеевой пленки и ее прижатия к поверхности сетчатки. Через 5–7 мин из витреальной полости удаляли ПФОС, затем заменяли воздух на сбалансированный солевой раствор (balanced salt solution). Тампонаду витреальной полости не проводили (рис. 1).
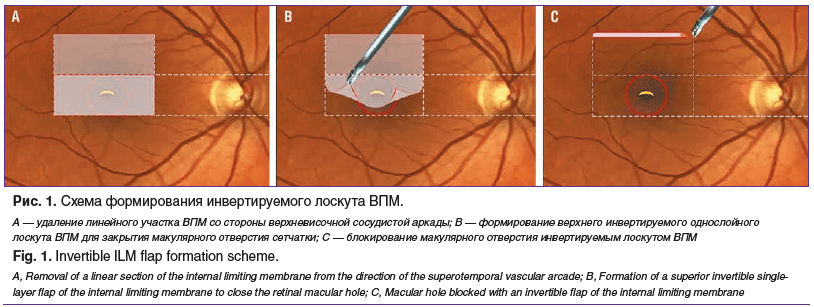
Сроки наблюдения составили 1, 3, 6 мес. после операции.
Статистическую обработку результатов исследования проводили с использованием программ Excel (Microsoft) и Statistica 13.3 (Tibco Software Inc., США). Для определения нормальности распределения использовали критерии Колмогорова — Смирнова и Шапиро — Уилка. Изменения в динамике оценивали с использованием парного t-теста Стьюдента (для нормального распределения) и критерия Уилкоксона (для ненормального распределения). При расчете средних величин остроты зрения данные, полученные по стандартным таблицам (децимальные), пересчитывали для таблиц ETDRS. Количественные данные МКОЗ, букв ETDRS, СЧо, СЧц представлены в виде M±m, где M — среднее арифметическое, m — стандартная ошибка среднего арифметического, поскольку в настоящей работе для анализа результатов важно было оценить средние значения, а не разброс анализируемых показателей.
Результаты исследования
Интраоперационно ни у кого из пациентов осложнений не наблюдалось. На следующий день после операции на СОКТ-снимках визуализировалась тромбоцитарно-фибриновая пленка, находящаяся поверх инвертированного лоскута ВПМ, блокирующего макулярное отверстие. В просвете макулярного отверстия элементов тромбоцитарно-фибринового сгустка не наблюдалось ни в одном случае.
На 2–3-и сутки после операции у 4 (17,4%) пациентов наблюдался ранний лизис фибриновой пленки, который в 2 (8,6%) случаях привел к незакрытию МР (рис. 2), а еще в 2 (8,6%) случаях разрыв остался блокирован инвертированным фрагментом ВПМ (рис. 3).
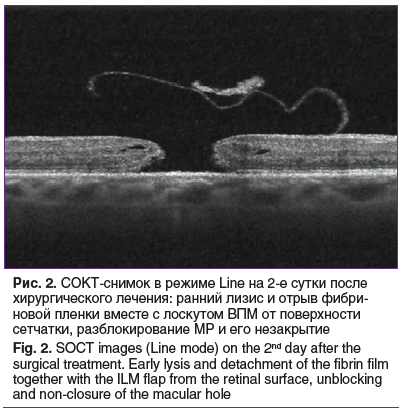
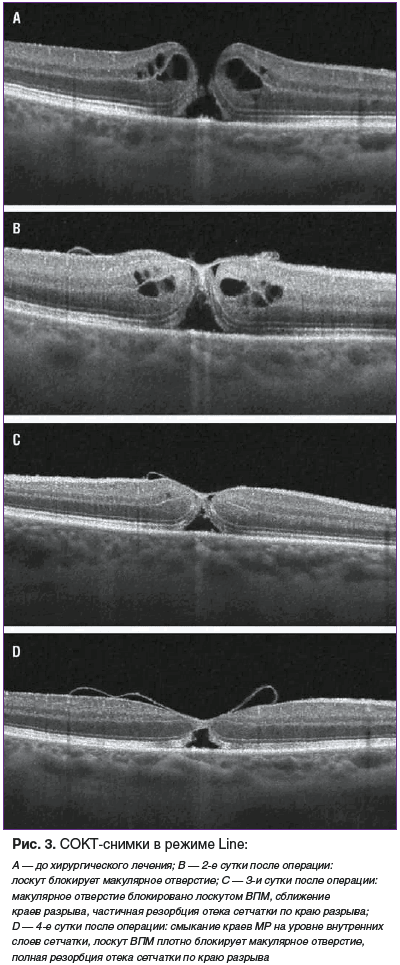
Двум пациентам с незакрытием МР сразу было проведено повторное хирургическое вмешательство с репозицией лоскута ВПМ, фиксацией лоскута при помощи PRP и тампонадой витреальной полости воздухом. Через 1 мес. после повторной операции у них регистрировали закрытие макулярного отверстия.
По данным СОКТ, через 1 мес. после первичного вмешательства у всех остальных пациентов произошло закрытие сквозных МР с сохранением локальной дезорганизации или гипорефлективного дефекта в эллипсоидной зоне фоторецепторов. Наружная пограничная мембрана была сохранена на всем протяжении, имела непрерывный ровный профиль. Произошло купирование отека по краю разрыва. При помощи режима EnFace четко визуализировали инвертированный лоскут ВПМ, блокирующий макулярное отверстие (рис. 4). На всех сроках послеоперационного наблюдения, по данным СОКТ, размер дефекта эллипсоидной зоны сетчатки постепенно уменьшался.
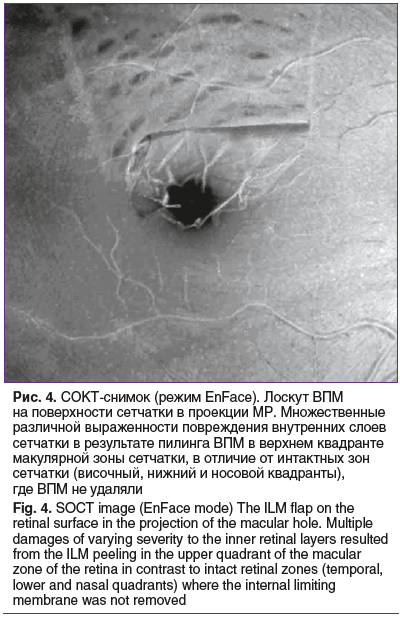
Уже на ранних сроках послеоперационного наблюдения у всех пациентов отмечалось уменьшение количества жалоб.
Данные функциональных исследований до и после хирургического лечения представлены в таблице.
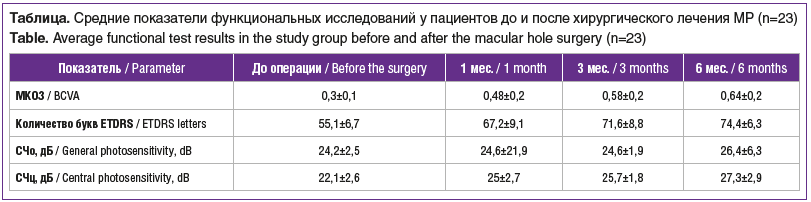
Через 1 мес. у 17 (73,9%) пациентов выявлено повышение МКОЗ: в 4 случаях — на 0,1, в 2 — на 0,2, в 6 — на 0,3, в 2 — на 0,4, в 3 — на 0,5. У 6 пациентов острота зрения существенно не изменилась. Средние значения МКОЗ составили 0,48±0,2 (от 0,2 до 0,8) или 67,2±9,1 буквы ETDRS. Через 3 мес. зарегистрировано увеличение МКОЗ в 14 случаях: у 9 пациентов — на 0,1, у 3 — на 0,2, у 2 — на 0,4. У остальных пациентов изменений МКОЗ не было, зрительные функции оставались стабильными. Через 6 мес. после операции у 19 пациентов значения МКОЗ оставались стабильными, а у 4 — МКОЗ повысилась (в 2 случаях — на 0,2, в 1 — на 0,4, в 1 — на 0,5).
За весь период наблюдения было зафиксировано постепенное повышение СЧц и СЧо. Через 1 мес. СЧ сетчатки в фовеа повысилась у всех пациентов, абсолютная скотома перестала определяться, фиксация у всех пациентов стала стабильнее, ТЗФ сдвинулась к центру фовеа. К 6-му месяцу наблюдения во всех случаях фиксация была стабильной, СЧц и СЧо увеличились по сравнению с предыдущими сроками наблюдения.
За период наблюдения у 21 из 23 пациентов развилась катаракта, в связи с чем была выполнена факоэмульсификация катаракты с имплантацией интраокулярной линзы. Функциональные результаты хирургического лечения МР оценивались при прозрачных оптических средах через 1 мес. после хирургии катаракты.
Обсуждение
В разные годы были предложены разнообразные способы хирургического лечения МР, с различными зонами и площадью пилинга ВПМ, с применением PRP и без, но в каждом из них обязательным этапом являлась тампонада витреальной полости воздушной или газовоздушной смесью [14, 15, 23].
Кроме того, при применении хирургических техник с формированием лоскута ВПМ для блокирования МР достижение стабильного положения лоскута ВПМ требует тщательного удаления жидкости из витреальной полости и подсушивания сетчатки в среде воздуха в функционально значимой области глазного дна, а именно области ДЗН и папилломакулярного пучка. Чрезмерное длительное высушивание может приводить к повреждению сетчатки инструментами и описанному в литературе синдрому внезапного снижения зрения, включающему центральную скотому и падение периферической СЧ сетчатки в сочетании со снижением толщины внутренних слоев сетчатки (слоя ганглиозных клеток сетчатки и слоя нервных волокон) [25, 26].
Это обусловлено тем, что именно в области папилломакулярного пучка нервных волокон находится «свободный» инвертированный край лоскута ВПМ, со стороны которого удаляется жидкость с поверхности сетчатки и с поверхности лоскута. Все это требует максимально аккуратного «высушивания» витреальной полости и поверхности сетчатки для достижения плотной адгезии лоскута ВПМ, которая возможна лишь при удалении базиса стекловидного тела в максимальном объеме, что, в свою очередь, также увеличивает продолжительность операции [27] и добавляет риск ятрогенных альтераций указанных анатомических структур. Это может негативно отразиться на конечном функциональном результате оперативного лечения.
Формирование лоскута ВПМ с височной стороны также нецелесообразно из-за возможности его смещения вниз или обратного разворота (ретроверсии) под силой тяжести при принятии пациентом вертикального положения и под действием стекающих по поверхности сетчатки сверху вниз остатков базиса стекловидного тела и внутриглазной жидкости, которая непрерывно продуцируется цилиарным телом глазного яблока. Возникающие риски смещения лоскута в сторону нижневисочной сосудистой аркады могут приводить к разблокированию разрыва и рецидиву (незакрытию МР), к повторной операции и снижению конечного функционального результата оперативного лечения [28].
По данным литературы, одним из основных недостатков газовой тампонады являются ограничения в подъемах на высоту (от 15-го этажа высотного здания) [29]. Кроме того, неотъемлемым условием такого вмешательства является позиционирование пациента лицом вниз после операции, что не всегда возможно из-за определенного общесоматического и умственно-эмоционального состояния пациента, а также ухудшает реабилитацию пациента из-за длительного отсутствия зрения после вмешательства [30].
На наш взгляд, в хирургическом лечении первичных МР перспективно применение предложенной нами хирургической техники с частичным удалением ВПМ сетчатки. Исключение послеоперационной тампонады витреальной полости за счет фиксации лоскута ВПМ при помощи PRP позволяет не располагать обязательно пациента лицом вниз даже на короткий период, обеспечивает ранний контроль анатомического результата лечения и, в отличие от газовой тампонады, делает возможным подъем на высоту (использование авиатранспорта) сразу после хирургического лечения, а также ускоряет послеоперационную реабилитацию пациентов.
Предложенная нами методика не только обладает рядом преимуществ, но и показывает высокую анатомическую и функциональную эффективность. Сохранение ТЗФ, отсутствие механического воздействия на края разрыва и зону папилломакулярного пучка позволили добиться высокого функционального результата, о чем свидетельствуют данные МКОЗ и микропериметрии, по результатам которой в послеоперационном периоде у всех пациентов отмечен прирост светочувствительности сетчатки и исчезновение абсолютной скотомы в центре фовеа. Так, МКОЗ в группе наблюдения увеличилась в среднем с 0,3±0,1 до 0,64±0,2 к концу периода наблюдения, а средние значения СЧц повысились с 22,1±2,6 до 27,3±2,9 дБ.
В работах А.Ю. Клейменова и соавт. [29] были описаны сопоставимые функциональные результаты с увеличением МКОЗ до 0,33±0,04 к 3 мес. наблюдения и до 0,5±0,05 к 1 году наблюдения.
Настоящее исследование имеет ряд ограничений: группа наблюдения была относительно небольшой, не проведен анализ отдаленных результатов лечения (1 год и более). Необходима контрольная группа для сравнительной оценки клинической эффективности разработанной методики. Однако имеющиеся данные достаточно показательны и демонстрируют безопасность и перспективы предложенной методики.
Заключение
Предложенная методика хирургического лечения МР обеспечивает высокий функциональный результат на фоне минимального травмирующего воздействия на сетчатку в ходе оперативного вмешательства.
Применение указанной методики может повысить функциональную эффективность хирургического лечения первичных МР, но в перспективе требуется продолжение исследований в этом направлении на достаточном клиническом материале для получения точных и достоверных данных.
Сведения об авторах:
Шилов Николай Михайлович — к.м.н., заведующий отделением хирургии катаракты Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. им. Святослава Федорова, д. 5; ORCID iD 0000-0002-2392-3049
Терещенко Александр Владимирович — д.м.н., директор Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. им. Св. Федорова, д. 5; профессор кафедры хирургии Медицинского института КГУ им. К.Э. Циолковского; 248023, Россия, г. Калуга, ул. Степана Разина, д. 26; ORCID iD 0000-0002-0840-2675
Плахотний Михаил Алексеевич — к.м.н., заведующий оперблоком Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. им. Св. Федорова, д. 5; ORCID iD 0000-0002-4099-819X
Юдина Нина Николаевна — к.м.н., заведующая отделением витреоретинальной хирургии Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. им. Св. Федорова, д. 5; ORCID iD 0000-0002-2135-8162
Новиков Сергей Васильевич — врач-офтальмолог Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. им. Св. Федорова, д. 5; ORCID iD 0000-0003-4953-4663
Кабулдинова Сания Жумакелдыевна — врач-офтальмолог Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. им. Св. Федорова, д. 5; ORCID iD 0009-0008-9333-5630
Контактная информация: Новиков Сергей Васильевич, e-mail: nauka@mntk.kaluga.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 25.12.2024.
Поступила после рецензирования 27.01.2025.
Принята в печать 19.02.2025.
About the authors:
Nikolai M. Shilov — C. Sc. (Med.), Head of the Department of Cataract Surgery, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fyodorov str., Kaluga, 248007, Russian Federation; ORCID iD 0000-0002-2392-3049
Alexander V. Tereshchenko — Dr. Sc. (Med.), Director, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fyodorov str., Kaluga, 248007, Russian Federation; professor of the Surgery Department of Medical Institute, Kaluga State University named after K.E. Tsiolkovski; 26, Stepan Razin st., Kaluga, 248023, Russian Federation; ORCID iD 0000-0002-0840-2675
Mikhail A. Plakhotnii — C. Sc. (Med.), Head of the Surgery Unit, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fyodorov str., Kaluga, 248007, Russian Federation; ORCID iD 0000-0002-4099-819X
Nina N. Yudina — C. Sc. (Med.), Head of the Department of Vitreoretinal Surgery, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fyodorov str., Kaluga, 248007, Russian Federation; ORCID iD 0000-0002-2135-8162
Sergei V. Novikov — Ophthalmologist, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fyodorov str., Kaluga, 248007, Russian Federation; ORCID iD 0000-0003-4953-4663
Saniya Zh. Kabuldinova — Ophthalmologist, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fyodorov str., Kaluga, 248007, Russian Federation; ORCID iD 0009-0008-9333-5630
Contact information: Sergei V. Novikov, e-mail: nauka@mntk.kaluga.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 25.12.2024.
Revised 27.01.2025.
Accepted 19.02.2025.
материал rmj.ru
