Введение
Неоваскулярная форма возрастной макулярной дегенерации (нВМД) — заболевание, связанное с патологическим ростом сосудов из сосудистой оболочки через мембрану Бруха в пространство под пигментным эпителием сетчатки или субретинальное пространство в макулярной области. Несмотря на успехи в терапии нВМД в течение последних 10–15 лет, это заболевание по-прежнему остается частой причиной слабовидения у пожилых пациентов. Одной из важных проблем в лечении нВМД является баланс между анатомо-функциональным улучшением и организационной нагрузкой edа участников процесса лечения. Другими словами, для достижения стабильного улучшения необходимы частые и регулярные интравитреальные инъекции, что увеличивает объем работы врача, частоту визитов пациента в лечебное учреждение и вовлеченность родственников в лечение. В связи с изменениями эпидемиологической обстановки из-за появления новых штаммов SARS-CoV-2 доступность специализированной медицинской помощи существенно ограничена, включая возможность планового проведения интравитреальных инъекций [1, 2].
В этих условиях становится очевидной польза внедрения препаратов с пролонгированным действием, в частности препарата бролуцизумаб, который может вводиться пациенту с частотой 1 раз в 12 нед., что в 1,5 раза реже по сравнению с текущим стандартом лечения. Бролуцизумаб представляет собой одноцепочечный фрагмент гуманизированного антитела (ScFv, single-chain variable fragment) с молекулярной массой 26 кДа, который является наименьшей функциональной единицей антитела. Это позволяет вводить в одной дозе большее количество препарата, чем при применении зарегистрированных ранее антител к фактору роста эндотелия сосудов (VEGF), c потенциальной возможностью более длительного дейст вия и более высокой пенетрацией в ткани. Бролуцизумаб с высокой аффинностью связывается с различными изоформами VEGF-A (в частности, с VEGF110, VEGF121 и VEGF165), тем самым препятствуя связыванию VEGF-A с его рецепторами (VEGFR-1 и VEGFR-2) [3, 4]. Бролуцизумаб был одобрен для клинического применения в лечении нВМД на территории России в конце 2020 г. и стал применяться в клинической практике с середины 2021 г. Однако на сегодняшний день в России отсутствуют собственные данные по безопасности и эффективности применения данного препарата. Кроме того, если эти показатели у пациентов, ранее не получавших лечение, подробо изучены в многоцентровых исследованиях, то у пациентов, резистентных к ранее проводившейся терапии, они исследованы недостаточно.
Цель исследования: оценить эффективность и безопасность применения препарата бролуцизумаб у российской популяции пациентов с нВМД.
Материал и методы
Проспективное интервенционное исследование было проведено на базе кафедры офтальмологии им. проф. В.В. Волкова Военно-медицинской академии
им. С.М. Кирова. В исследование было включено 47 пациентов: 13 пациентов, ранее не получавших антиангиогенное лечение (1-я группа), и 34 пациента с активностью нВМД на фоне ранее проводившейся антиангиогенной терапии (2-я группа). Критериями включения были диагноз нВМД с любым типом хориоидальной неоваскуляризации, затрагивающей фовеальную область, и выполнение не менее
2 инъекций препарата бролуцизумаб. Критериями исключения были наличие иной сопутствующей ретинальной патологии (включая окклюзии вен сетчатки), снижение прозрачности оптических сред, способное повлиять на результаты оптической когерентной томографии (ОКТ), а также внутриглазное воспаление в анамнезе.
В се пациенты прошли стандартное офтальмологическое обследование и ОКТ на момент включения в исследование, а в дальнейшем — при каждом ежемесячном визите в клинику для контроля и проведения очередной инъекции. В ходе офтальмологического обследования особое внимание уделяли выявлению признаков внутриглазного воспаления в виде цитоза во влаге передней камеры, витреита и васкулита сосудов сетчатки. ОКТ проводили на аппарате RTVue-XR (Optovue, США). Дополнительно статус цитоза во влаге переднеЦ 9 камеры был исследован с помощью ОКТ переднего сегмента протоколом сканирования 3D-Cornea по ранее описанной методике [5]. Также все пациенты прошли дополнительное обследование с помощью сканирующей лазерной офтальмоскопии (F-10, NIDEK, Япония) с целью оценки воспалительной реакции в стекловидном теле.
Оптическая когерентная томография включала получение макулярной карты с дальнейшим извлечением из нее показателей центральной толщины сетчатки (ЦТС) и макулярного объема (МО). Кроме того, путем просмотра всех структурных сканов макулярной карты определяли наличие какого-либо из типов жидкости: жидкости под пигментным эпителием сетчатки (ПЭС), субретинальной жидкости (СРЖ) или интраретинальной жидкости (ИРЖ). ИРЖ определяли как наличие гипорефлективных округлых полостей в нейросенсорной сетчатке по крайней мере на одном кросс-секционном ска edе. СРЖ определяли как гипорефлективное пространство между нейросенсорной сетчаткой и ПЭС как минимум на одном кросс-секционном скане. Жидкость под ПЭС определяли как гипорефлективное пространство между мембраной Бруха и ПЭС. Для оценки активности заболевания также анализировали кумулятивную частоту встречаемости различных типов жидкости у каждого пациента, под которой подразумевали сочетание типов жидкости в одном глазу и изменение этого сочетания на фоне лечения.
Для статистической обработки данных использовали программный пакет MedCalc 18.4.1 (MedCalc Software, Бельгия). Данные представлены как среднее ± стандартное отклонение. Однофакторный дисперсионный анализ с повтор e5ниями использовали для оценки статистической значимости различий ОЗ до лечения и после выполнения
2 инъекций. Статистическую значимость изменения частоты обнаружения ИРЖ, СРЖ и жидкости под ПЭС оценивали с помощью теста χ2. Кумулятивную частоту встречаемости различных типов жидкости сравнивали с помощью теста Вилкоксона. Разницу считали статистически значимой при р<0,05.
Результаты исследования
Всего в исследование было включено 47 пациентов, разделенных на 2 группы. В 1-ю группу вошли 13 пациентов (13 глаз), ранее не получавших антиангиогенное лечение: 12 мужчин и 1 женщина, средний возраст которых составил 72,4±9,5 года, средняя ОЗ 0,43±0,32 (28,4±20,4 знака таблицы ETDRS) и ЦТС 331,0±99,2 мкм. Во 2-ю группу вошли 34 пациента (34 глаза) с активностью нВМД на фоне ранее проводившейся антиангиогенной терапии (пациенты получили 9,4±5,5 инъекции за 17,3±6,1 мес.,
соблюдая режим pro re nata): 25 мужчин и 9 женщин, средний возраст 74,1±8,0 года, средняя ОЗ 0,46±0,25 (34,3±14,1 знака таблицы ETDRS), ЦТС 293,5±73,8 мкм.
Среди пациентов 1-й группы 11 больных получили по 2 инъекции, 9 пациентов — по 3 инъекции препарата. Среди пациентов 2-й группы 29 больных получили по 2 инъекции, 10 пациентов — по 3 инъекции. Таким образом, всего было выполнено 137 инъекций.
За период исследования не было зарегистрировано серьезных нежелательных явлений, связанных с внутриглазным воспалением. У 1 пациента был выявлен витреит легкой степени тяжести, обнаруженный через 2 дня после первой инъекции препарата бролуцизумаб, купированный однократной субконъюнктивальной инъекцией 0,1% раствора дексаметазона и инстилляциями местного стероидного препарата в течение 3 сут, после чего пациент продолжил лечение тем же препаратом.
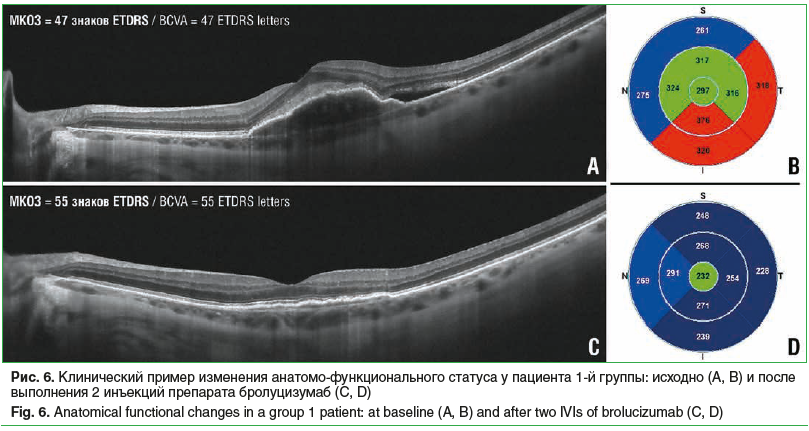
Среди пациентов 1-й группы, которые получили по 2 инъекции (11 больных), ОЗ исходно, после 1-й и 2-й инъекций составила 34,9±6,6, 41,4±5,1 и 44,1±4,2 знака таблицы ETDRS соответственно, со статистически значимой тенденцией к увеличению (p=0,02) (рис. 1А). Было обнаружено статистически значимое снижение показателей ЦТС с 317,8±26,0 мкм до 272,8±47,1 мкм и до 236,4±18,3 мкм (p=0,05) (рис. 2А), а также статистически значимое уменьшение МО (p=0,04) с 6,24±0,42 мм3 до 5,4±0,12 мм3 и до 5,27±0,12 мм3 (рис. 3А) исходно, после 1-й и 2-й инъекций соответственно. Частота обнаружения ИРЖ исходно, после 1-й и 2-й инъекций соответственно составила 15,4, 9,1 и 0,0% (p=0,22). Частота обнаружения жидкости под ПЭС исходно, после 1-й и 2-й инъекций соответственно составила 76,9, 36,3 и 11,1% (p=0,002). Частота обнаружения СРЖ исходно, после 1-й и 2-й инъекций соответственно составила 100,0, 36,3 и 11,1% (p<0,0001) (рис. 4А). Анализ кумулятивной частоты встречаемости различных типов жидкости показал статистически значимое снижение медианного значения с 2 до 0 (p=0,004) (рис. 5А, 6).
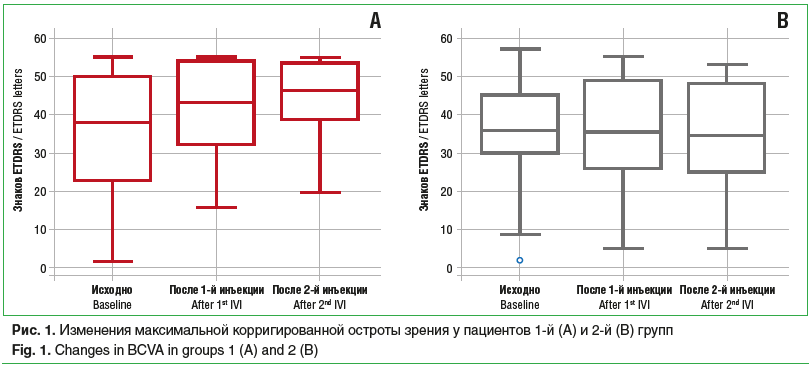
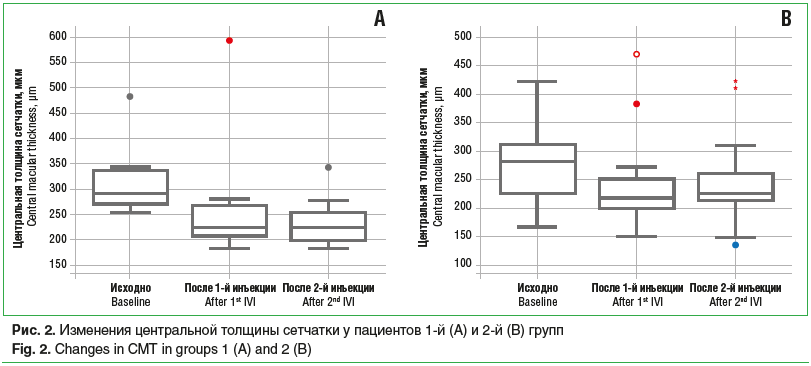
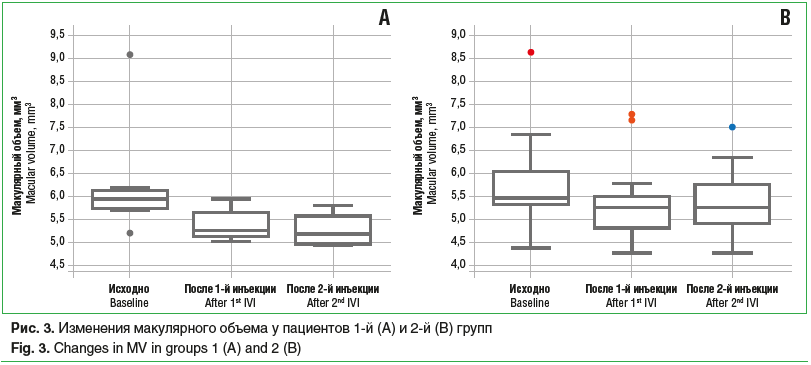
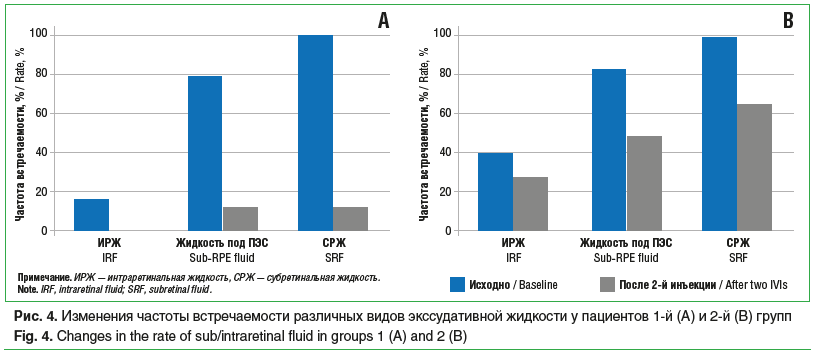
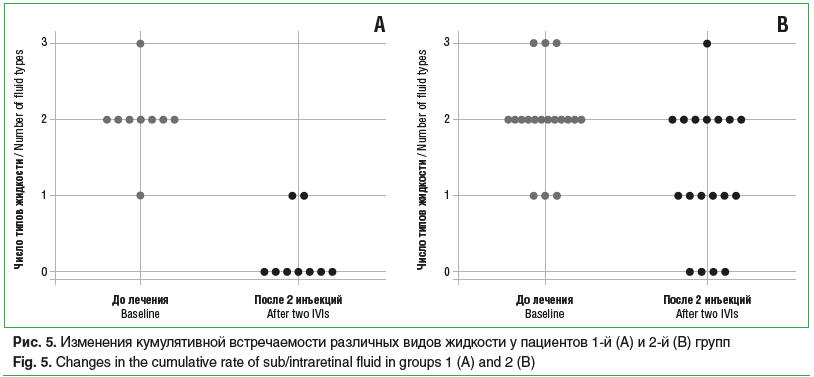
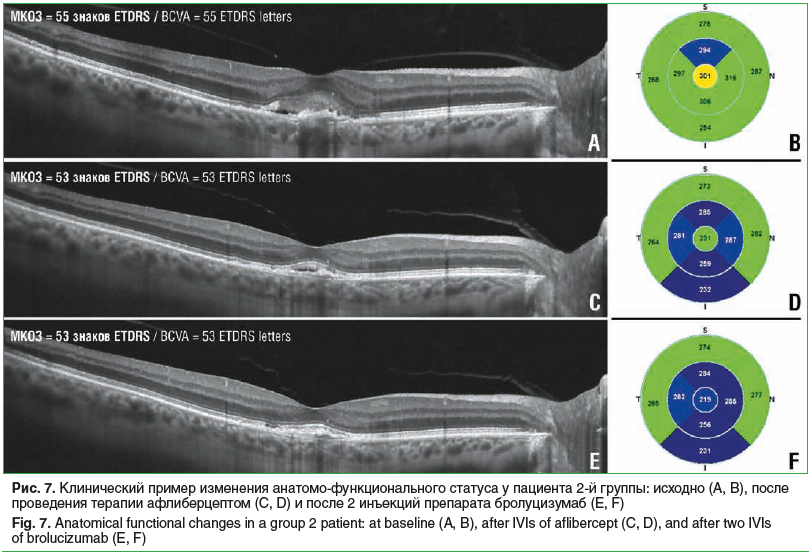
Во 2-й группе пациентов, получивших по 2 инъекции, ОЗ исходно, после 1-й и 2-й инъекций соответственно составила 35,0±3,5, 36,0±3,5 и 33,8±3,7 знака таблицы ETDRS, без статистически значимой тенденции к изменению (p>0,05) (рис. 1В). Не было отмечено статистически значимой тенденции в снижении показателя ЦТС (p=0,06), который составил исходно, после 1-й и 2-й инъекций 276,7±16,8, 238,2±19,1 и 245,2±18,3 мкм соответственно (рис. 2В). Статистически значимая тенденция (p=0,04) была выявлена для изменения МО, который составил 5,76±0,23, 5,35±0,2 и 5,37±0,17 мм3 исходно, после 1-й и 2-й инъекций соответственно (рис. 3В). Частота обнаружения ИРЖ исходно, после 1-й и 2-й инъекций соответственно составила 38,2, 11,5 и 26,3% (p>0,05). Частота обнаружения жидкости под ПЭС исходно, после 1-й и 2-й инъекций соответственно составила 82,4, 56,0 и 47,4% (p>0,05). Частота обнаружения субретинальной СРЖ исходно, после 1-й и 2-й инъекций соответственно составила 97,1, 42,3 и 63,2% (p>0,05) (рис. 4В). Анализ кумулятивной частоты встречаемости различных типов жидкости показал статистически значимое снижение медианного значения с 2 до 1 (p=0,013) (рис. 5В и 7).
Обсуждение
Мы проанализировали первый собственный опыт применения препарата бролуцизумаб для лечения нВМД у пациентов, ранее не получавших лечение или демонстрирующих активность заболевания на фоне ранее проводившейся терапии. В данное исследование были включены пациенты, которым было выполнено по 2 инъекции, что продиктовано необходимостью получить как можно более ранние результаты в условиях начала широкого клинического применения бролуцизумаба на территории России. Исследование показало существенное анатомическое и функциональное улучшение у пациентов 1-й групы, что проявлялось существенным снижением ЦТС, МО и увеличением ОЗ. Мы обнаружили выраженное снижение частоты встречаемости различных типов жидкости, в том числе статистически значимое снижение кумулятивной встречаемости (сочетания) различных типов жидкости, стремящееся к ну ebю, что можно интерпретировать как тенденцию к полному подавлению активности заболевания. Среди пациентов 1-й группы статистически значимые различия не были достигнуты для изменения частоты встречаемости ИРЖ из-за малого числа наблюдений, поскольку исходно только 2 пациента демонстрировали этот признак. Однако следует подчеркнуть, что после 2 инъекций ни в одном случае этот вид жидкости не определялся. Среднее увеличение ОЗ в нашем исследовании среди пациентов 1-й группы составило около 1 строки.
Эти данные соответствуют анатомо-функциональным показателям и их динамике в регистрационных клинических исследованиях эффективности и безопасности препарата бролуцизумаб HAWK [6] и HARRIER [7]: среднее увеличение ОЗ на 6 знаков и снижение ЦТС на 160–180 мкм к 3 мес. от начала лечения после выполнения 2 инъекций. Кроме того, наши данные соответствуют результатам исследований HAWK [6] и HARRIER [7] в отношении подавления активности заболевания по частоте встречаемости различных типов жидкости: к концу периода исследования (96 нед.) частота встречаемости ИРЖ или СРЖ составила 24%, что на 35–37% меньше по сравнению с таковыми при применении препарата афлиберцепт, а частота встречаемости жидкости под ПЭС составила 11–17%, что на 23–27% меньше, чем на фоне терапии афлиберцептом.
С ростом числа исследований в области терапии нВМД стала понятна роль оценки различных типов жидкости и ЦТС по данным ОКТ, что нашло отображение в 2021 г. в федеральных клинических рекомендациях «Макулярная дегенерация возрастная» [8] как подход к оценке активности заболевания. Согласно изменениям анатомические параметры, наряду с ОЗ, являются ключевыми факторами активности заболевания, используемыми для мониторинга эф f4ективности терапии и принятия решения о начале/возобновлении лечения пациента с ВМД. Признаками активности заболевания могут быть снижение ОЗ вследствие данного состояния и/или ухудшение анатомических параметров: появление макулярных геморрагий (в том числе геморрагических отслоек ПЭС или нейросенсорной сетчатки) и/или efоявление/увеличение скопления ИРЖ (отека нейросенсорной сетчатки), и/или появление/увеличение скопления СРЖ (отслойки нейросенсорной сетчатки), и/или появление/усиление экстравазального выхода красителя при флюоресцентной ангиографии.
Несмотря на относительно длительное применение препарата бролуцизумаб в клинической практике в США, данных о его эффективности и безопасности у пациентов, ранее получавших лечение, все еще мало. В то же время эта когорта будет наиболее обширной в начале применения препарата на территории России, и эти данные представляются достаточно ценными для реальной клинической практики.
В нашем исследовании мы проанализировали показатели пациентов, ранее получавших лечение препаратом афлиберцепт, которые демонстрировали активность заболевания наличием различных типов жидкости. В этой группе пациентов мы не выявили статистически значимого снижения частоты встречаемости каждого из типов жидкости по отдельности, хотя численные показатели снизились по каждому из них на 12–35%, что в целом соответствует динамике частоты встречаемости различных типов жидкости, показанной ранее в исследованиях HAWK [6] и HARRIER [7]. Отсутствие статистически значимых различий можно объяснить недостаточным числом наблюдений. Однако следует отметить, что кумулятивная частота встречаемости различных типов жидкости продемонстрировала статистически значимое снижение. Также, хотя численные показатели ЦТС демонстрировали снижение, к 3 мес. наблюдения оно оказалось статистически незначимым. В то же время статистически значимую тенденцию к уменьшению показал МО, что, вероятно, говорит о большей ценности этого показателя в оценке ранней динамики при переводе таких пациентов на лечение препаратом бролуцизумаб. За 3-месячный период наблюдения мы не обнаружили существенных изменений ОЗ, что, с одной стороны, может быть объяснено малым числом выполненных инъекций, а с другой — выраженными анатомическими изменениями за предшествующий период лечения (без полного подавления активности заболевания). Эти данные также могут указывать на потенциальные преимущества раннего полного подавления активности заболевания более эффективным препаратом по сравнению с переводом на такой препарат в случае резистентности заболевания к ранее проводившемуся лечению.
В этом краткосрочном исследовании мы не столкнулись с тяжелыми нежелательными реакциями в виде внутриглазного воспаления, хотя, по данным ранее выполненных исследований, их частота в реальной клинической практике может составлять около 2,4% [9]. В реальной клинической практике уровень риска развития внутриглазного воспаления был повышен у пациентов с предшествующими его эпизодами. Если рассматрива ть единственный случай витреита легкой степени тяжести, купированный приемом местного стероидного препарата, как внутриглазное воспаление, вызванное интравитреальной инъекцией, то частота нежелательных явлений в нашем исследовании составляет 2,1%.
Ограничениями данного исследования являются небольшое чи сло включенных случаев и короткий срок наблюдения, однако все пациенты проходили обследование с помощью методов мультимодальной диагностики, и мы можем рассчитывать, что ни один, даже самый легкий, случай внутриглазного воспаления, кроме описанного выше, не был пропущен.
Заключение
По результатам проведенного нами исследования, несмотря на короткий период наблюдения и малое число выполненных интравитреальных инъекций бролуцизумаба, пациенты 1-й группы демонстрировали существенное улучшение анатомо-функциональных показателей, полностью соответствующее полученным ранее результатам в зарубежных многоцентровых исследованиях. При этом пациенты 2-й группы продемонстрировали существенное снижение активности заболевания с тенденцией к улучшению анатомических показателей, однако без статистически значимых функциональных изменений. Таким образом, полученные нами результаты доказывают необходимость дальнейших исследовиний у данной группы пациентов, а также, вероятно, преимущества раннего полного подавления активности заболевания по сравнению с подавлением активности после периода относительной резистентности к проводившемуся ранее антиангиогенному лечению.
Сведения об авторах:
Куликов Алексей Николаевич — д.м.н., профессор, начальник кафедры офтальмологии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Боткинская, д. 21; ORCID iD 0000-0002-5274-6993.
Мальцев Дмитрий Сергеевич — д.м.н., заведующий отделением лазерной хирургии клиники офтальмологии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Боткинская, д. 21; ORCID iD 0000-0001-6598-3982.
Малафеева Анна Юрьевна — заведующая отделением витреоретинальной хирургии клиники офтальмологии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Боткинская, д. 21; ORCID iD 0000-0001-9957-1804.
Перминова Софья Михайловна — клинический ординатор клиники офтальмологии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Боткинская, д. 21; ORCID iD 0000-0001-5697-5630.
Жалимова Валерия Рафаэлевна — врач-офтальмолог клиники офтальмологии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Боткинская, д. 21; ORCID iD 0000-0001-8024-0300.
Васильев Александр Сергеевич — врач-офтальмолог клиники офтальмологии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Боткинская, д. 21; ORCID iD 0000-0002-0635-4438.
Казак Алина Алексеевна — клинический ординатор клиники офтальмологии Военно-медицинской академии
им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Боткинская, д. 21; ORCID iD 0000-0002-6855-2384.
Контактная информация: Мальцев Дмитрий Сергеевич, e-mail: glaz.med@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.02.2022.
Поступила после рецензирования 15.03.2022.
Принята в печать 07.04.2022.
About the authors:
Aleksey N. Kulikov — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, S.M. Kirov Military Medical Academy; 21, Botkinskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-5274-6993.
Dmitriy S. Maltsev — Dr. Sc. (Med.), Head of the Department of Laser Surgery of the Clinics of Ophthalmology, S.M. Kirov Military Medical Academy; 21, Botkinskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-6598-3982.
Anna Yu. Malafeeva — Head of Department of Vitreoretinal Surgery of the Clinics of Ophthalmology, S.M. Kirov Military Medical Academy; 21, Botkinskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-9957-1804.
Sof’ya M. Perminova — clinical resident of the Clinics of Ophthalmology, S.M. Kirov Military Medical Academy; 21, Botkinskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-5697-5630.
Valeria P. Zhalimova — ophthalmologist of the Clinics of Ophthalmology, S.M. Kirov Military Medical Academy; 21, Botkinskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-8024-0300.
Aleksandr S. Vasile’v — ophthalmologist of the Clinics of Ophthalmology, S.M. Kirov Military Medical Academy; 21, Botkinskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-0635-4438.
Alina A. Kazak — clinical resident of the Clinics of Ophthalmology, S.M. Kirov Military Medical Academy; 21, Botkinskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-6855-2384.
Contact information: Dmitriy S. Maltsev, e-mail: glaz.med@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 15.02.2022.
Revised 15.03.2022.
Accepted 07.04.2022.
.
материал rmj.ru
