Введение
Раннее выявление первичной открытоугольной глаукомы (ПОУГ) является одной из важнейших проблем в офтальмологии. Это обусловлено ее высокой распространенностью и угрозой прогрессирующего необратимого распада зрительных функций при далеко зашедших стадиях.
Риск развития ПОУГ значительно возрастает у пациентов с миопией высокой степени [1–6]. Так, A. Ha et al. [6] по результатам метаанализа показали, что на каждую диоптрию увеличения миопии риск формирования ПОУГ возрастает примерно на 20%. Подобного мнения придерживаются также J.B. Jonas et al. [2], которые показали, что увеличение переднезадней оси (ПЗО) глаз свыше 26,0–26,5 мм приводит к значительным гистологическим изменениям в диске зрительного нерва. Так, у пациентов с аксиальной длиной глаза более 33 мм, по их данным, распространенность глаукомной оптической нейропатии достигала 80%.
По мнению N.Y.Q. Tan et al. [7] и Y.X. Wang et al. [8], при увеличении аксиального размера глаза формируются изменения морфометрических параметров структур заднего отрезка, способные создавать дополнительные трудности в диагностике глаукомы у таких пациентов.
К настоящему времени большой пул пациентов с миопической рефракцией, которым в 1980–1990-е годы была выполнена передняя дозированная радиальная кератотомия (ПРК), достигли возраста 50–70 лет и старше. В связи с этим, соответственно, у этих пациентов увеличиваются возрастные риски развития ПОУГ, что особенно актуально при наличии миопии [9–12].
При этом офтальмологи столкнулись с характерными особенностями, затрудняющими оценку измерения уровня внутриглазного давления (ВГД) с помощью тонометра Маклакова у таких пациентов. Это отсутствие идеальной сферичности передней поверхности роговицы в сочетании с изменениями задней поверхности, обусловленные послабляющими насечками на ее периферии и уплощением центральной зоны [13, 14]. Кроме того, имеются данные о том, что у пациентов после ПРК снижаются биомеханические свойства роговицы [15–17]. И, наконец, у ряда пациентов с миопией уровень ВГД может иметь ложно-нормальные, т. е. статистически нормальные значения. Совокупность этих факторов способна дезориентировать офтальмолога, проводящего тонометрию, поскольку они значительно осложняют объективную оценку уровня ВГД у пациентов, ранее перенесших ПРК.
Ряд авторов указывает на высокую погрешность при применении аппланационных методов измерения ВГД у пациентов после кераторефракционных операций. Она зависит от изменения топографии передней поверхности роговицы, ее биомеханических свойств, типа проведенной рефракционной операции [18–20].
Так, С.В. Вострухин [21] и С.Э. Аветисов и соавт. [22] показали низкую достоверность результатов тонометрии, осуществляемую с помощью методик, предполагающих деформацию роговицы и/или ее контакт с тонометром в центральной зоне.
В настоящее время, согласно приказу от 12 ноября 2012 г. № 902н[1], в стандарт технического оснащения офтальмологических кабинетов поликлиник для оценки уровня ВГД должны входить автоматический бесконтактный пневмотонометр, тонометр аппланационный Маклакова.
Автоматический бесконтактный пневмотонометр отличается быстротой выполнения исследования, неинвазивностью, минимизацией рисков инфекционных осложнений. Поэтому в амбулаторной практике окулисты предпочитают использовать этот прибор. Однако к его недостаткам относят то, что выполняемое с помощью него исследование является лишь скрининговым, целью которого является предварительная оценка ВГД, особенно при обследовании большого количества пациентов.
Немаловажным является также то, что при более высоком исходном уровне ВГД пневмотонометр может давать большую погрешность [23–25]. Так, Q.K. Farhood [26] отмечает, что тонометрия при помощи воздушной струи является подходящим методом для общественных массовых скринингов, но может давать завышенные значения ВГД в сравнении с тонометром Гольдмана ввиду большой площади контакта воздушного потока с роговицей, приводящего к ее деформации. Подобного же мнения придерживаются P. Wang et al. [27], которые отметили завышение показателей ВГД у пациентов с миопией при проведении бесконтактной тонометрии в сравнении с тонометрией по Гольдману.
В отношении пациентов, перенесших ПРК, имеются разрозненные немногочисленные данные о градациях и степенях погрешностей измерений уровней ВГД, получаемых при использовании аппланационного и автоматического бесконтактного пневмотонометра [22, 28, 29].
На сегодняшний день по результатам исследований, проведенных в НИИ глазных болезней им. М.М. Краснова, наиболее точным методом измерения уровня ВГД после ПРК, сопоставимым с манометрическим уровнем ВГД, является точечная контактная тонометрия. Она выполняется с помощью рикошетного тонометра iCare (Icare Finland Oy, Финляндия) [30–32].
Точность измерения с помощью точечного контактного тонометра обусловлена принципом его действия, не зависящим от нарушений сферичности передней поверхности роговицы [33–36]. В отличие от автоматической бесконтактной пневмотонометрии, при выполнении этой методики происходит воздействие лишь на ограниченную поверхность роговицы крошечным зондом с последующим анализом его замедления. Поэтому наличие неравномерностей топографии передней поверхности роговицы не способно повлиять на точность результата. При повышенном уровне ВГД отмечается более выраженное замедление зонда после контакта с роговицей, при низком уровне ВГД, соответственно, меньшее.
В целом ряде исследований отмечено, что показатели, полученные при помощи точечного контактного тонометра iCare, зависят преимущественно от биомеханических свойств роговицы и точки приложения зонда к роговице. При этом они не зависят от нарушений ее сферичности, что характерно для пациентов после ПРК. Так, измерения в центре роговицы и на ее периферии могут отличаться на 3–4 мм рт. ст. [37–39].
Высокая точность тонометрии iCare, вполне сопоставимая с точностью тонометрии по методу Гольдмана, отмечается рядом исследователей [40–42]. Но из-за стоимости как самого тонометра iCare, так и его расходных материалов применение в широкой амбулаторной практике данного прибора менее доступно. Соответственно, он отсутствует в перечне оснащения поликлинических кабинетов.
При массовом использовании пневмотонометров в поликлиническом звене достаточно важным является вопрос: каким значениям тонометра iCare соответствуют показатели, полученные с помощью автоматического бесконтактного пневмотонометра? Однако подобных сведений в литературе мы не нашли. Между тем они могли бы существенно помочь в объективной оценке показателей ВГД у пациентов с миопией, ранее перенесших ПРК, с учетом повышенного риска формирования ПОУГ у таких пациентов. В связи с этим мы решили изучить данную проблему на собственном клиническом материале.
Цель исследования: построить нейросетевую модель, позволяющую адекватно оценивать уровень ВГД у пациентов, перенесших ПРК, основываясь на данных бесконтактной автоматической пневмотонометрии.
Содержание статьи
Материал и методы
Исследование проведено при участии 68 пациентов (135 глаз), ранее перенесших ПРК. Среди пациентов 16 мужчин, 52 женщины, медиана возраста составила 59 [54; 65] лет, минимальный — 47 лет, максимальный — 74 года.
Сроки после проведенной ПРК составили 25 лет и более. Показатели ПЗО глаз варьировали от 23,41 до 29,49 мм, медиана значений ПЗО составила 25,55 [24,84; 26,69] мм. У 26 пациентов (52 глаза) размер ПЗО превышал 26 мм рт. ст. Число кератотомических рубцов варьировало от 6 до 24, медиана числа рубцов составила 10 [8; 12].
У всех пациентов уровень ВГД последовательно измеряли двумя различными методами. Сначала использовали метод автоматической бесконтактной пневмотонометрии (TONOREF III, NIDEK, Япония). Затем проводили измерение ВГД с помощью рикошетного точечного тонометра iCare TA01i (iCare, Финляндия).
Тонометрия iCare выполнялась шестикратно, на средней периферии роговицы, с височной ее стороны в 4 мм от лимба в зонах, лишенных кератотомических рубцов. На приборе автоматически рассчитывалось среднее значение уровня ВГД.
Биометрию глаза проводили всем пациентам с помощью оптического биометра OcuScan RxP (Alcon, Германия); число кератотомических рубцов оценивали при выполнении биомикроскопии (щелевая лампа Takagi SM-2N, Япония) при увеличении 16×.
Медиана показателей ВГД, измеренных с помощью метода автоматической бесконтактной пневмотонометрии, составила 19 [16; 25] мм рт. ст., минимальное — 11 мм рт. ст., максимальное — 51 мм рт. ст.
Медиана показателей ВГД, полученных методом рикошетной тонометрии iCare, — 14 [11; 17] мм рт. ст., минимальное — 6 мм рт. ст., максимальное — 29 мм рт. ст.
Вычисляли разность значений обоих показателей. Так, разность показателей ВГД методом пневмотонометрии и iCare варьировала от -17 до +23 мм рт. ст., медиана разности составила 6 [3; 10] мм рт. ст. Например, у женщины 66 лет, с 8 кератотомическими рубцами на левом глазу ВГД по результатам автоматической пневмотонометрии превосходило таковое по результатам измерения с помощью iCare на 23 мм рт. ст. (34 мм рт. ст. против 11 мм рт. ст.). Напротив, у другой пациентки, 62 лет, с 10 рубцами на правом глазу, по результатам автоматической пневмотонометрии уровень ВГД оказался ниже, чем по результатам измерения с помощью iCare, на 17 мм рт. ст. (11 мм рт. ст. против 28 мм рт. ст.).
Статистическую обработку данных, построение регрессионных линейных и нейросетевых моделей выполняли с использованием программы статистического анализа R версии 4.4.0 (R Core Team (2024), https://www.R-project.org/).
Нормальность распределения показателей проверяли критерием Шапиро — Уилка. Так как распределения не являлись нормальными, данные представлены в виде Me [Q1; Q3], где Me — медиана, Q1 и Q3 — 1-й и 3-й квартили. Рассчитывали коэффициент корреляции Спирмена и его статистическую значимость. Выполняли анализ качества полученных моделей (анализ ошибок), рассчитывали среднеквадратические, минимальные и максимальные ошибки моделей. Нейросетевые модели строили с использованием пакета Neuralnet версии 1.44.2.
Результаты исследования
На начальном этапе исследования мы попытались построить линейные регрессионные модели, где в качестве зависимой переменной выступал уровень ВГД, измеренный рикошетным тонометром iCare, а в качестве предикторов — уровень ВГД, измеренный бесконтактным автоматическим пневмотонометром, пол, возраст пациентов, ПЗО глаз, сферические и цилиндрические показатели рефракции, число кератотомических рубцов. Но ни одна модель с различными комбинациями таких предикторов не показала приемлемого качества прогнозирования.
На наш взгляд, это было связано, в первую очередь, с нелинейным характером взаимосвязи между зависимыми и независимыми переменными. Коэффициент корреляции Спирмена, показывающий силу линейной или монотонно преобразованной линейной взаимосвязи между iCare и бесконтактной автоматической пневмотонометрией, был невысок, составляя 0,440 (p<0,001), а с другими рассматриваемыми предикторами iCare коррелировал еще слабее.
Ввиду этого для достижения поставленной цели нами было решено строить предиктивную модель на основе искусственных нейронных сетей (ИНС), поскольку ИНС эффективно справляются с нелинейными зависимостями.
Весь клинический материал случайным образом был разбит на обучающую (training) и тестовую (test) выборки в соотношении 70% : 30%. На обучающей выборке было выполнено построение нейросетевых моделей, на тестовой — верификация полученных моделей на независимых данных и контроль их переобучения.
В качестве ИНС был выбран многослойный перцептрон с обратным распространением ошибки (Rprop). В качестве функции активации нейронов (кроме выходного нейрона) использовали стандартную сигмоиду. Все данные обучающей и тестовой выборок предварительно были нормализованы в диапазон [0; 1] функцией scale() в программе R.
В результате моделирования была получена ИНС, минимизирующая ошибку прогнозирования (рис. 1).
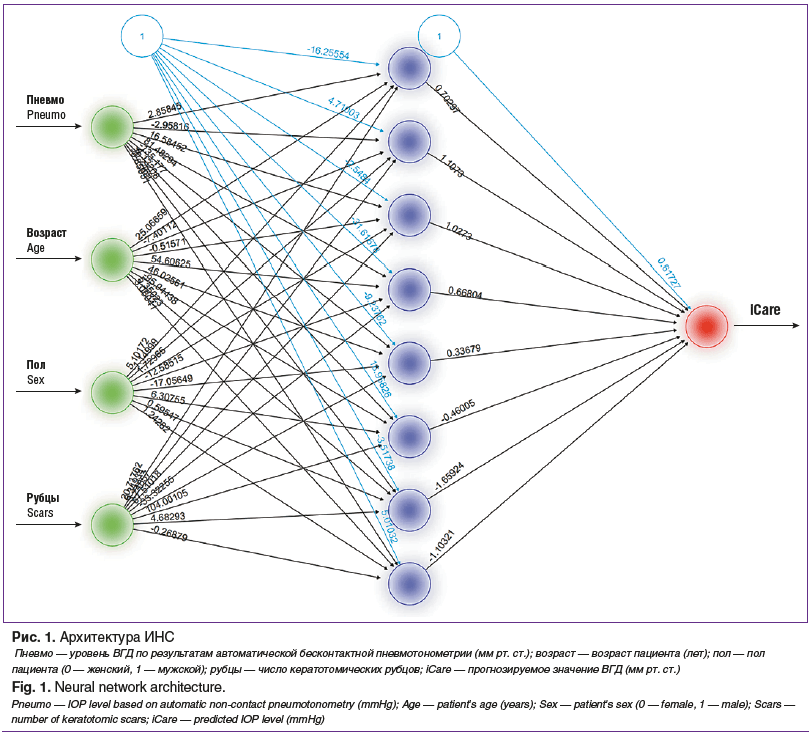
Архитектура ИНС состоит из входного слоя (4 нейрона), скрытого слоя (8 нейронов) и выходного слоя (1 нейрон). Предикторами модели являются:
уровень ВГД по результатам автоматической бесконтактной пневмотонометрии (мм рт. ст.),
возраст пациента (лет),
пол пациента (0 — женский, 1 — мужской),
число кератотомических рубцов.
Особо подчеркнем, что все эти предикторы легко оценимы в условиях амбулаторного приема офтальмолога.
Прогностические качества модели представлены на рисунках 2, 3 и в таблице. Под ошибкой прогнозирования здесь следует понимать разность между прогнозируемым и истинным значением параметра iCare.
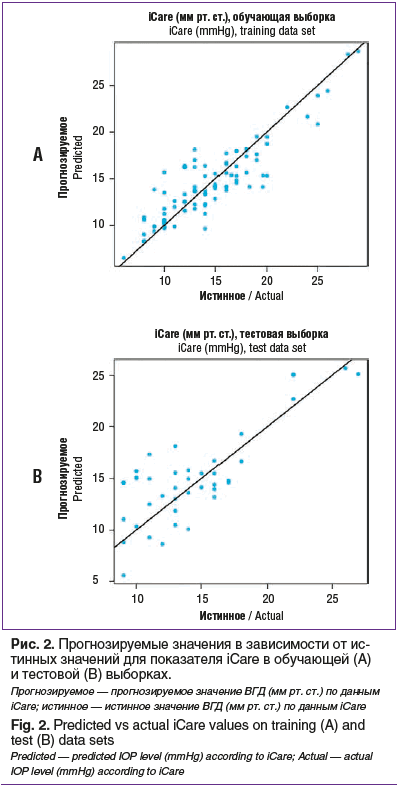
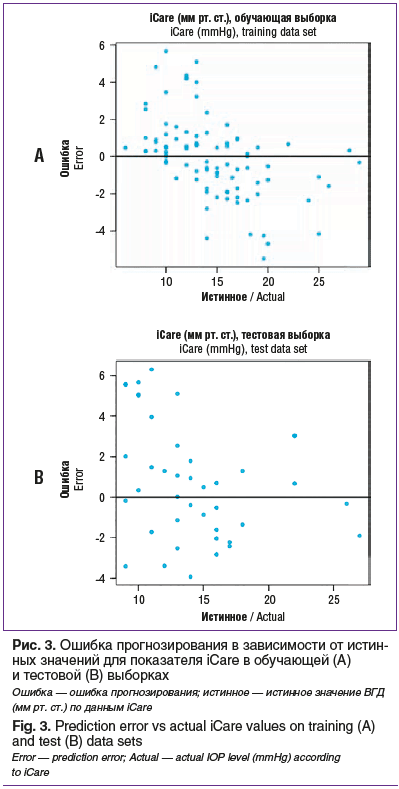
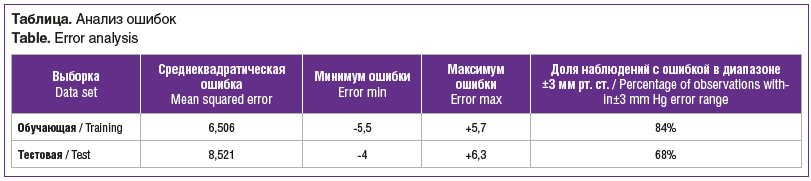
Как видно из таблицы, для обучающей выборки среднеквадратическая ошибка составила 6,506. Ошибка прогнозирования лежала в пределах от -5,5 до 5,7 мм рт. ст. Но для подавляющего большинства (84%) наблюдений ошибка находилась в небольшом диапазоне ±3 мм рт. ст.
Для тестовой выборки среднеквадратическая ошибка составила 8,521. При этом ошибка прогнозирования находилась в пределах от -4 до 6,3 мм рт. ст. Для 68% наблюдений ошибка прогнозирования находилась в диапазоне ±3 мм рт. ст. В целом на тестовом наборе данных ИНС показала вполне удовлетворительный результат в виде минимального расхождения прогнозируемых и фактических показателей уровня ВГД, что свидетельствует о хороших прогностических способностях полученной модели.
Обсуждение
Проблема адекватной оценки уровня ВГД у пациентов с миопией, ранее перенесших ПРК, все более актуализируется из-за нарастающего числа таких пациентов, достигших 50–70-летнего возраста. С целью своевременного выявления ПОУГ основной упор делается на амбулаторное звено офтальмологов. Но большинство амбулаторных кабинетов оснащено бесконтактными автоматическими пневмотонометрами в связи с удобством их применения, минимизацией рисков инфекционных осложнений, а также быстротой проводимых измерений. Однако с учетом изменения ряда важных характеристик роговицы у пациентов после ПРК (неравномерность топографии передней поверхности, снижение ее биомеханических свойств) измерение уровня ВГД автоматическим бесконтактным пневмотонометром сопряжено с высокой вероятностью ошибок [43, 44].
Более точные показания ВГД при наличии кератотомических рубцов способен дать тонометр iCare. Но с учетом невозможности укомплектования широкой сети поликлинического звена столь дорогостоящими тонометрами нами разработана нейросетевая модель, позволяющая по показателям автоматической бесконтактной пневмотонометрии прогнозировать уровень ВГД, соответствующий показателям тонометра iCare. При этом также учитывается ряд показателей: возраст, пол пациента, число кератотомических рубцов. Разработанная нами нейросетевая модель может быть использована врачами-офтальмологами как поликлинического звена, так и стационаров.
Заключение
Для более точной оценки уровня ВГД у пациентов с миопией, ранее перенесших ПРК, разработана нейросетевая модель, способная по данным автоматической бесконтактной пневмотонометрии прогнозировать уровень ВГД, соответствующий показателям рикошетного тонометра iCare, отличающегося более высокой точностью измерения.
Сведения об авторах:
Кулешова Наталья Алексеевна — заведующая лечебно-диагностическим отделением, врач-офтальмолог Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; ORCID iD 0000-0002-2061-1920
Пашенцев Ярослав Евгеньевич — младший научный сотрудник Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; ORCID iD 0000-0001-5446-0633
Сорокин Евгений Леонидович — д.м.н., профессор, заместитель директора по научной работе Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; профессор кафедры общей и клинической хирургии ФГБОУ ВО «Дальневосточный государственный медицинский университет» Минздрава России; 680000, Россия, г. Хабаровск, ул. Муравьева-Амурского, д. 35; ORCID iD 0000‑0002-2028-1140
Контактная информация: Кулешова Наталья Алексеевна, e-mail: naukakhvmntk@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.12.2024.
Поступила после рецензирования 21.01.2025.
Принята в печать 13.02.2025.
About the authors:
Nataliya A. Kuleshova — Head of the Medical and Diagnostic Department, Ophthalmologist, Khabarovsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; ORCID iD 0000-0002-2061-1920
Iaroslav E. Pashentsev — Junior Scientific Officer, Khabarovsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; ORCID iD 0000-0001-5446-0633
Evgenyi L. Sorokin — D. Sc. (Med.), Professor, Deputy Director for Scientific Work, Khabarovsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya st., Khabarovsk, 680033, Russian Federation; Professor of the Department of General and Clinical Surgery, Far Eastern State Medical University; 35, Murav’yov-Amurskyi str., Khabarovsk, 680000, Russian Federation; ORCID iD 0000-0002-2028-1140
Contact information: Nataliya A. Kuleshova, e-mail: naukakhvmntk@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.12.2024.
Revised 21.01.2025.
Accepted 13.02.2025.
[1] Приказ от 12 ноября 2012 г. № 902н «Об утверждении порядка оказания медицинской помощи взрослому населению при заболеваниях глаза, его придаточного аппарата и орбиты (в ред. приказов Минздрава РФ от 09.06.2020 № 558н, от 01.02.2022 № 44н)». (Электронный ресурс.) URL: https://normativ.kontur.ru/document?moduleId=1&documentId=417471 (дата обращения: 04.10.2024).
материал rmj.ru
