Введение
Российскими и иностранными авторами было предложено множество хирургических техник лечения макулярных разрывов (МР) сетчатки, большинство из них связаны с пилингом внутренней пограничной мембраны (ВПМ): методика «перевернутого лоскута» (однослойного и многослойного), методика поэтапного формирования фрагмента ВПМ для закрытия МР, техника «темпорального перевернутого лоскута», техники с неполным удалением ВПМ, технология с сохранением фовеолярной ВПМ и др. [1–6].
Фовеолярная зона сетчатки и зона папилломакулярного пучка (ПМП) нервных волокон зрительного нерва являются наиболее значимыми для обеспечения высокой остроты зрения и офтальмоэргономических функций [7].
Повреждение тонких структур сетчатки и зрительного нерва в ходе пилинга ВПМ, даже при высочайшей квалификации витреоретинального хирурга, по-прежнему остается неизбежным. Это обусловлено тесной морфологической связью ВПМ сетчатки и клеток Мюллера, что подтверждено наличием фрагментов нейроэпителия сетчатки и клеток Мюллера на гистологических препаратах удаленной ВПМ [8, 9]. Повреждение клеток Мюллера приводит к необратимым деструктивным изменениям в сетчатке, которые напрямую негативно влияют на ее светочувствительность и, как следствие, ухудшают функциональный исход лечения [8–13].
Кроме того, сообщалось о диссоциации нервных волокон сетчатки, частичной атрофии зрительного нерва, дистопии фовеолы со смещением в сторону диска зрительного нерва (ДЗН) с уменьшением папиллофовеолярного расстояния, истончении и растяжении ткани сетчатки, а также о появлении парацентральных микроскотом в поле зрения, определяющих зрительный дискомфорт у пациентов после хирургии [12, 14–16].
На данном этапе развития витреоретинальной хирургии МР сетчатки по-прежнему остаются спорные моменты, касающиеся выбора техники хирургического лечения, которая обеспечила бы максимально высокий анатомический результат и в то же время была бы максимально щадящей по отношению к микроструктурам сетчатки и зрительного нерва, оказывающим прямое влияние на функциональный результат лечения. Поэтому поиск компромисса между достижением гарантированного анатомического результата путем максимального устранения тангенциальных тракций вокруг МР за счет пилинга ВПМ, имеющей коэффициент упругости, значительно превышающий таковой у подлежащих слоев сетчатки, и минимизацией повреждения микроструктур сетчатки и зрительного нерва, обеспечивающих высокий функциональный исход лечения, остается актуальной задачей.
Цель исследования: разработка технологии хирургического лечения сквозных первичных МР сетчатки с сохранением интактной ВПМ сетчатки в проекции папилломакулярного пучка (ПМП) нервных волокон и оценка ее клинической эффективности.
Содержание статьи
Материал и методы
Под наблюдением находились 42 пациента (42 глаза) с первичными МР сетчатки малого и среднего диаметра (с минимальным диаметром не более 400 мкм), в том числе женщин — 35, мужчин — 7. Возраст пациентов варьировал от 57 до 77 лет (табл. 1).
Каждому пациенту, помимо стандартных методов обследования (рефрактометрия, визометрия, тонометрия, биометрия, офтальмосканирование), проводились микропериметрия и спектральная оптическая когерентная томография (СОКТ).
При помощи СОКТ (Optovue Solix, США) с использованием протокола Line при первичном обращении регистрировали следующие показатели: минимальный диаметр МР (наименьшее расстояние между его краями), максимальный диаметр МР (ширина разрыва на уровне пигментного эпителия сетчатки) и высоту МР. Использование протокола Angio Retina 6,4×6,4 мм позволило оценить толщину сетчатки и комплекса ганглиозных клеток в макулярной области в динамике, использование режима En-Face — положение лоскута ВПМ и изменения на уровне фоторецепторного слоя в послеоперационном периоде и при последующих контрольных осмотрах.
При помощи микропериметрии (MAIA CenterVue, Италия) определяли центральную светочувствительность (СЧц) и общую светочувствительность (СЧо) (6 и 10° соответственно), а также точку зрительной фиксации и стабильность фиксации.
Предоперационно максимальная корригированная острота зрения (МКОЗ) у пациентов варьировала от 0,02 до 0,6 (средняя — 0,23). Минимальный диаметр разрыва составлял от 69 до 443 мкм (303,6±80,6 мкм), максимальный диаметр разрыва у основания — от 302 до 1250 мкм (746±242 мкм), высота разрыва колебалась от 273 до 531 мкм (419±58 мкм). СЧо была от 18,8 до 29,2 дБ (25,2±2,0 дБ), СЧц — от 17,3 до 28,0 дБ (22,6±2,2 дБ). В центре фовеа во всех случаях определялась абсолютная скотома. У 23 пациентов зарегистрирована относительно нестабильная фиксация, у 19 пациентов фиксация оставалась стабильной. Точка зрительной фиксации у всех пациентов определялась по верхнему краю разрыва.
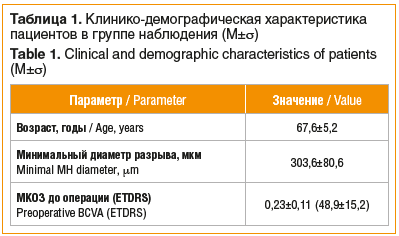
Всем пациентам выполнена операция с использованием хирургической техники с сохранением интактного ПМП (ИПМП) (по типу «замочной скважины») [17] с целью минимизировать риски повреждения ПМП нервных волокон и точку зрительной фиксации по краю разрыва и повысить функциональный результат лечения.
Все операции были проведены одним хирургом.
Техника операции: выполняли стандартную трансконъюнктивальную трехпортовую 27G-витрэктомию с частотой резов от 5000 до 10 000. Вакуум — от 0 до 650 мм рт. ст. Задние кортикальные слои стекловидного тела отделяли аспирационным методом, начиная от ДЗН. Для окрашивания ВПМ использовали краситель Membran Blue Dual.
Пилинг ВПМ осуществляли путем последовательного дозированного удаления ее локальных участков концентрично макулярному отверстию. При этом сохранялась зона интактной фовеолярной ВПМ сетчатки в виде пояска вокруг МР шириной 0,3–0,5 мм — фовеолярный интактный фрагмент ВПМ (ФИФ ВПМ), а также зона интактной ВПМ в области ИПМП. Для закрытия макулярного отверстия формировался однослойный фрагмент ВПМ — верхний инвертируемый фрагмент ВПМ (ВИФ ВПМ), которым накрывался и тампонировался МР (рис. 1). Операцию завершали заменой жидкости на воздух без дренирования жидкости через разрыв и без механического воздействия на края МР. Перфторорганические соединения в ходе операции не применяли. Пациентам было запрещено ложиться на спину и рекомендовано преимущественное положение «лицом вниз» в течение первых суток.
Контрольные осмотры пациентов осуществлялись в сроки 1, 3, 6 и 12 мес. после операции.
Результаты и обсуждение
Оперативное лечение всех пациентов прошло без осложнений.
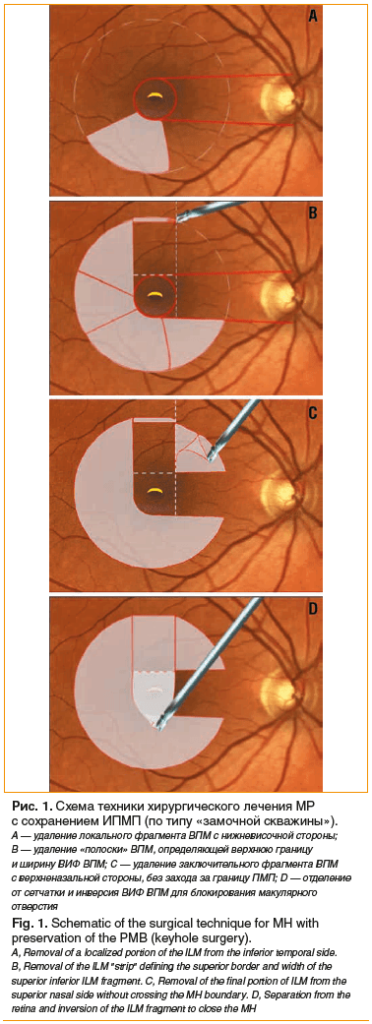
Через 1 мес. после хирургического вмешательства по данным СОКТ во всех случаях края разрыва были сопоставлены с сохранением локального дефекта в виде гипорефлективного участка на уровне эллипсоидной зоны фоторецепторного слоя. Наружная пограничная мембрана четко определялась и имела линейный профиль. Отек по краям разрыва полностью резорбировался. ВИФ ВПМ, блокирующий макулярное отверстие, хорошо визуализировался на EnFace-изображениях с сегментацией на уровне поверхности сетчатки, плотно прилегая к ней.
На последующих контрольных осмотрах на сроках 3, 6 и 12 меc. по данным СОКТ во всех случаях отмечалось сохранение дефекта на уровне эллипсоида. При этом размер дефекта постепенно уменьшался. Восстановление анатомии наружных слоев сетчатки было постепенным и связано с восстановлением структуры эллипсоидной зоны фоторецепторов [18]. ВИФ ВПМ на поверхности сетчатки в фовеа хорошо визуализировался во всех случаях на всех сроках наблюдения. Помимо этого, у всех пациентов по данным СОКТ определялись множественные (различной степени выраженности) дефекты внутренних слоев сетчатки в пределах перифовеальной области, соответствующие зоне пилинга ВПМ и не захватывающие папилломакулярную область (рис. 2). В проекции зоны пилинга ВПМ было отмечено снижение толщины комплекса ганглиозных клеток (КГК) сетчатки. Выявленные изменения толщины КГК имели вид «замочной скважины». Снижения толщины КГК в проекции ПМП за весь срок наблюдения ни в одном случае зарегистрировано не было. Следует отметить, что случаев отсутствия закрытия МР, а также его рецидивов за весь срок наблюдения не отмечалось.
Все пациенты отмечали снижение уровня искажений и увеличение остроты зрения уже в первый месяц после операции. Так, на контрольном осмотре через 1 мес. у 32 пациентов отмечался прирост МКОЗ: в 5 случаях острота зрения увеличилась на 0,2, в 13 — на 0,1. У 10 пациентов острота зрения осталась без изменений. Средние показатели МКОЗ составили 0,42 (от 0,2 до 0,8). Через 3 мес. после хирургического лечения МР увеличение МКОЗ было зафиксировано в 19 случаях: у 7 пациентов на 0,3, у 4 — на 0,2, у 11 — на 0,1. У остальных пациентов изменений МКОЗ выявлено не было, зрительные функции оставались стабильными. Средние показатели МКОЗ на данном сроке наблюдения составили 0,56 (от 0,3 до 0,8). На контрольном осмотре через 6 мес. у 26 пациентов показатели МКОЗ оставались без изменений, а у 16 пациентов было отмечено увеличение остроты зрения (в 6 случаях — на 0,2, в 3 случаях — на 0,3). Средние показатели МКОЗ составили 0,69 (от 0,4 до 0,8). В целом у всех пациентов группы наблюдения отмечалось постепенное увеличение МКОЗ до 0,8 (в среднем 0,77) (табл. 2).
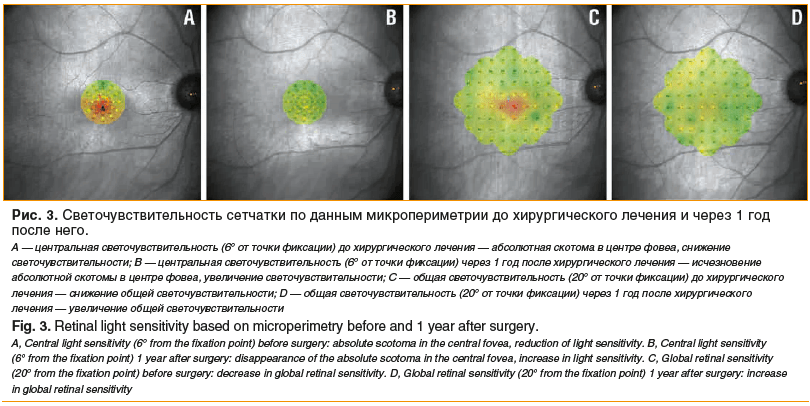
В ходе наблюдения было отмечено планомерное увеличение центральной и общей светочувствительности сетчатки на всех сроках наблюдения: через 1 мес. — 24,6±1,7 дБ (от 21,3 до 28,8 дБ), СЧо — 25,8±1,3 дБ (от 22,8 до 29,3 дБ). Светочувствительность сетчатки в проекции фовеа возросла, абсолютная скотома не определялась, фиксация во всех случаях стала более стабильной, точка зрительной фиксации сместилась к центру фовеа. К 3-му месяцу наблюдения средние показатели СЧц достигли 25,8±1,3 дБ (от 22,9 до 28,8 дБ), СЧо — 26,2±1,4 дБ (от 22 до 29,3 дБ). К концу периода наблюдения во всех случаях была отмечена стабильная фиксация, СЧц повысилась до 27,7±1,3 дБ (от 24,5 до 29,7 дБ), СЧо — до 27,3±0,8 дБ (от 25,8 до 29,5 дБ) (рис. 3).
За весь период наблюдения катаракта развилась у 6 пациентов, в связи с чем им потребовалась факоэмульсификация катаракты с имплантацией ИОЛ, которая была выполнена по стандартной методике. Функциональные результаты лечения оценивались при прозрачных оптических средах.
В российской и иностранной литературе приводятся данные о методиках, позволяющих уменьшить травматичность хирургии МР за счет уменьшения площади пилинга ВПМ, деликатного отношения к точке зрительной фиксации по краю разрыва и минимизации повреждения слоя нервных волокон сетчатки, в частности в зоне ПМП [1–3].
В исходе хирургического лечения макулярного отверстия по этим методикам сохраняется большой процент тангенциальных тракций, которые могут вызвать незакрытие МР или привести к рецидиву заболевания в отдаленном периоде, так как ВПМ может быть субстратом для формирования эпиретинальных мембранных структур, способных к констрикции и усилению тангенциального натяжения на края макулярного отверстия.
На основании данных об анатомии хода нервных волокон от ДЗН по поверхности сетчатки [19] и полученного клинического опыта нами разработана новая техника хирургического лечения сквозных первичных МР сетчатки с сохранением интактной ВПМ сетчатки в области ИПМП по типу «замочной скважины», что исключает риски его повреждения и, следовательно, минимизирует дегенеративные изменения нервных волокон этой зоны в отдаленном послеоперационном периоде. Отсутствие манипуляций в зоне ПМП нервных волокон в момент хирургического вмешательства сводит к минимуму вероятность ятрогенного интраоперационного повреждения этой области сетчатки и уменьшает продолжительность операции. Сохранение ФИФ ВПМ предупреждает риск повреждения края МР и точки зрительной фиксации. Последующее удаление ВПМ концентрично ФИФ ВПМ обеспечивает смыкание краев разрыва стык в стык, обусловливая смещение точки зрительной фиксации к центру фовеа, что улучшает функциональный результат лечения, ускоряет процесс реабилитации и увеличивает удовлетворенность пациентов проведенным лечением. Локализация ВИФ ВПМ сверху относительно МР и его достаточный размер (2–3 диаметра макулярного отверстия) обеспечивает стабильное положение указанного фрагмента на поверхности сетчатки в послеоперационном периоде и надежную пролонгированную тампонаду макулярного отверстия без необходимости длительного позиционирования пациента лицом вниз. За счет удаления более 50% площади ВПМ вокруг МР сводятся к минимуму риски его незакрытая и рецидивов из-за развития эпиретинальных мембран на поверхности ВПМ, которая может быть субстратом для этого.
Предложенная нами методика показала высокую анатомическую и функциональную эффективность. Во всех случаях было достигнуто анатомическое закрытие МР путем смыкания его краев стык в стык. Сохранение фовеолярной части ВПМ и фрагмента ВПМ в проекции ПМП позволило добиться высокого функционального результата, о чем свидетельствуют данные МКОЗ и микропериметрии, по результатам которой в послеоперационном периоде у всех пациентов отмечен прирост светочувствительности сетчатки и исчезновение абсолютной скотомы в центре фовеа. Метод позволил бережно отнестись к точке зрительной фиксации за счет сохранения ФИФ ВПМ вокруг МР, у всех пациентов точка зрительной фиксации сместилась к центру фовеа. По данным СОКТ в зоне пилинга ВПМ, концентрично МР, определялись множественные дефекты внутренних слоев сетчатки различной степени выраженности в пределах перифовеальной области, соответствующие зоне пилинга ВПМ и не захватывающие папилломакулярную область, что подтверждает щадящее отношение к этой зоне сетчатки в ходе хирургического вмешательства.
Заключение
Таким образом, предложенная методика лечения МР с сохранением ИПМП по типу «замочной скважины» позволяет достичь стойкого закрытия первичных МР малого и среднего диаметра, обеспечивая высокий функциональный результат лечения на фоне минимального травмирующего воздействия на сетчатку в ходе оперативного вмешательства. Широкое применение указанной методики может повысить функциональную эффективность хирургического лечения первичных МР малого и среднего диаметра за счет сохранения анатомической структуры сетчатки в области ПМП и фовеальной зоны. В перспективе требуется продолжение исследований в этом направлении на достаточном клиническом материале для получения точных и достоверных данных, доказывающих эффективность и безопасность разработанной технологии.
Сведения об авторах:
Шилов Николай Михайлович — к.м.н., заведующий отделением неотложной офтальмологической помощи Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирур-
гия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. Святослава Федорова, д. 5; ORCID iD 0000-0002-2392-3049.
Терещенко Александр Владимирович — д.м.н., директор Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. Святослава Федорова, д. 5; профессор кафедры хирургии медицинского института КГУ им. К.Э. Циолковского; 248023, Россия, г. Калуга, ул. Степана Разина, д. 26; ORCID iD 0000-0002-0840-2675.
Ерохина Елена Владимировна — врач-офтальмолог высшей категории, заведующая диагностическим отделением Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. Святослава Федорова, д. 5; ORCID iD 0000-0001-7320-9209.
Новиков Сергей Васильевич — врач-офтальмолог отделения витреоретинальной хирургии Калужского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 248007, Россия, г. Калуга, ул. Святослава Федорова, д. 5; ORCID iD 0000-0003-4953-4663.
Луговая Анна Анатольевна — к.м.н., доцент кафедры глазных болезней ФГБОУ ВО СМГУ Минздрава России; 214019, Россия, г. Смоленск, ул. Крупской, д. 28; ORCID iD 0000-0002-5478-6040.
Кургузова Александра Геннадьевна — к.м.н., научный сотрудник отдела патологии сетчатки и зрительного нерва ФГБНУ «НИИГБ им. М.М. Краснова»; 119021, Российская Федерация, г. Москва, ул. Россолимо, д. 11, корп. А, Б; ORCID iD 0000-0002-3990-4491.
Контактная информация: Шилов Николай Михайлович, e-mail: nauka@mntk.kaluga.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 17.06.2024.
Поступила после рецензирования 10.07.2024.
Принята в печать 31.07.2024.
About the authors:
Nikolay M. Shilov — C. Sc. (Med.), Head of the Department of the Emergency Ophthalmic Care, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fedorov str., Kaluga, 248007, Russian Federation; ORCID iD 0000-0002-2392-3049.
Aleksandr V. Tereshchenko — Dr. Sc. (Med.), Director, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fedorov str., Kaluga, 248007, Russian Federation; professor of the Department of Surgery of the Medical Institute, K.E. Tsiolkovskiy Kaluga State University; 26, Stepan Razin str., Kaluga, 248023, Russian Federation; ORCID iD 0000-0002-0840-2675.
Elena V. Erokhina — Head of the Diagnostical Department, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fedorov str., Kaluga, 248007, Russian Federation; ORCID iD 0000-0001-7320-9209.
Sergey V. Novikov — ophthalmologist of the Department of Vitreoretinal Surgery, Kaluga Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 5, Svyatoslav Fedorov str., Kaluga, 248007, Russian Federation; ORCID iD 0000-0003-4953-4663.
Anna A. Lugovaya — C. Sc. (Med.), associate professor of the Department of Eye Diseases, Smolensk State Medical University; 28, Krupskaya str., Smolensk, 214019, Russian Federation; ORCID iD 0000-0002-5478-6040.
Anna G. Kurguzova — C. Sc. (Med.), researcher of the Division of Retinal and Optic Nerve Disorders M.M. Krasnov Research Institute of Eye Diseases; 11A, B, Rossolimo str., Moscow, 119021, Russian Federation; ORCID iD 0000-0002-3990-4491.
Contact information: Nikolay M. Shilov, e-mail: nauka@mntk.kaluga.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 17.06.2024.
Revised 10.07.2024.
Accepted 31.07.2024.
материал rmj.ru
