Материал и методы
Основную (проспективную) группу исследования составили 84 пациента (84 глаза) с глаукомой, находившиеся на лечении в ГБУЗ «ГКБ № 15 ДЗМ» и оперированные методом ХРС (с ПОУГ — 67, с ВГ — 17). Контрольную (ретроспективную) группу составили 80 пациентов (с ПОУГ — 61, с ВГ — 19) после ДТЛЦК. Больные распределялись на группы по типу глаукомы (ПОУГ и ВГ), стадиям глаукомного процесса (II, III, IV стадии). Большую часть составляли больные с III стадией глаукомы: 62 (74%) — в основной, 61 (76%) — в контрольной группе. Среди пациентов c развитой стадией ПОУГ и ВГ 16 больных наблюдались в основной группе, 9 — в контрольной. Средний возраст больных — 63 года. Отдаленные сроки наблюдения — от 24 до 36 мес.
Офтальмологическое обследование включало определение остроты зрения методом визометрии по таблицам Сивцева с максимальной коррекцией. Периметрия проводилась с использованием Humphrey Visual Field Analyzer II (Carl Zeiss, Германия). Программы выбирались с учетом стадии глаукомы (скрининговая или пороговая) — Standard-30 или Central 30–2. Оценивались показатели среднего отклонения (mean deviation, MD) и среднеквадратичного стандартного отклонения (pattern standart deviation, PSD). Кроме того, с учетом многочисленности пациентов с III стадией для оценки динамики глаукомного процесса проводилась кинетическая периметрия и определялись суммарные границы периферического поля зрения (ППЗ) по 8 радиусам. Тонометрия проводилась тонометром Маклакова (груз 10 г). Результаты определяли по диаметру отпечатка линейкой Б.Л. Поляка (мм рт. ст.). Основные гидродинамические показатели (коэффициент легкости оттока, КЛО) определяли методом электронной тонографии с помощью прибора «ТНЦ-100» (Glautest-60, «Офтальмологические приборы», Россия). Ультразвуковую биомикроскопию (УБМ) переднего сегмента глаза выполняли на приборе HiScan (OPTIKON, Италия) с целью оценки состояния хирургически созданных путей оттока.
Методика ХРС: 1) отсепаровка конъюнктивы в верхнем отделе от лимба с 10 до 12 ч и (или) с 12 до 2 ч под местной инстилляционной анестезией; 2) выполнение на расстоянии 1–2 мм от лимба, в проекции ресничного тела, между прямыми мышцами (внутренней и верхней прямой и (или) верхней и наружной прямой), хирургическим лезвием 1 или 2 резекций склеры размером 7,0×5,0 мм на глубину 4/5 ее толщины. Глубина резекции склеры определяется визуально по появлению серого цвета основания ложа;
3) наложение 1–2 узловых швов на конъюнктиву.
Методика ДТЛЦК: 1) проведение парабульбарной анестезии и акинезии раствором лидокаина 2%; 2) нанесение 22–25 лазерных коагулятов диодным лазером «АЛОД-01» («АЛКОМ медика», Россия) в зоне от 3 до 5 мм от лимба концентрично на 220–270 градусов. Мощность — от 1,2 Вт, экспозиция — 3,0 с. Длина волны излучения — 810 мкм, диаметр фокального пятна — 200 мкм.
Статистический анализ клинических данных был проведен на персональном компьютере при помощи электронных таблиц MS Excel 2010 и прикладных программ SPSS Statistics 13 (IBM Company, США). Полученные данные обработаны методом вариационной статистики с определением средней величины (М) и средней ошибки (m) для каждой группы с оценкой критерия достоверности (р) по Стьюденту при парных сравнениях и критерия Вилкоксона для малых выборок.
Результаты исследования
Динамика внутриглазного давления (ВГД) после ХРС и ДТЛЦК характеризовалась статистически достоверными результатами лишь к первому месяцу наблюдения и достигала значимых показателей к третьему месяцу по сравнению с исходными данными. На основе анализа данных уровня ВГД у пациентов с ПОУГ и ВГ были получены статистически достоверные результаты снижения офтальмотонуса после хирургического и лазерного лечения. У пациентов контрольной группы с ПОУГ и ВГ уровень ВГД после ДТЛЦК снизился в отдаленные сроки на 39,11% и 36,78% соответственно (р≤0,05). У пациентов основной группы с ПОУГ и ВГ после ХРС офтальмотонус снизился на 31,5%, а у больных ВГ — на 35,26% (р≤0,05) (рис. 1).
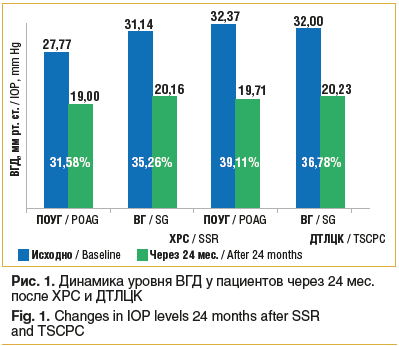
Более значимые показатели снижения уровня ВГД регистрировались после ДТЛЦК у пациентов с ПОУГ по сравнению с показателями после ХРС. У больных ВГ результативность лечения была схожей после обоих вмешательств.
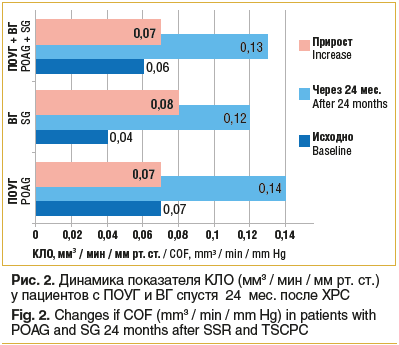
Выполнение ХРС у всех пациентов достоверно увеличило КЛО — в среднем на 0,075±0,005 мм3 / мин / мм рт. ст. У пациентов с ПОУГ отток водянистой влаги улучшился на 0,07±0,006 мм3 / мин / мм рт. ст., с ВГ — на 0,08±0,007 мм3 / мин / мм рт. ст. (p<0,05). Прирост КЛО у пациентов после ХРС показан на рисунке 2. Данные КЛО отсутствовали у пациентов группы ДТЛЦК в связи с тем, что анализ показателей проводился ретроспективно, а электронная тонография не входила в число обязательных обследований. К тому же патогенетический механизм ДТЛЦК связан с угнетением продукции ВГЖ, а не со стимуляцией ее оттока [14–16].
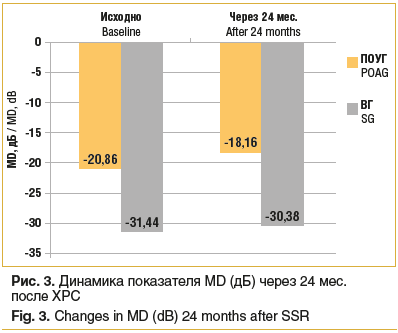
Показатели MD были посчитаны только суммарно для каждой группы, без разделения на стадии и форму глаукомы. Было отмечено, что к концу наблюдения после ХРС показатели MD улучшились в среднем на 2,7 дБ (12,94%) и на 1,06 дБ (3,4%) у пациентов с ПОУГ и ВГ соответственно (p=0,05) (рис. 3). Изменения PSD не были статистически значимыми.
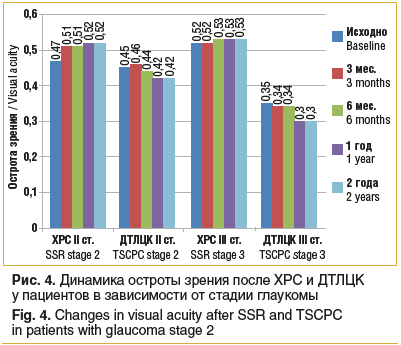
Как видно из рисунка 4, средняя острота зрения пациентов с ПОУГ и ВГ со II стадией глаукомы после ХРС через 24 мес. составила 0,52±0,01 (исходный уровень — 0,47±0,01). После ДТЛЦК через 24 мес. острота зрения у пациентов несколько ухудшилась — с 0,45±0,01 до 0,42±0,02. Получена достоверная разница динамики результатов у пациентов со II стадией глаукомы в исследуемых группах (p≤0,05). При оценке динамики остроты зрения у пациентов с III стадией глаукомы (ПОУГ + ВГ) после ХРС и ДТЛЦК не было получено статистически значимых результатов (p>0,05).
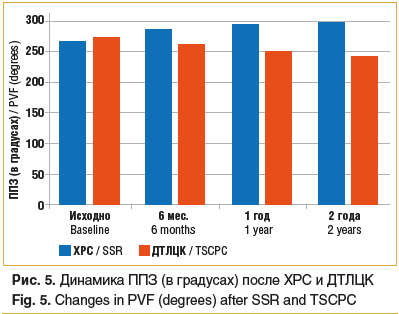
У пациентов основной группы с ПОУГ и ВГ после ХРС к концу исследования показатель ППЗ улучшился с 267,1±15,420 до 297,9±14,910 соответственно (p=0,05), в группе пациентов после ДТЛЦК показатель ППЗ несколько ухудшился — с 272,4±18,120 до 243,1±14,540 (p=0,05). Следовательно, после ДТЛЦК в отдаленные сроки наблюдения суммарный показатель ППЗ снизился на 10,76% от исходного значения, а после ХРС улучшился на 11,19% от исходного показателя (p≤0,05). Таким образом, после ХРС наблюдалась стабилизация зрительных функций в отдаленные сроки, несмотря на преобладание в группах пациентов с далеко зашедшей стадией глаукомного процесса (рис. 5).
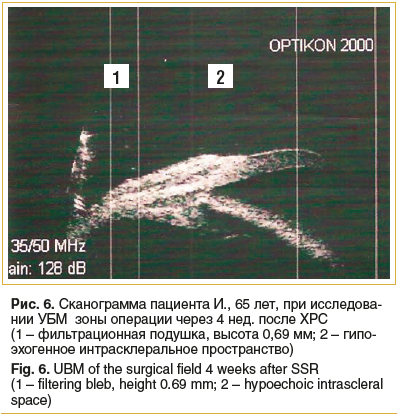
Через 4 нед. и в отдаленные сроки после ХРС с помощью УБМ были получены данные о сохранении хирургически сформированных зон, участвующих в склеральном оттоке водянистой влаги (рис. 6). Спустя 24 мес. фильтрационная подушка была достаточно выражена, высота ее в среднем составила 0,52±0,02 мм (от 0,32±0,03 мм до 0,92±0,08 мм) по сравнению с окружающими тканями (p≤0,05).
В отдаленные сроки наблюдения отмечалась сопоставимость гипотензивного эффекта после ДТЛЦК и ХРС (p>0,05). Изменение гипотензивного режима или реоперация потребовалась 9 больным (11%) после лазерного лечения и 11 больным (13%) — после хирургического.
После выполнения ХРС мы не наблюдали осложнений. Субконъюнктивальные кровоизлияния купировались к 7–10-му дню. Сохранность глубоких слоев склеры и топографическая особенность зоны вмешательства позволяют избежать развития стафилом. Осложнения фиксировались только в контрольной группе после ДТЛЦК у 11 из 80 больных (14%). У прооперированных пациентов гифема регистрировалась в 2% случаев, цилиохориоидальная отслойка — в 4%, увеит развился у 8% больных. Гипотензивный режим (количество действующих веществ) после ХРС снижен на 35,9% у пациентов с ПОУГ и на 33,2% у больных ВГ (p≤0,05), в то время как после ДТЛЦК — на 25,7% и 22,8% соответственно (p≤0,05).
Таким образом, предложенный метод ХРС эффективен и безопасен у больных ПОУГ и ВГ, что является доказательством того, что склера — перспективный объект для разработки новых непроникающих методик хирургического лечения глаукомы, альтернативных циклодеструктивным вмешательствам, таким как ДТЛЦК. Отсутствие негативного влияния на цилиарное тело позволяет избежать геморрагических и увеальных осложнений. Сохранение полноценного питания внутриглазных структур и постепенная нормализация ВГД без избыточного рубцевания окружающих тканей после вмешательства способствуют длительному гипотензивному эффекту и сохранению зрительных функций в отдаленном периоде у больных ПОУГ и ВГ.
Заключение
Процесс развития ПОУГ и ВГ связан с прогрессированием нарушения трабекулярного оттока. Выраженные изменения в углу передней камеры и постепенное ухудшение зрительных функций приводят к резкому снижению эффективности и безопасности непроникающих методов, направленных на стимуляцию основного дренажного пути [19]. В то же время увеличивается доля увеосклерального оттока водянистой влаги, конечным этапом которого является склера. Резекция склеры в безопасной зоне способствует улучшению оттока водянистой влаги и демонстрирует устойчивость ВГД. Метод ХРС показал свою эффективность и безопасность в ходе клинических исследований у больных ПОУГ и ВГ в сравнении с ДТЛЦК, что является перспективным направлением для разработки оперативных пособий, стимулирующих отток ВГЖ через склеру и позволяющих проводить лечение пациентов амбулаторно или в условиях дневного стационара.
Сведения об авторах:
Корчуганова Елена Александровна — к.м.н., старший научный сотрудник научно-исследовательской лаборатории глаукомы и дистрофических заболеваний глаза, ORCID iD 0000-0001-5147-0385;
Казанцева Ангелина Юрьевна — младший научный сотрудник научно-исследовательской лаборатории глаукомы и дистрофических заболеваний глаза, ORCID iD 0000-0002-2542-3734.
ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Корчуганова Елена Александровна, e-mail: korchuganovaelena@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 13.01.2021.
About the authors:
Elena A. Korchuganova — Cand. of Sci. (Med.), Senior Researcher of the Research Laboratory of Glaucoma and Degenerative Eye Diseases, ORCID iD 0000-0001-5147-0385;
Angelina Yu. Kazantzeva — Junior Researcher of the Research Laboratory of Glaucoma and Degenerative Eye Diseases, ORCID iD 0000-0002-2542-3734.
Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation.
Contact information: Elena A. Korchuganova, e-mail: korchuganovaelena@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 13.01.2021.
.
материал rmj.ru
