Введение
Факоэмульсификация является классическим методом лечения катаракты, позволяет аспирировать хрусталик и имплантировать интраокулярную линзу (ИОЛ) через микроинвазивные доступы в роговице. Данная технология минимизирует количество осложнений, сокращает реабилитационный период и в короткие сроки возвращает зрительные функции. Однако помутнение роговицы, мелкая передняя камера, ригидный зрачок, несостоятельность связочного аппарата хрусталика делают трудным проведение факоэмульсификации и повышают риск осложнений, что снижает функциональный результат операции.
Нестабильность цинновых связок хрусталика встречается в 20% случаев и может быть причиной как глазной сопутствующей патологии (глаукома, псевдоэксфолиативный синдром, травматический генез, высокая осложненная мио-пия и др.), так и общего соматического заболевания (синдромы Марфана и Вайля — Марчезани, ревматоидные заболевания с рецидивирующими увеитами и др.) [1–5].
Для интраоперационной стабилизации хрусталика используются крючкообразные ирис-ретракторы, которые подвешивают капсульную сумку за капсулорексис. При невыраженном дефекте цинновых связок во время или после факоаспирации хрусталика имплантируют внутрикапсульное кольцо, которое предотвращает пролапс стекловидного тела и коллапс капсульной сумки, восстанавливая ее симметричный круговой контур, а также предотвращает децентрацию ИОЛ в послеоперационном периоде [6, 7].
При значительной слабости связочного аппарата хрусталика зачастую не получается сохранить капсульную сумку. В таких случаях используют переднекамерные линзы, ИОЛ со зрачковой фиксацией, а также заднекамерные линзы с их подшиванием [8–10]. После имплантации переднекамерных ИОЛ и линз со зрачковой фиксацией возникает проблема расширения зрачка; повышается риск зрачкового блока, эндотелиально-эпителиальной дистрофии роговицы, хронического увеита. Транссклеральное подшивание линзы также включает недостатки в виде геморрагических осложнений (гифемы, гемофтальма, субретинального кровоизлияния); хронического увеита из-за прошивания цилиарного тела, отслойки сосудистой оболочки, а также деградации шовного материала.
Фиксация линзы к радужке за гаптические элементы может вызвать осложнения, которые проявляются как в момент самой операции (сложность удерживания линзы в задней камере без капсульной поддержки в момент прошивания радужки и гаптических элементов; пролапс стекловидного тела в просвет зрачка с последующими тяжами в передней камере; смещенное подшивание линзы по отношение к оптической оси глаза); так и в послеоперационном периоде (децентрация и сублюксация линзы; наклон ИОЛ по отношению к радужке; пигментная дисперсия за счет контакта пигментного листа радужки с линзой).
Несмотря на вышеуказанные проблемы подшивания линзы к радужке, мы считаем данную методику перспективной, обеспечивающей высокие зрительные функции с минимальным процентом осложнений. Нами разработана техника факоэмульсификации с подшиванием линзы к радужке, научная новизна которой заключается в фиксации ИОЛ и ее центрации в момент подшивания за счет временного поддержания капсульной сумки, снижении процента пролапса стекловидного тела в просвет зрачка и сохранении целостности передней гиалоидной мембраны.
Цель исследования: изучить клинические результаты подшивания ИОЛ к радужке у пациентов с исходной нестабильностью связочного аппарата.
Содержание статьи
Материал и методы
В исследовании приняли участие 84 пациента с осложненной катарактой и нестабильностью связочного аппарата, из которых 63 (75%) мужчины и 21 (25%) женщина. Возраст пациентов — от 32 лет до 81 года. Критерии включения: подвывих хрусталика 2–3-й степени по классификации дислокаций хрусталика Н.П. Паштаева и И.В. Куликова [3] и нарушение целостности цинновых связок по данным ультразвуковой биомикроскопии (УБМ) в двух или трех квадрантах. Критерии исключения: 1-я степень дислокации хрусталика и локализация разрыва цинновых связок в 1 квадранте на УБМ, полная люксация хрусталика в витреальную полость.
В 52 случаях подвывих хрусталика был связан с наличием глаукомы (группа 1), в 25 — с травмой глаза в анамнезе (группа 2), в 7 — с синдромом Марфана (группа 3). Пред-операционное состояние глаз представлено в таблице 1.
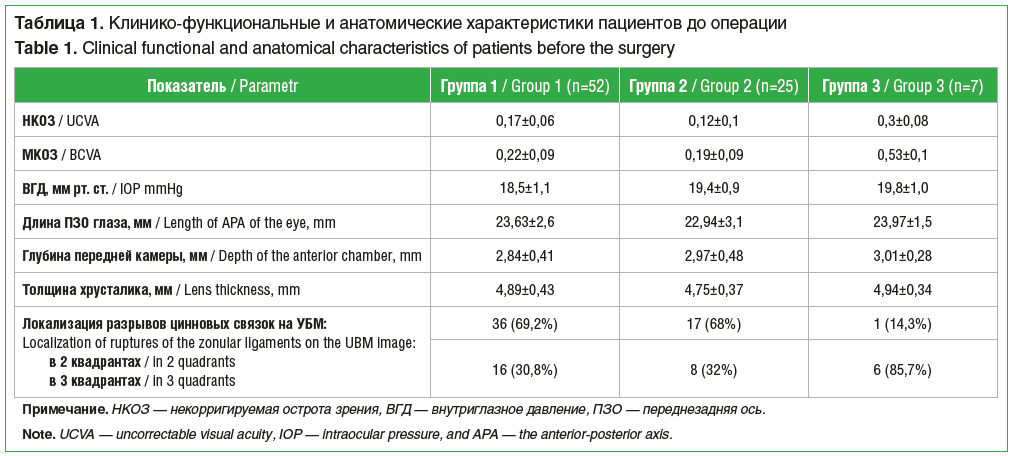
В группе 1 по результатам периметрии 17 (32,7%) пациентов имели развитую стадию глаукомы, а 35 (67,3%) – далеко зашедшую. По классификации LOCS III (The Lens Opacities Classification System III), у 19 (36,5%) пациентов наблюдалась мягкая плотность хрусталика NC (nucleus color) 1-3, у 30 (57,7%) — средней плотности NC 4-5, а у 3 (5,8%) — плотная NC 6.
У пациентов группы 2 по классификации LOCS III у 6 (24%) пациентов выявлена мягкая плотность хрусталика NC 1-3, у 18 (72%) — средней плотности NC 4-5, а у 1 (4%) — плотная NC 6.
У пациентов группы 3 по классификации LOCS III наблюдалась мягкая плотность хрусталика NC 1-3.
Пациентам перед операцией проведено обследование в следующем объеме: визометрия, УБМ, гониоскопия, офтальмоскопия, периметрия, тонометрия (по Маклакову), офтальмометрия, β-сканирование, измерение диаметра зрачка.
В связи с выраженной слабостью связочного аппарата хрусталика возникает трудность проведения факоэмульсификации, так как повышается вероятность интраоперационной люксации хрусталика в витреальную полость. Также этап фиксации ИОЛ без капсульной поддержки в задней камере сопровождается риском смещения линзы. С учетом данных осложняющих факторов нами предложена методика экстракции катаракты и подшивания ИОЛ к радужке.
Техника операции. В паралимбальной области роговицы формируются тоннель 2,2 мм на 9 часах и парацентезы 1,0 мм на 2, 3, 5, 8 и 11 часах по условному циферблату. Далее проводится круговой капсулорексис 5 мм, за край которого подвешивают 4 ирис-ретрактора, тем самым фиксируя иридо-хрусталиковую диафрагму. Проводится факофрагментация и аспирация ядра и кортекса хрусталика (рис. 1A, B). Далее на 5 и 11 часах удаляются 2 ирис-ретрактора (рис. 1C). ИОЛ имплантируется в заднюю камеру на передний листок капсульного мешка, гаптические элементы расположены за радужкой в меридиане 5 и 11 часов (рис. 1D). Капсульная сумка, натянутая между ирис-ретракторами на 2 и 8 часах, выполняет роль диафрагмы, отделяющей витреальную полость от задней камеры (рис. 1C). Также данная структура временно фиксирует линзу в задней камере без инструментальной поддержки. Далее каждый гаптический элемент подшивается к радужке узловым швом 10/0 (рис. 1E, F). После этого снимаются ирис-ретракторы и через тоннель пинцетом удаляется капсульный мешок из-под оптической части линзы (рис. 1G). В завершение проводится гидратация всех парацентезов и тоннеля.
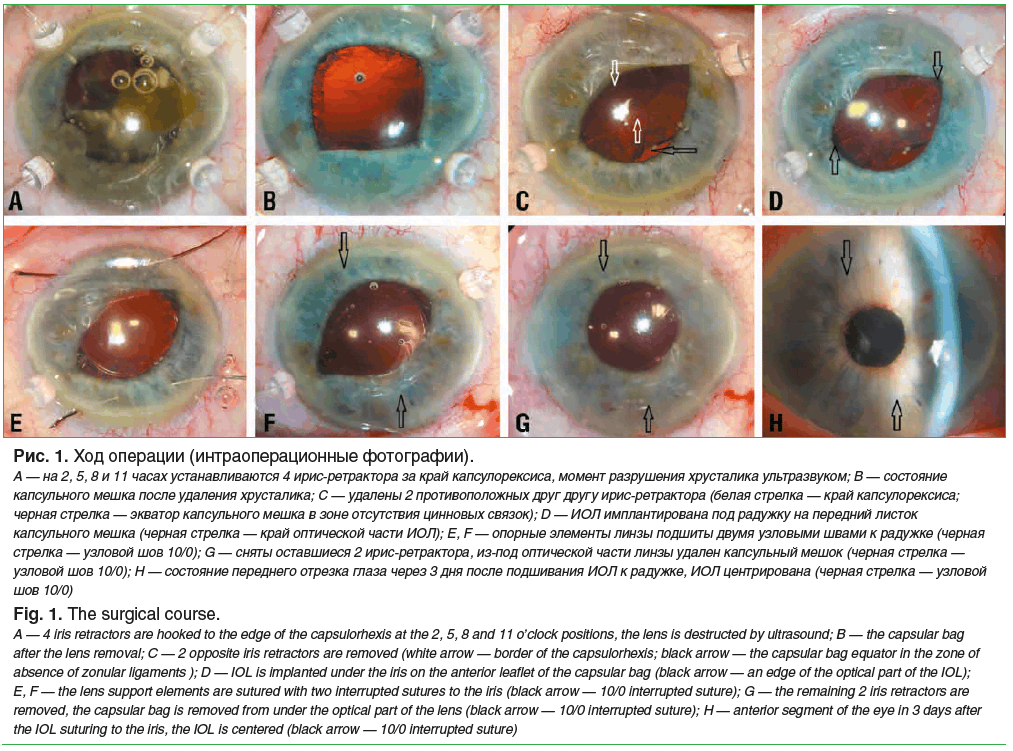
В 47 случаях была имплантирована линза Akreos Adapt AO (Bausch & Lomb, США) с 4 опорными элементами (рис. 1H); в 24 — линза RayOne aspheric (Rayner, Великобритания) с 2 двойными гаптическими элементами, в 13 — линза Tecnis (Johnson & Johnson, США) с 2 одинарными опорными элементами.
Из-за выраженного дефекта цинновых связок на протяжении 2, 3 квадрантов всем пациентам удалялся капсульный мешок без попыток его сохранения.
Статистическая обработка выполнена с использованием программы Statistica 13.0 (StatSoftInc, США). Данные, имеющие нормальное распределение, представлены как среднее значение и стандартное отклонение (M±σ). Категориальные данные указаны в абсолютных значениях и процентных долях (n (%)). В качестве порога статистической значимости принимали значение р<0,05.
Результаты и обсуждение
Во время экстракции катаракты из-за нестабильности хрусталика в 5 случаях был сформирован узкий капсулорексис, у 7 пациентов наблюдались сгустки крови по краю зрачка в месте фиксации ирис-ретрактора за капсулорексис (табл. 2). Средний диаметр зрачка на максимальном мидриазе составил 4,7±1,3 мм, поэтому крючкообразные ирис-ретракторы не только фиксировали хрусталик с нестабильным связочным аппаратом, но и дилатировали зрачок.
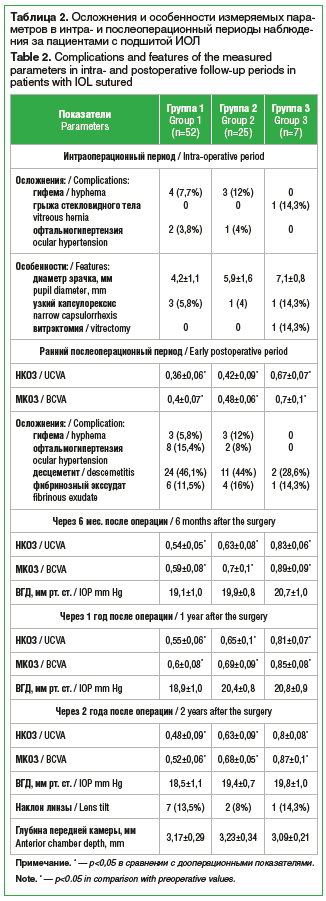
Во время ирригации-аспирации хрусталиковых масс у пациентки из группы 3 возникла грыжа стекловидного тела, что потребовало проведения передней витрэктомии. У 2 пациентов из группы 1 и у 1 пациента из группы 2 наблюдалась интраоперационная офтальмогипертензия. Наличие дефекта цинновых связок хрусталика приводит к повышению риска девиации инфузионных потоков и повышению ВГД. Указанным пациентам проведена задняя частичная витрэктомия для снижения давления в витреальной полости.
Из-за воздействия ирис-ретракторов на узкий зрачок у пациентов с глаукомой и у некоторых пациентов с травматической катарактой на следующий день после операции наблюдалась гифема. Из-за дополнительных манипуляций во время операции (установление ирис-ретракторов и подшивание ИОЛ к радужке) в раннем послеоперационном периоде у пациентов всех групп отмечались признаки воспаления в виде десцеметита и фибринозного экссудата (табл. 2). В раннем послеоперационном периоде у всех пациентов наблюдалось улучшение зрительных функций по сравнению со зрением до операции. В связи с атрофией зрительного нерва у пациентов с глаукомой МКОЗ составила 0,4±0,07, что ниже, чем у пациентов других групп (0,48±0,06 и 0,7±0,1 соответственно).
Через 2 года после хирургического лечения катаракты с несостоятельностью связочного аппарата хрусталика при УБМ наблюдался наклон линзы (в группе 1 — в 13,5% случаев, в группе 2 — в 8%, в группе 3 — в 14,3%). Данное смещение линзы не вызывало значимого снижения зрения и не требовало повторного хирургического вмешательства. У пациентов всех групп ВГД поддерживалось на целевом уровне; МКОЗ составила 0,52±0,06, 0,68±0,05 и 0,87±0,1 соответственно.
При оставленной капсульной сумке у пациентов с явным подвывихом хрусталика, даже с имплантированным внутрикапсульным кольцом, повышается риск контракционного капсульного синдрома и сублюксации блока «ИОЛ + капсульный мешок» в послеоперационном периоде, что требует повторного хирургического вмешательства. Наша тактика при значительной потере связочного аппарата хрусталика также совпадает с мнением других офтальмологов, которые предпочитают проводить факоэмульсификацию вместе с удалением капсульного мешка, после чего подшивают ИОЛ к радужке или транссклерально [11–13].
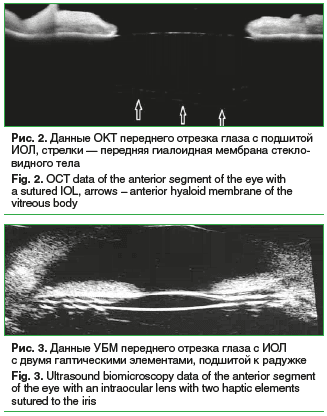
За счет капсульной сумки предложенная методика создает диафрагму между задней камерой и витреальной полостью, что обеспечивает уверенную фиксацию ИОЛ в момент ее подшивания. Данная структура во время манипуляции позволяет центрировать линзу, двигая ее манипулятором по капсульному мешку. Наличие капсульной сумки как отграничительного компонента снижает риск возникновения грыжи стекловидного тела и сохраняет целостность передней гиалоидной мембраны, что подтверждается на снимках оптической когерентной томографии (ОКТ). Также за ИОЛ прослеживается передняя гиалоидная мембрана (рис. 2), что говорит о полном сохранении объема стекловидного тела во время подшивания ИОЛ за счет временного создания диафрагмы капсульным мешком между витреальной полостью и передней камерой. На рисунке 3 визуализируются передняя и задняя поверхности линзы с правильным ее расположением по отношению к радужке. Разнообразие видов гаптических элементов ИОЛ, используемых в данной методике, позволяет сделать вывод о возможности применения предложенной хирургической техники с большинством зарегистрированных ИОЛ на территории России.
По данным Y. Zhang et al. [14], в раннем послеоперационном периоде при УБМ переднего отрезка глаза со склеральной фиксацией линзы в 3% случаев выявлена дислокация ИОЛ, в 3% — полная люксация линзы в витреальную полость. В работе P. Narang et al. [15] представлена техника факоэмульсификации с передней витрэктомией и фиксацией линзы у пациентов с синдромом Марфана и посттравматическими катарактами. В большинстве случаев после удаления капсульного мешка проводилась витрэктомия передней части стекловидного тела, а также его тяжей. В отдаленных сроках послеоперационного наблюдения при УБМ авторами выявлен наклон линзы в 17,4% случаев. В отечественной офтальмологии имеется исследование по измерению наклона и децентрации подшитой к радужке ИОЛ при помощи ОКТ, в котором представлен наклон ИОЛ на 3,02°, а децентрация — 190–259 мкм [16]. По мнению авторов работы, данные показатели не являются клинически значимыми для любого дизайна ИОЛ.
Геморрагические осложнения существующих операций по фиксации ИОЛ при выраженной слабости связочного аппарата хрусталика включают в себя кровоизлияния в переднюю камеру и стекловидное тело. По данным Т.Г. Сажина и соавт. [17], гифема наблюдалась в 5,8% случаев, а гемофтальм — в 2,9%. Предложенная А.А. Кожуховым и соавт. [18] методика транссклеральной фиксации линзы сопровождалась отсутствием гифемы у всех пациентов, у 3,3% пациентов выявлен гемофтальм, который не оказал отрицательного влияния на зрительные функции в отдаленном послеоперационном периоде.
Заключение
Предложенная оригинальная методика подшивания ИОЛ к радужке позволяет создать диафрагму из капсульного мешка при помощи ирис-ретракторов, что дает временную фиксацию линзы и ее центрацию во время подшивания, а также снижает риск пролапса стекловидного тела. Данная техника позволяет использовать ИОЛ с различной формой гаптических элементов, снижает риск послеоперационной децентрации ИОЛ и появления грыжи стекловидного тела в просвете зрачка.
СВЕДЕНИЯ ОБ АВТОРАХ:
Ивачёв Евгений Александрович — к.м.н., доцент кафедры челюстно-лицевой хирургии с курсом офтальмологии и оториноларингологии ФГБОУ ВО «ПГУ»; 440026, Россия, г. Пенза, ул. Красная, д. 40; заведующий офтальмологическим отделением ЧУЗ «КБ «РЖД-Медицина» г. Пенза»; 440600, Россия, г. Пенза, ул. Урицкого, д. 118; ORCID iD 0000-0001-5662-4195
Кочергин Сергей Александрович — д.м.н., профессор кафедры офтальмологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-8913-822X
Ивачёва Ольга Тимуровна — врач-офтальмолог ООО «Глазной центр «ИРИС»; 440018, Россия, г. Пенза, ул. Бекешская, д. 4; ORCID iD 0000-0001-9180-1273
Хмеди Эмин — аспирант, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0003-9164-2825
Хамза Бен Хадж Юнес — аспирант, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский
Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0006-3212-5846
Контактная информация: Ивачёв Евгений Александрович, e-mail: eivachov1@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 01.04.2025.
Поступила после рецензирования 24.04.2025.
Принята в печать 30.04.2025.
ABOUT THE AUTHORS:
Evgenii A. Ivachyov — C. Sc. (Med.), Assistant Professor of the Department of Maxillofacial Surgery with the Ophthalmology and Otorhinolaryngology Course, Penza State University; 40, Krasnaya str., Penza, 440026, Russian Federation; Head of the Ophthalmological Department, Clinical Hospital «RZD-Meditsina» of the city of Penza; 118, Uritsky str., Penza, 440600, Russian Federation; ORCID iD 0000-0001-5662-4195
Sergey A. Kochergin — Dr. Sc. (Med.), Professor of the Department of Ophthalmology, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000‑0002‑8913‑822X
Olga T. Ivachyova — Ophthalmologist, IRIS Ophthalmological Center LLC; 4, Bekeshskaya st., Penza, 440018, Russian Federation; ORCID iD 0000-0001-9180-1273
Emin Khmedi — Postgraduate Student, I.M. Sechenov First Moscow State Medical University (Sechenov University), 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0009-0003-9164-2825
Khamza B.H. Yunes — Postgraduate Student, I.M. Sechenov First Moscow State Medical University (Sechenov University), 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0009-0006-3212-5846
Contact information: Evgenii A. Ivachyov, e-mail: eivachov1@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 01.04.2025.
Revised 24.04.2025.
Accepted 30.04.2025.
материал rmj.ru
