Введение
Кольцо Зоммеринга (КЗ) — один из типов регенераторной формы вторичной катаракты, возникающей в отдаленном послеоперационном периоде хирургии хрусталика. Образование КЗ происходит в результате пролиферации остаточных митотически активных герминативных эпителиальных клеток в замкнутом пространстве экватора капсульного мешка в пределах круговой капсулярной спайки [1].
Название КЗ происходит от имени немецкого патологоанатома Д.В. Зоммеринга, который в 1828 г. впервые описал почти невидимую прозрачную кольцеобразную субстанцию на кадаверных глазах людей, при жизни перенесших экстракцию хрусталика [2].
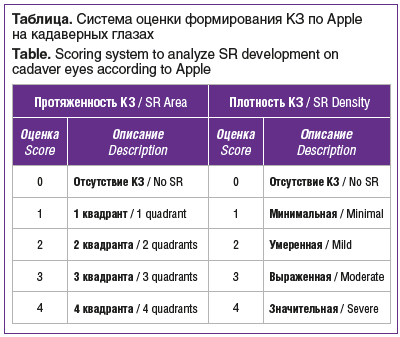
На сегодняшний день не существует клинической классификации КЗ. В 2000 г. D.J. Apple et al. [3] предложили систему оценки КЗ для кадаверных глаз, препарированных с помощью техники Miyake-Apple. Авторы оценивали протяженность по квадрантам и плотность КЗ по 5-балльной шкале (см. таблицу).
В клинической практике диагностика КЗ затруднена ввиду его расположения в «теневой» зоне за радужной оболочкой. При биомикроскопии его обнаружение возможно только при наличии достаточного мидриаза. Основным методом диагностики КЗ является ультразвуковая биомикроскопия (УБМ), при этом кольцо визуализируется как гиперэхогенная структура за радужной оболочкой вокруг края оптической части интраокулярной линзы (ИОЛ). С помощью УБМ возможно проанализировать протяженность КЗ по окружности и толщину КЗ в разных квадрантах, а также оценить взаиморасположение КЗ и близлежащих структур глаза.
Так как КЗ не всегда обнаруживается при осмотре, находится вне оптической зоны и непосредственно не влияет на остроту зрения, его наличие не отражается в клиническом диагнозе в отличие от других форм вторичной катаракты. Однако КЗ может стать источником развития серьезных отдаленных осложнений оперативных вмешательств на хрусталике. Анализ немногочисленных данных литературы позволил выявить несколько состояний, в которых КЗ оказывается ключевым звеном их патогенеза.
Дислокация КЗ
изолированная:
в переднюю камеру;
в заднюю камеру;
в составе комплекса «капсульный мешок хрусталика — ИОЛ».
Вторичная глаукома:
зрачковый блок;
формирование синехий;
в сочетании с плоской радужкой.
Дифференциальная диагностика с новообразованиями радужки.
Синдром «увеит — глаукома — гифема» (УГГ-синдром).
Синдром капсульного блока (СКБ).
Содержание статьи
Дислокация КЗ
Первые упоминания о дислокации КЗ начали появляться в научной литературе с 1910 г. Авторы описывали клинические случаи дислокации КЗ в переднюю камеру у пациентов с афакией [4]. В 1951 г. G.S. Guha [5] были предприняты попытки проанализировать и суммировать основные факторы риска дислокации КЗ, к которым были отнесены молодой возраст, миопия, травма, дегенеративные изменения связочного аппарата или самого КЗ.
Дислокация КЗ в переднюю камеру может снижать остроту зрения пациента при непосредственном закрытии зрачка смещенным КЗ [6]. Кроме того, описаны случаи, когда фрагменты КЗ вызывают обтурацию и разрушение трабекулярной сети и являются источником возникновения вторичной глаукомы [7, 8]. Контакт КЗ с роговичным эндотелием вызывает его декомпенсацию и отек [9, 10].
Также описаны дислокации КЗ в витреальную полость. При этом пациенты предъявляют жалобы на возникновение округлого плавающего помутнения, что можно ошибочно расценить как возникновения кольца Вейса [11, 12]. Дислокация КЗ в заднюю камеру может быть ассоциирована с развитием увеита, невосприимчивого к консервативному лечению без хирургического удаления КЗ как источника воспаления [13].
В наши дни офтальмологи сталкиваются с проблемой поздней дислокации комплекса «ИОЛ — капсульный мешок хрусталика». К основным факторам, вызывающим дислокации, относят прогрессирующий фиброз капсульного мешка, контракционное воздействие на передний капсулорексис, разрушение зонулярных связок ввиду псевдоэксфолиативного синдрома и т. д. [14]. Нередко можно наблюдать наличие КЗ у данных пациентов, при этом его роль как возможного фактора, усугубляющего разрушение связочного аппарата и утяжеляющего вес комплекса, в литературе не описана.
Кольцо Зоммеринга и глаукома
В публикациях многие авторы используют термин «артифакичная глаукома», к которой относят случаи стойкого повышения внутриглазного давления (ВГД) после экстракции хрусталика и имплантации ИОЛ, при условии отсутствия диагноза «глаукома» в анамнезе пациента и непосредственной вовлеченности ИОЛ, ее положения и других факторов, возникших после хирургического вмешательства. I.T. Ragab et al. [15] провели анализ данных 29 таких пациентов и выявили, что КЗ является ключевым звеном патогенеза артифакичной глаукомы в 10,3% случаев. В литературе описано несколько механизмов повышения ВГД ввиду формирования КЗ.
Зрачковый блок
Зрачковый блок является наиболее частой причиной возникновения закрытоугольной глаукомы после катарактальной хирургии [16]. В 2000 г. H. Kobayashi et al. [17] впервые описали клинический случай возникновения зрачкового блока на фоне формирования массивного КЗ, препятствующего перемещению внутриглазной жидкости из задней камеры в переднюю ввиду протяженности кольца от ИОЛ до цилиарного тела по всей его окружности и смещения комплекса «КЗ — капсульный мешок — ИОЛ» кпереди. Для снижения ВГД в данном случае пациенту была проведена лазерная иридотомия (ЛИТ) в сочетании с лазерной капсулотомией через иридотомическое отверстие, что способствовало открытию угла передней камеры.
Патогенез образования зрачкового блока также может быть связан с окклюзией зрачка высвободившимся содержимым КЗ. В описанном Y. Suwan et al. [18] подобном клиническом случае на первом этапе лечения авторы применили ЛИТ, после чего произошло моментальное разрешение зрачкового блока. На втором этапе аспирировали хрусталиковые массы из передней камеры.
Образование передних синехий
Рост КЗ и смещение им радужки кпереди может привести к возникновению иридокорнеального контакта и формированию передних синехий. В литературе описан клинический случай практически круговой передней синехии на фоне увеличенного в размерах КЗ. При этом авторы отмечают, что место образования передних синехий коррелирует с местами проминенции КЗ [19].
Кольцо Зоммеринга в сочетании с плоской радужкой
F. Kitamura et al. [20] описали клинический случай острого повышения ВГД до 56 мм рт. ст. на левом глазу у пациентки 60 лет через 14 лет после факоэмульсификации катаракты. Изначально у пациентки был диагностирован двухсторонний приступ закрытоугольной глаукомы, который удалось купировать с помощью ЛИТ на правом глазу и который потребовал экстракции хрусталика ввиду неэффективности ЛИТ на левом глазу. На момент осмотра на левом глазу у пациентки было выявлено: отек роговицы, мидриаз, периферическая колобома после ЛИТ, неравномерная глубина передней камеры — глубокая в центральных отделах и мелкая на периферии, кроме того, визуализировалось КЗ по всей окружности ИОЛ. С помощью УБМ визуализировали конфигурацию плоской радужки, смещенную кпереди массивным КЗ, контактирующим с задней поверхностью радужки в условиях расширенного зрачка. Инстилляция 2% пилокарпина привела к открытию угла передней камеры и снижению ВГД до нормальных значений. Авторы сделали выводы о необходимости тщательного наблюдения пациентов с конфигурацией плоской радужки после факоэмульсификации катаракты при формировании КЗ [20].
Дифференциальная диагностика с новообразованиями радужной оболочки
Меланома радужки является редким типом злокачественных новообразований и составляет 3–10% среди всех случаев увеальных меланом. Меланома радужки — это состояние, требующее моментальной диагностики и начала лечения ввиду возможности летального исхода. Однако дифференциальная диагностика между доброкачественными и злокачественными новообразованиями радужки на сегодняшний день остается затруднительной [21].
J.A. Shields et al. [22] провели клиническое исследование, включающее 200 пациентов с различными патологическими состояниями, маскирующимися под новообразования радужной оболочки. C.L. Shields et al. [23] привели список заболеваний, требующих дифференциальной диагностики, в который включены кисты радужки, невус, эссенциальная дистрофия радужки, инородное тело радужки и т. д. КЗ в данном списке не упоминается. Однако в литературе описаны два случая, когда при первичной диагностике выступающий участок радужной оболочки над массивным КЗ был принят за кисту радужки и меланому радужки [24, 25].
Таким образом, КЗ следует рассматривать как возможную причину возникновения проминирующих участков радужки у пациентов, перенесших хирургию хрусталика, и включать в список диагнозов для дифференциальной диагностики со злокачественными новообразованиями.
Синдром «увеит — глаукома — гифема»
Синдром «увеит — глаукома — гифема» (УГГ-синдром, синдром Эллингсона) впервые описан в 1977 г. F.T. Elling-son [26] и изначально был связан с имплантацией переднекамерных ИОЛ первого поколения. Несмотря на совершенствование конструкции и материалов ИОЛ, хирургической техники, УГГ-синдром является актуальной проблемой и в настоящее время. Патогенез данного состояния связан с возникновением контакта и трением между ИОЛ и радужной оболочкой или цилиарным телом (iris chafing-синдром), приводящим к хронической травматизации увеальной ткани [27].
Изначально считалось, что основной причиной УГГ-синдрома у пациентов с заднекамерными ИОЛ является их внекапсульное расположение. Однако далее было обнаружено, что возможно развитие УГГ-синдрома и при внутрикапсульном положении ИОЛ [28].
Основная клиническая картина характеризуется тремя основными признаками: вялотекущим увеитом, вторичной глаукомой, рецидивирующими гифемами. Кроме того, выделяют УГГ-плюс синдром в случаях присоединения гемофтальма и/или отека макулы [27].
В литературе имеется описание нескольких клинических случаев возникновения УГГ-синдрома, связанного с наличием у пациента выраженного КЗ. При этом механизмы до сих пор остаются не до конца изученными.
Впервые связь КЗ и УГГ-синдрома описана в статье T.K. Bryant et al. [29] на примере пациента с внутрикапсульным расположением ИОЛ и формированием массивного КЗ, смещающего комплекс «ИОЛ — капсульный мешок» кпереди, что вызывало его трение о радужную оболочку и возникновение характерных симптомов.
Подобный механизм возникновения асимметричных разнонаправленных сил, воздействующих на комплекс «ИОЛ — капсульный мешок» ввиду формирования тяжелого и массивного КЗ, упоминается в статье А.А. Sura et al. [30], в которой авторы делают акцент на том, что не всегда возможно визуализировать контакт комплекса «ИОЛ — капсульный мешок» с помощью УБМ. В описанном ими клиническом примере только при эндоскопии с последующим выполнением прямой циклофотокоагуляции был обнаружен контакт гаптики, находящейся в капсульном мешке, с цилиарным отростком. По мнению авторов, именно КЗ в данном случае было причиной, спровоцировавшей этот контакт.
Имеются данные о возникновении УГГ-синдрома у пациента с трехчастной ИОЛ, гаптические элементы которой были расположены в цилиарной борозде, что допустимо для данной модели ИОЛ. Однако формирование массивного КЗ вызвало смещение ИОЛ относительно плоскости радужки и трение ее оптической части о задний пигментный листок радужной оболочки. В данном случае репозиция ИОЛ с использованием методики «optic capture» способствовала частичному разрешению синдрома (купирование воспаления, но сохранение медикаментозного гипотензивного режима) [31].
В результате своего исследования C.D. Dubois et al. [32] выявили, что КЗ может быть «фундаментом» для воспалительных клеток и появления неоваскуляризации цилиарного тела.
J. Liu et al. [33] высказали предположение о большем риске возникновения УГГ-синдрома при сочетании КЗ с псевдоэксфолиативным синдромом и/или выраженным фиброзом капсулы.
Синдром капсульного блока
Синдромом капсульного блока называют редкое осложнение хирургии катаракты, связанное с накоплением различного типа жидкого материала внутри капсульного мешка в результате окклюзии отверстия переднего непрерывного кругового капсулорексиса ядром хрусталика (интраоперационно) или оптической частью ИОЛ (в послеоперационном периоде), вследствие чего капсульный мешок растягивается.
В литературе предположение об участии КЗ в патогенезе данного синдрома впервые встречается в описании клинического случая V.C. Ghanem et al. в 2003 г. [34]. Предположение о ведущей значимости дезинтеграции листков капсульного мешка в патогенезе СКБ встречалось в нескольких источниках [35, 36]. В 2024 г. Е.А. Рагозина и соавт. впервые описали обнаруженные в своем исследовании доказательства вовлеченности КЗ. С помощью УБМ были визуализированы локальный прорыв кругового капсульного барьера и частичное разрушение структуры КЗ, которое являлось источником жидкого и твердого содержимого ретрооптического пространства [37].
Заключение
Таким образом, КЗ является недооцененной проблемой отдаленного послеоперационного периода хирургии хрусталика, связанной с возникновением различного типа осложнений, потенциально угрожающих зрению, а также создает сложности при замене ИОЛ, вторичной имплантации в афакичный глаз и репозиции дислоцированного комплекса «капсульный мешок хрусталика — ИОЛ». Так как КЗ формируется в течение длительного времени, данные осложнения возникают через годы и десятилетия после хирургии катаракты, что во многих случаях делает диагноз неочевидным. Диагностика КЗ затруднена ввиду его расположения и возможна только с помощью УБМ. Актуальным является дальнейшее исследование КЗ как источника осложнений, разработка системы оценки, изучение возможности профилактики его возникновения.
Сведения об авторах:
Рагозина Екатерина Александровна — врач-офтальмолог 2-го офтальмологического отделения Новосибирского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 630096, Россия, г. Новосибирск, ул. Колхидская, д. 10; ORCID iD 0000-0002-6980-4563
Егорова Елена Владиленовна — д.м.н., заместитель директора по лечебной работе Новосибирского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 630096, Россия, г. Новосибирск, ул. Колхидская, д. 10; ORCID iD 0000-0002-2901-0902
Ермакова Ольга Викторовна — к.м.н., заведующая 2-м офтальмологическим отделением Новосибирского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 630096, Россия, г. Новосибирск, ул. Колхидская, д. 10; ORCID iD 0000-0003-0427-1564
Диреев Артем Олегович — к.м.н., врач-офтальмолог 2-го офтальмологического отделения Новосибирского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 630096, Россия, г. Новосибирск, ул. Колхидская, д. 10; ORCID iD 0000-0003-3801-6844
Контактная информация: Рагозина Екатерина Александровна, e-mail: kate_r08@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 13.11.2024.
Поступила после рецензирования 06.12.2024.
Принята в печать 24.12.2024.
About the authors:
Ekaterina A. Ragozina — Ophthalmologist of the Ophthalmological Department No. 2, Novosibirsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 10, Kolkhidskaya str., Novosibirsk, 630096, Russian Federation; ORCID iD 0000-0002-6980-4563
Elena V. Egorova — Dr. Sc. (Med.), Deputy Director for Clinical Care, Novosibirsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 10, Kolkhidskaya str., Novosibirsk, 630096, Russian Federation; ORCID iD 0000-0002-2901-0902
Olga V. Ermakova — C. Sc. (Med.), Head of the Ophthalmological Department No. 2, Novosibirsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 10, Kolkhidskaya str., Novosibirsk, 630096, Russian Federation; ORCID iD 0000-0003-0427-1564
Artyom O. Direev — C. Sc. (Med.), Ophthalmologist of the Ophthalmological Department No. 2, Novosibirsk Branch
of the S. Fyodorov Eye Microsurgery Federal State Institution; 10, Kolkhidskaya str., Novosibirsk, 630096, Russian Federation; ORCID iD 0000-0003-3801-6844
Contact information: Ekaterina A. Ragozina, e-mail: kate_r08@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 13.11.2024.
Revised 06.12.2024.
Accepted 24.12.2024.
Информация с rmj.ru
