Введение
В последние годы в лечении пациентов с синдромом «сухого глаза» отмечен существенный прогресс, связанный с появлением новых терапевтических средств и разработкой инновационных хирургических методов лечения.
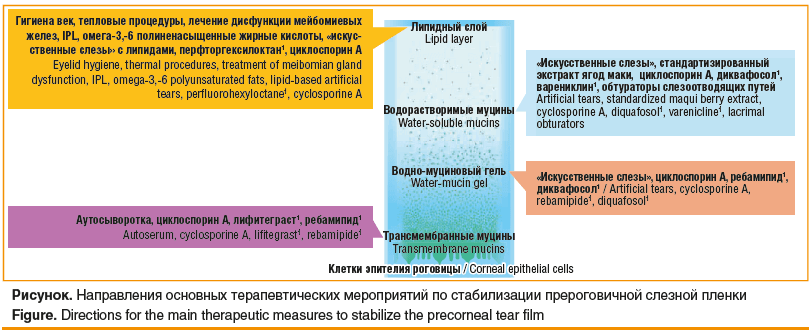
Безусловно, в арсенале практикующего врача амбулаторного звена главенствуют методы консервативного лечения пациентов с роговично-конъюнктивальным ксерозом, в итоге направленные на стабилизацию прероговичной слезной пленки. Вместе с тем их клинико-патогенетический эффект имеет различную направленность (см. рисунок).
Как видно из представленной на рисунке схемы, существующие на сегодняшний день методы лечения позволяют компенсировать дефицит практически любого компонента слезной пленки, а также способствовать купированию воспалительного, ксеротического и дегенеративного процессов в эпителии глазной поверхности.
В частности, восстановить недостаточный объем липидного слоя слезной пленки способны средства, нормализующие функцию мейбомиевых желез: гигиена век с их обработкой очищающими средствами и гелями для физиотерапии век, а также массаж, прогревание век, в том числе интенсивным импульсным светом (IPL), системное применение омега-3, -6 полиненасыщенных жирных кислот [1, 2]. Вместе с тем эти известные и широко используемые терапевтические средства сегодня успешно дополнены систематическими инстилляциями препарата перфторгексилофтана1 — полуфторированного алкана, содержащего липофобный и липофильный сегменты. Он стабилизирует липидный слой слезной пленки, распределяясь на ее поверхности в виде монослоя [3].
Наиболее популярным направлением лечения пациентов рассматриваемого профиля является компенсация дефицита водно-муцинового геля, объединяющего секрет добавочных слезных желез конъюнктивы (водная составляющая), муцины — продукт бокаловидных клеток Бехера, желез Манца, крипт Генле и гликокаликс эпителиальных клеток роговицы (муциновая составляющая слезной пленки) [2]. Соответственно, и компенсация дефицита водно-муцинового геля может быть условно подразделена на восполнение недостатка водной его составляющей и восстановление муцинов, хотя четкую грань между ними провести довольно трудно.
Результатом исследований, посвященных изучению возможностей восполнения объема водной составляющей водно-муцинового геля, стала разработка препарата «искусственной слезы» — 3% диквафосола натрия1, эффект которого связан со стимуляцией продукции слезы и муцинов за счет повышения активности агониста пуринорецепторов P2Y2 [4], а также назального спрея варениклина1. Последний является низкомолекулярным агонистом никотиновых ацетилхолиновых рецепторов (nAChR), которые расположены на свободных нервных окончаниях ветвей тройничного нерва в слизистой оболочке носа, и связывается с ними, стимулируя выработку слезной жидкости [5]. Эффективность в указанном отношении в проведенных с нашим участием исследованиях также продемонстрировала биологически активная добавка, представляющая собой стандартизированный экстракт ягод маки (Аристотелия чилийская) [6]. Решить эту же задачу призвана обтурация слезоотводящих путей одним из многочисленных способов [2], например с помощью силиконовых пробочек [7]. Ведутся исследования по изучению эффективности систематических инстилляций ребамипида1, в том числе в сочетании с закапыванием аутосыворотки пациента, что способствует нормализации формирования гликокаликса эпителиальных клеток роговицы и конъюнктивы [8].
Задачу купирования воспалительного процесса в клетках эпителия глазной поверхности решают длительные инстилляции в конъюнктивальную полость препаратов циклоспорина А, лифитеграста1 (низкомолекулярный ингибитор интегрина, воздействующего на функционально-ассоциированный антиген лимфоцитов 1), глюкокортикоидов, отчасти — нестероидных противовоспалительных препаратов [1, 2].
Содержание статьи
Современные препараты «искусственной слезы»
Возвращаясь к схеме основных направлений терапевтических мероприятий у пациентов с синдромом «сухого глаза», следует отметить разнонаправленный механизм осуществления эффекта некоторых препаратов и многих растворов «искусственной слезы» (см. рисунок). В частности, Катионорм (Santen), представляющий собой катионную водную эмульсию, обладает способностью протезировать все слои слезной пленки, включая липидный, разрывая порочный круг синдрома «сухого глаза» и предотвращая прогрессирование заболевания.
Кроме того, сразу несколько препаратов, наряду с замещением водной составляющей слезной пленки, позволяют имитировать ее муциновый компонент благодаря высокой мукоадгезивности (табл. 1). Основу таких препаратов составляют природные мукополисахариды (гиалуроновая кислота (ГК), полисахарид из семян тамаринда, экстракта семян бобового дерева гуара и др.), а также искусственная карбоксипропилметилцеллюлоза [2].
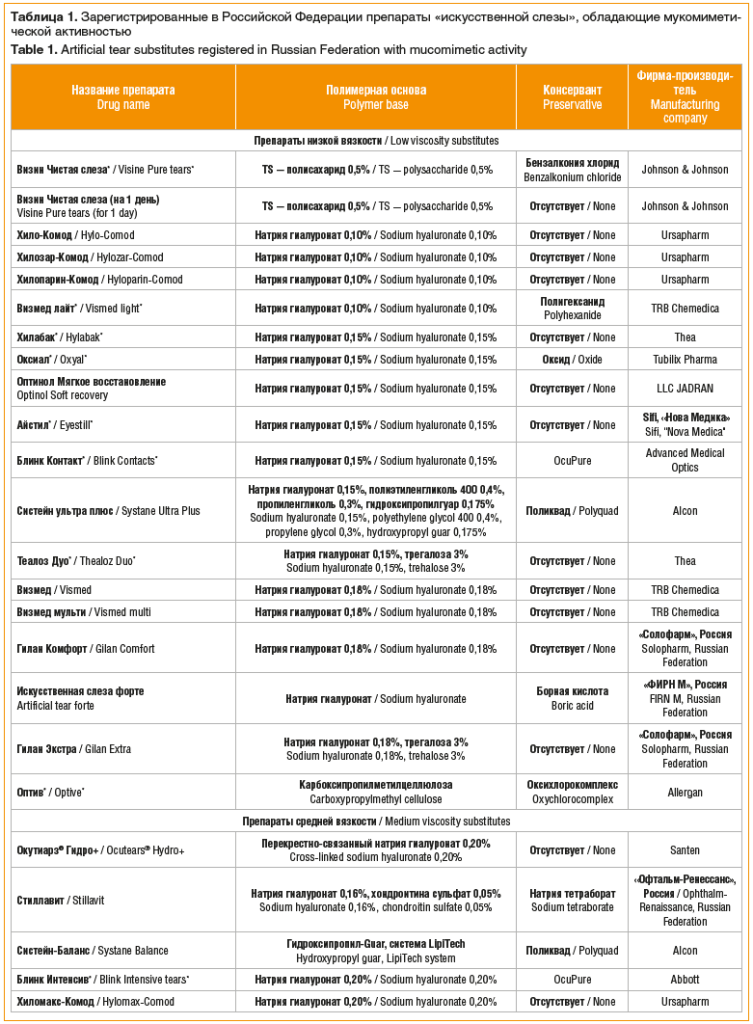
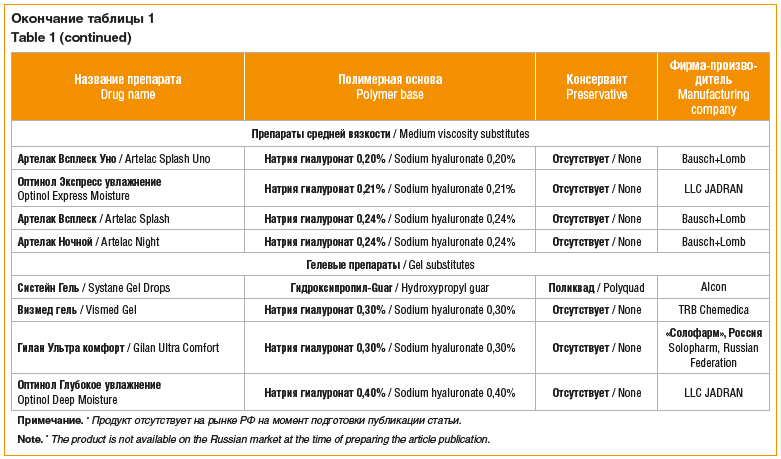
Как видно из таблицы 1, большинство препаратов ГК производятся в виде ее натриевой соли, гиалуроната натрия, что позволяет увеличить устойчивость ГК к окислению [9]. Ранее было показано, что гиалуронат натрия имеет небольшую молекулярную массу, позволяющую повысить его проникновение в ткани и биодоступность, обладая в то же время практически теми же свойствами, что и нативная ГК соответствующей молекулярной массы [9].
На сегодняшний день гиалуронат натрия является полимерной основой 27 препаратов «искусственной слезы» (54% от 50 зарегистрированных в РФ слезозаменителей).
Мукоадгезивность и обусловленное ею длительное пребывание на глазной поверхности молекул ГК (с одной стороны — связывающихся силами адгезии с муцинами слезной пленки, с другой — удерживающихся на гликокаликсе эпителиальных клеток роговицы и конъюнктивы) закономерно способствуют длительному увлажнению глазной поверхности и купированию признаков ксероза глазной поверхности [1, 2]. Кроме того, ГК обладает еще рядом полезных, применительно к ее роли в препаратах «искусственной слезы», качеств: биосовместимостью, биодеградацией, неиммуногенностью, гигроскопичностью и, наконец, тиксотропностью [10]. Физиологические механизмы реализации основных свойств ГК представлены в таблице 2.
![Таблица 2. Основные биологические свойства ГК и механизмы их реализации [1, 2, 9–12] Table 2. Main biological properties of HA and their implementation mechanisms [1, 2, 9–12] Таблица 2. Основные биологические свойства ГК и механизмы их реализации [1, 2, 9–12] Table 2. Main biological properties of HA and their implementation mechanisms [1, 2, 9–12]](https://medblog.su/wp-content/uploads/2025/01/1737635512_786_Sovremennye-vozmozhnosti-stabilizatsii-sleznoj-plenki-Brzheskij-VV-Kim-GG.png)
В частности, способность образовывать единый комплекс одновременно со многими молекулами воды обеспечивает высокую степень гидратации ГК. Как известно, 1 г ГК способен удержать до 6 л воды, что существенно превышает соответствующие возможности любой другой природной или искусственной основы слезозамещающего препарата [9, 11].
Однако особого внимания заслуживают вязкоэластические свойства (тиксотропность) высокомолекулярной ГК: в статичном состоянии (между миганиями) на открытой глазной поверхности цепочки ГК образуют густую сеть — матрицу, обеспечивающую высокую вязкость и, соответственно, длительное увлажнение поверхности глазного яблока и стабилизацию слезной пленки. В то же время при возрастании скорости сдвига разрушаются межмолекулярные водородные связи: цепочки ГК деформируются и выравниваются в направлении сдвига. Это происходит, в частности, на фоне миганий, когда скорость сдвига достигает 20 000 с-1, а вязкость ГК на мгновение резко снижается и ГК свободно «растекается» по глазной поверхности, не затуманивая зрения [13].
Наряду с перечисленными выше свойствами, высокомолекулярная ГК также стимулирует миграцию клеток эпителия роговицы, активирует процессы репаративной регенерации, уменьшает продукцию и активность провоспалительных медиаторов и матриксных металлопротеиназ, обладает антиоксидантными и иммуносупрессивными свойствами. Эти функции, в частности, проявляются в элиминации свободных радикалов кислорода, ингибировании миграции и агрегации лейкоцитов, макрофагов и др. [12, 13].
Очевидно, что такие препараты «искусственной слезы» способны компенсировать дефицит одновременно как водной, так и муциновой составляющей водно-муцинового геля (см. рисунок), что служит дополнительной причиной приверженности пациентов и врачей терапии ксероза глазной поверхности слезозаменителями на основе натриевой соли ГК.
В то же время в клинической практике имеется потребность в совершенствовании увлажняющих свойств препаратов «искусственной слезы» путем повышения их гигроскопичности, снижения скорости биодеградации и повышения продолжительности пребывания в конъюнктивальной полости и в структуре прероговичной слезной пленки. Кроме того, представляется целесообразным обеспечение возможности высвобождения конъюгированных с натриевой солью ГК лекарственных препаратов [14, 15].
Перекрестно-связанная ГК и возможности ее применения в слезозамещающей терапии
Достичь указанных выше целей стало возможно за счет перекрестного связывания (сшивания) молекул ГК, в ходе которого используются такие «сшивающие агенты», как карбодиимид гидрохлорида, мочевина [15], этиловый эфир ГК-цистеина, полифункциональные диэпоксиды, глутаровый альдегид, дивинилсульфон и др. Они соединяют цепи нативной или конъюгированной ГК посредством двух или более ковалентных связей [16, 17]. В указанных целях также нашли применение N-винилпирролидон, а также фотосшивка ГК ультрафиолетом или тиол-еновой реакцией, индуцированной видимым светом [18–21]. Физико-химические качества вещества, используемого для сшивки, напрямую влияют на механические свойства и деградацию ГК. Так, например, кросс-линкинг карбоксильных групп ГК с помощью карбодиимида гидрохлорида является предпочтительным, так как при деградации он распадается до водорастворимых производных мочевины, не оказывающих цитотоксического действия на глазную поверхность. ГК, поперечно-связанная с помощью карбодиимида гидрохлорида, является максимально биосовместимой с глазной поверхностью [22].
В результате перекрестного связывания возрастает устойчивость трехмерной полимерной сетки ГК к ферментативному разложению [15]. Вязкость за счет связывания ее цепочек увеличивается, что обеспечивает более продолжительный контакт с эпителием глазной поверхности и более интенсивное его увлажнение. Это закономерно позволяет уменьшить частоту закапываний основанного на перекрестно-связанной ГК препарата «искусственной слезы» [13].
Многочисленные доклинические исследования возможностей применения перекрестно-связанной ГК в офтальмологии продемонстрировали ее эффективность в концентрациях 0,02 и 0,4% в отношении реэпителизации роговицы (in vitro) после ее ранения [17], а также in vivo (на кроликах) — вследствие механической травмы и щелочного ожога. В последнем случае эпителизация роговицы на фоне четырехкратных инстилляций перекрестно-связанного гиалуроната натрия наступала практически в два раза быстрее, чем в контрольных группах (фосфатный буфер) [23].
Сходные результаты были получены в исследованиях на кроликах и собаках уже с моделями «сухого» кератоконъюнктивита [24, 25], а также при лечении острых и торпидных язв роговицы у собак и кошек [26]. В работе [26] был апробирован гидрогель сшитой ГК (в концентрациях 0,33 и 0,75%), репаративный эффект которого оказался более выраженным, чем у линейной ГК.
Столь же эффективным оказался гидрогель сшитой посредством тиол-еновой реакции (индуцированной синим светом) ГК и в концентрации 0,1%: в эксперименте на крысах на модели щелочного ожога роговицы отмечено ускорение ее эпителизации и купирования воспалительного процесса [27]. Исследователи объясняют эффект препарата повышенной гигроскопичностью гидрогеля, его устойчивостью к биодеградации и продолжительностью пребывания на роговице. Указанные свойства позволяют рассматривать возможность его использования в качестве носителя лекарственных веществ в глазных каплях [27].
Перекрестно-связанную 0,2% ГК впервые в клинической практике с успехом применили C. Cagini et al. [28] при лечении больных с синдромом «сухого глаза», обусловленного синдромом Шегрена, сравнивая ее с линейной ГК той же концентрации. При этом исследуемый препарат показал большую эффективность в стабилизации слезной пленки по сравнению с линейной ГК, что авторы исследования объясняют высокой вискоэластичностью перекрестно-связанной ГК, а также более длительным пребыванием на глазной поверхности.
Исследования E.I. Postorino et al. [29] выявили значительное снижение индекса поражения глазной поверхности (OSDI) и выраженности прокрашивания роговицы у больных с синдромом «сухого глаза» на фоне инстилляций перекрестно-связанной ГК и коэнзима Q10 (группа А) по сравнению с закапыванием линейной ГК той же концентрации 0,15% (группа Б). У пациентов в группе А также значительно улучшилась и функция мейбомиевых желез.
Установлена также способность гидрогеля перекрестно-связанной ГК ускорять эпителизацию роговицы после фоторефракционной кератэктомии [30], что расширяет показания к ее применению.
Немаловажно, что перекрестно-связанная ГК приближается к естественной слезе по физико-коллоидным свойствам, что доказано результатами сравнительного кристаллографического исследования нативной слезы и различных полимерных слезозаменителей [31]. Как известно, образование структурированных папоротниковых узоров после испарения микрокапель слезы является характерной особенностью коллоидной системы слезной жидкости и достаточно информативным показателем мукомиметичности и терапевтического потенциала исследуемых растворов «искусственной слезы» [32, 33].
Как показали результаты кристаллографических исследований, физико-коллоидные свойства перекрестно-связанной ГК и нативной слезы оказались сходными даже при использовании исследуемого препарата в концентрации на порядок ниже, чем у прочих слезозаменителей [31]. Это служит косвенным доказательством возможности влияния перекрестно-связанной ГК на структуру не только водно-муцинового геля слезной пленки, но и ее липидного слоя, в том числе и на его распределение по поверхности водно-муцинового геля [34]. Так, исследования in vitro показали, что мукомиметические полимеры (в частности, ГК), содержащие длинные полианионные полисахаридные фрагменты, имитирующие остатки сиаловой кислоты секреторных гликопротеинов муцина [35], могут модулировать распространение пленок секрета мейбомиевых желез и липидов слезы на поверхности слезной пленки.
Рассмотренные выше результаты многочисленных экспериментальных и клинических исследований явились основанием для разработки препарата «искусственной слезы» Окутиарз® Гидро+ (Santen). Данный офтальмологический раствор не содержит консерванта, предназначен для слезозаместительной терапии больных с синдромом «сухого глаза» (в том числе с компьютерным зрительным синдромом, проявляющимся, в частности, в жалобах на сухость глаз в вечерние часы, после напряженной зрительной работы), в качестве увлажнителя для облегчения дискомфорта при ношении контактных линз, особенно в период адаптации к ним, для защиты роговицы и ускорения заживления глазной поверхности после операций по поводу катаракты и кераторефракционных вмешательств. Полимерной основой препарата служит охарактеризованная выше перекрестно-связанная ГК (натрия гиалуронат) в концентрации 0,2%, что обеспечивает комфорт и не вызывает ощущения склеивания и затуманивания зрения, наблюдаемые иногда при использовании ГК в более высокой концентрации2.
С учетом того, что в последние годы в ряду этиологических факторов синдрома «сухого глаза» все чаще фигурирует компьютерный зрительный синдром [2], нами была оценена возможность купирования признаков «сухого глаза» у 14 таких пациентов — студентов университета. В качестве иллюстрации приводим клиническое наблюдение.
Клиническое наблюдение
Пациент С., 22 года. Студент медицинского университета, время работы за компьютером достигает 6 ч в день. Предъявляет жалобы астенопического характера, а также на ощущение сухости, дискомфорта за веками, переходящего в ощущение жжения. Эти явления возникают через 20–30 мин работы за компьютером и продолжаются в течение всего «экранного времени». Попытки использовать препараты «искусственной слезы» низкой вязкости успеха не имели.
При обследовании: индекс поражения глазной поверхности (OSDI) — 42 (соответствует ксерозу средней степени) [36]. На обоих глазах определяется легкая гиперемия бульбарной конъюнктивы, индекс слезного мениска 2,0, время разрыва слезной пленки (по Норну) 6 с на правом и 4 с на левом глазу. Прокрашивание эпителия бульбарной конъюнктивы 3% лиссаминовым зеленым в пределах открытой глазной щели — 4 и 5 по шкале Oxford [37].
Выставлен диагноз: компьютерный зрительный синдром, артифициальный синдром «сухого глаза» средней степени.
Пациенту был назначен Окутиарз® Гидро+ в режиме инстилляций «по ощущениям» в течение дня и закапываний каждые 1,5 ч в период работы за компьютером.
Через 1 мес. терапии пациент отметил существенное уменьшение выраженности астенопических жалоб, а также субъективных проявлений синдрома «сухого глаза», увеличилась продолжительность «бессимптомной» работы за компьютером. Индекс OSDI составил 14 баллов, что соответствует ксерозу легкой степени [36]. Уменьшилась гиперемия бульбарной конъюнктивы, стабильность слезной пленки возросла до 10 с на правом глазу и до 6 с — на левом. Прокрашивание бульбарной конъюнктивы отсутствует.
Пациент удовлетворен лечением и продолжает его.
Таким образом, препарат Окутиарз® Гидро+ продемонстрировал эффективность также и в наших наблюдениях за пациентами с синдромом «сухого глаза» на почве компьютерного зрительного синдрома.
Заключение
В целом современные методы лечения пациентов с синдромом «сухого глаза» предусматривают возможность восполнения дефицита всех компонентов слезной пленки и, согласно рекомендациям Международной рабочей группы по исследованию «сухого глаза» TFOS DEWS-II [1], должны назначаться совместно и в то же время дифференцированно, с учетом патогенеза заболевания. При этом применение препаратов «искусственной слезы» во многом решает рассматриваемую проблему благодаря их универсальному влиянию на восстановление основных компонентов слезной пленки. В этой связи разработка и апробация в широкой клинической практике офтальмологического раствора Окутиарз® Гидро+, основанного на перекрестно-связанной ГК, является важным шагом в заместительной и метаболической терапии пациентов с синдромом «сухого глаза».
1Не зарегистрирован в Российской Федерации.
2Инструкция по применению медицинского изделия Раствор офтальмологический стерильный ОКУТИАРЗ® ГИДРО+. (Электронный ресурс.) URL: https://docs.nevacert.ru/files/med_reestr_v2/62962_instruction.pdf (дата обращения: 12.07.2024).
Сведения об авторах:
Бржеский Владимир Всеволодович — д.м.н., профессор, заведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0001-7361-0270.
Ким Герман Геннадьевич — аспирант кафедры офтальмологии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-7621-4019.
Бобрышев Всеволод Андреевич — ассистент кафедры ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-3999-7173.
Контактная информация: Бржеский Владимир Всеволодович, e-mail: vvbrzh@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.06.2024.
Поступила после рецензирования 28.06.2024.
Принята в печать 21.07.2024.
About the authors:
Vladimir V. Brzheskiy — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0001-7361-0270.
German G. Kim — postgraduate student of the Department of Ophthalmology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-7621-4019.
Vsevolod A. Bobryshev — assistant of the Department of Ophthalmology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-3999-7173.
Contact information: Vladimir V. Brzheskiy, e-mail: vvbrzh@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.06.2024.
Revised 28.06.2024.
Accepted 21.07.2024.
материал rmj.ru
