Введение
Розеоловирусы распространены повсеместно и характеризуются пожизненной персистенцией в клетках организма человека с последующей реактивацией и формированием хронической патологии.
Внимание исследователей привлекают вирусы герпеса человека (ВГЧ), открытые после 1985 г., в частности ВГЧ-6A/6B, ВГЧ-7. По последней классификации Международного комитета по таксономии вирусов, ВГЧ типов 6А, 6B и 7 относятся к роду Roseolovirus, подсемейству Betaherpesvirinae, семейству Orthoherpesviridae1. Несмотря на то, что ВГЧ-6A, ВГЧ-6B и ВГЧ-7 имеют различие в геноме не более 50%, а ВГЧ-6A и ВГЧ-6В — не более 10%, их роль в развитии патологии человека различна.
Продемонстрирована широкая распространенность лабораторных маркеров этих инфекций, вызванных данными вирусами, у детей. Частота выявления антител к ВГЧ-6A/B высока среди населения и может варьировать в разных странах от 70 до 100%, исследования указывают на то, что преобладающее большинство детей уже инфицированы к 3-летнему возрасту [1, 2]. Распространенность серопозитивности к ВГЧ-7 среди детского и взрослого населения также велика, однако его распространение начинается в более поздний период и происходит медленнее, чем у ВГЧ-6A/B. В среднем начало инфицирования приходится на возраст около 2 лет, а серопревалентность >90% достигается, по разным данным, к возрасту 6–10 лет [1, 3].
После 2012 г. стало совершенно очевидно, что ВГЧ-6 — это 2 разных вируса, геном которых отличается между собой всего на 10% [4]. Однако тропизм ВГЧ-6A и ВГЧ-6B к тканям, эпидемиология, клиническое течение и патофизиология заболеваний, вызванных ими, различаются. ВГЧ-6A и ВГЧ-6B используют разные клеточные рецепторы для проникновения в клетку, что объясняет их различный клеточный тропизм. Так, ВГЧ-6A использует CD46-рецепторы, которые экспрессируются на всех ядерных клетках, а ВГЧ-6B взаимодействует с CD134-рецепторами, которые преимущественно экспрессируются на поверхности Т-лимфоцитов [5–7]. Это определяет различный характер инфицирования и персистенции вирусов.
Так, для нейротропного ВГЧ-6A характерно развитие тяжелых случаев неврологических заболеваний. ВГЧ-6A обнаружен в тканях ЦНС пациентов с рассеянным склерозом, а ДНК ВГЧ-6A выявлена в образцах крови и спинномозговой жидкости пациентов с рассеянным склерозом. До 72% глиальных опухолей у детей содержат генетический материал ВГЧ-6A [8–11]. Есть данные о связи ВГЧ-6А с тиреоидитом Хашимото и с синцитиально-гигантоклеточным гепатитом у пациентов после трансплантации печени [12, 13].
Острая первичная инфекция, вызванная ВГЧ-6B, получила название «детская розеола», или «внезапная экзантема». Данное заболевание характерно для детей раннего возраста и проявляется лихорадкой, пятнистой сыпью, фебрильными судорожными приступами [2]. ВГЧ-6B обнаруживается в тканях глоточной и небной миндалин у детей с острыми инфекциями верхних дыхательных путей и хронической патологией аденотонзиллярной зоны [14]. На большой группе детей продемонстрировано, что ДНК ВГЧ-6B длительно выделяется в ротоглотке после перенесенной первичной инфекции. Имеются данные о выявлении ДНК вируса у клинически здоровых детей почти через 2 года после перенесенной внезапной экзантемы [15].
В мононуклеарных клетках периферической крови ВГЧ-6B выделен после трансплантации как солидных органов, так и костного мозга, стволовых клеток, что свидетельствует о реактивации инфекции [16–18].
Одним из уникальных свойств ВГЧ-6A/B является хромосомная интеграция — возможность вируса встраиваться в геном человека, не вызывая при этом развития инфекционного процесса. Данный феномен регистрируется в человеческой популяции примерно в 1% случаев [19, 20]. Эта особенность рассматривается некоторыми авторами как основной механизм персистенции ВГЧ-6A/B, в том числе и в зародышевой линии клеток. Хромосомно-интегрированный статус пациентов описан как для ВГЧ-6A, так и для ВГЧ-6B [2].
В отличие от ВГЧ-6A/B, выделенного от пациента с лимфопролиферативным заболеванием в 1986 г., ВГЧ-7 был выделен впервые от здорового человека в 1990 г. [21, 22]. Предполагается, что CD4+ Т-лимфоциты являются клетками-мишенями для ВГЧ-7, который использует CD4-рецепторы для проникновения в клетку-хозяина [23]. Достоверно зарегистрированных случаев хромосомной интеграции для ВГЧ-7 не описано.
Клиническое значение ВГЧ-7 на данный момент остается дискутабельным. Однако имеются данные литературы о протекании сходного с ВГЧ-6B острого первичного заболевания, вызванного ВГЧ-7. Острое лихорадочное состояние с экзантемой и фебрильным судорожным приступом, по данным ряда авторов, в 10% случаев связано с ВГЧ-7 [24]. Среди детей с сыпью неясного генеза, после исключения кори и краснухи, маркеры ВГЧ-7-инфекции выявляют в 32–40% случаев. Имеются данные о развитии тяжелых форм первичной инфекции ВГЧ-7, проявляющихся неврологической симптоматикой [25]. Так же, как и ВГЧ-6B, ВГЧ-7 был обнаружен в слюне, ткани глоточной и небной миндалин у пациентов с инфекционно-воспалительными заболеваниями ротоглотки [26].
Ограничением исследований, посвященных выделению ДНК розеоловирусов в ткани глоточной и небной миндалин у пациентов с инфекционно-воспалительной патологией, является отсутствие группы сравнения (условно здоровых). В работе [27] определяли наличие специфических анти-ВГЧ-7 и анти-ВГЧ-7 IgM и IgG, что не позволяет судить об активности инфекционного процесса, а лишь о распространенности серопозитивности к ВГЧ-7.
Таким образом, учитывая повсеместную распространенность вирусов группы герпеса человека, в также существование здорового носительства, необходимо проведение новых исследований для оптимизации диагностики и терапии инфекций, вызываемых ими.
Цель исследования: определение роли ВГЧ-6A, ВГЧ-6B и ВГЧ-7 в формировании инфекционно-воспалительных заболеваний, протекающих с поражением верхних дыхательных путей, у детей.
Содержание статьи
Материал и методы
Исследование выполнено в дизайне сравнительного когортного проспективного исследования и проведено в два этапа. Целью первого этапа было определить роль ВГЧ-6A/B и ВГЧ-7 в формировании острых респираторных заболеваний верхних дыхательных путей у детей. Цель второго этапа — определение роли ВГЧ-6А, ВГЧ-6B и ВГЧ-7 в формировании хронической патологии — гипертрофии глоточной миндалины у детей.
На первом этапе на базе ГАУЗ МО ХОБ обследовано 139 детей от 1 года до 16 лет (медиана 6 лет), из них 79 мальчиков, 60 девочек.
Пациенты разделены на две группы, сопоставимые по возрасту и полу: основную, в которую вошли дети с клиническими проявлениями ОРВИ в первые 2 сут от начала заболевания (n=75, 46 мальчиков и 29 девочек), и группу сравнения (n=64, 33 мальчика и 31 девочка) — условно здоровые дети, без клинических проявлений инфекционного заболевания. Критериями включения для детей основной группы являлись: наличие у пациентов клиники ОРВИ, развившейся в течение не более чем за 3 дня от даты обследования; для здоровых детей (группа сравнения): отсутствие жалоб на момент включения в исследование. Общие критерии включения: возраст от 1 мес. до 17 лет 11 мес. 30 дней; отсутствие у пациентов иммунодефицитных состояний как врожденных, так и приобретенных.
Критерии невключения: участие в других исследованиях за последние 6 мес. от момента начала данного исследования; несоответствие хотя бы одному из критериев включения в исследование.
Критерии исключения: непредоставление пациентом или его родителями/усыновителями исследуемого материала в предписанные данным исследованием сроки; желание пациента или его родителя/усыновителя досрочно завершить исследование по любой причине; ошибочное включение непригодного к участию в исследовании пациента; развитие инфекции нижних дыхательных путей у детей из основной группы.
Дети разделены на 3 возрастные группы: младшую возрастную группу, в которую вошли дети от 1 года до 3 лет 11 мес. (33 (24%), 15 девочек и 18 мальчиков), среднюю возрастную группу — дети от 4 до 6 лет 11 мес. (52 (37%), 20 девочек и 32 мальчика), старшую возрастную группу — дети 7 лет и старше (54 (39%), 25 девочек и 29 мальчиков).
В основной группе дети имели признаки риносинусита — 51 (68%) пациент, тонзиллофарингита — 64 (85%), кашель — 34 (45%), конъюнктивит — 9 (12%) детей, у 7 (9%) пациентов зарегистрирован фебрильный судорожный приступ, у 10 (13%) — инфекционная экзантема.
У каждого ребенка взят образец цельной крови в пробирку с ЭДТА и мазок со слизистой оболочки ротоглотки в пробирку с транспортной средой.
На втором этапе исследования обследован 41 ребенок от 1 года до 14 лет (медиана 7 лет) — 31 мальчик, 10 девочек. Дети были также разделены на две группы: основную группу (n=27, 18 мальчиков и 9 девочек), которая включала детей с гипертрофией глоточной миндалины 3-й степени, и группу сравнения (n=14, 13 мальчиков и 1 девочка) — клинически здоровые дети без признаков гипертрофии глоточной миндалины.
Критериями включения на втором этапе исследования для детей из основной группы являлись: наличие показаний к проведению планового оперативного лечения гипертрофии глоточной миндалины; для здоровых детей (группа сравнения) — отсутствие жалоб на момент включения в исследование. Общие критерии: возраст от 1 мес. до 17 лет 11 мес. 30 дней; отсутствие у пациентов иммунодефицитных состояний как врожденных, так и приобретенных. Критерии невключения в исключение соответствовали таковым для первого этапа исследования.
В основной группе исследовали образцы тканевого операционного материала, полученного в ходе плановой аденоидэктомии по неонкологическим показаниям, на наличие ДНК ВГЧ. В группе сравнения брали мазки-отпечатки с поверхности глоточных миндалин здоровых детей. В полученных образцах выделяли ДНК ВГЧ методом ПЦР.
Количественное определение ДНК ВГЧ в образцах цельной крови, мазках со слизистой оболочки ротоглотки, образцах тканевого операционного материала и мазках-отпечатках проведено методом ПЦР-РВ с использованием методик и наборов реагентов производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
Статистический анализ осуществляли в программе StatTech v. 4.4.1 (ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова — Смирнова. Количественные переменные при нормальном распределении описаны как средние значения с указанием стандартного отклонения (SD), при распределении, отличном от нормального, — с помощью медианы (Me) и 1-го и 3-го квартилей (Q1–Q3). Для категориальных данных указаны абсолютные значения и доли (%). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна — Уитни. Процентные доли при анализе таблиц сопряженности сравнивали с помощью критерия χ2 Пирсона, точного критерия Фишера. Различия считали статистически значимыми при p<0,05.
Исследование получило одобрение локального этического комитета, у законных представителей каждого из пациентов взято информированное согласие об участии в исследовании.
Результаты исследования
В ходе первого этапа исследования установлено, что хотя бы в одной из исследованных сред ДНК ВГЧ выявлена у 124 (89%) обследованных пациентов, чаще в группе сравнения — у 59 (92%), в основной группе — у 65 (87%) детей (р=0,413) (см. таблицу).
Наиболее распространенными ВГЧ, ДНК которых были обнаружены в исследованных средах, являлись ВГЧ-6A/B и ВГЧ-7. Выявлены тенденции к более частому обнаружению ДНК ВГЧ-6A/B и ВГЧ-7 в группе условно здоровых детей, чем в группе детей с ОРВИ (р=0,473 и 0,362 соответственно).
Маркеры ВГЧ-6A/B обнаруживались чаще у девочек — 45 (75%), чем у мальчиков — 44 (56%) (р=0,019). ДНК ВГЧ-6A/B определена в образцах цельной крови также чаще у девочек — 36 (61%), чем у мальчиков — 32 (41%) (р=0,020). В материале со слизистой оболочки ротоглотки ДНК ВГЧ-6 выявлена у 29 (48%) девочек и у 28 (35%) мальчиков (р=0,126). ДНК ВГЧ-7 определена у 39 (65%) девочек и 51 (65%) мальчика (р=0,957); в образцах цельной крови — у 29 (48%) девочек и 44 (56%) мальчиков (р=0,389); в отделяемом со слизистой оболочки ротоглотки — у 37 (62%) девочек и 42 (53%) мальчиков (р=0,316).
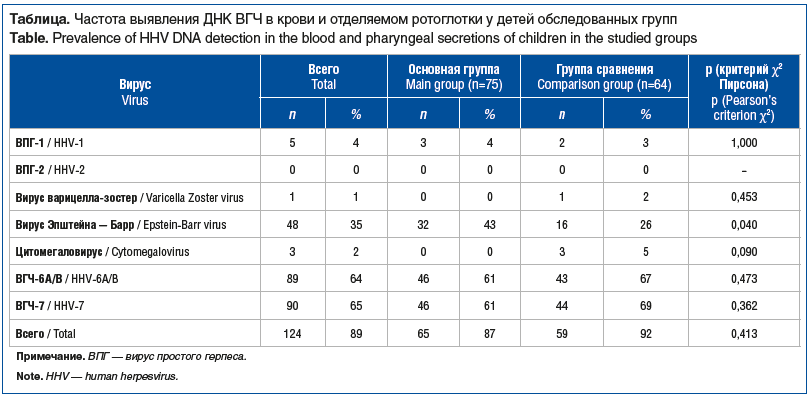
Наиболее часто ДНК ВГЧ-6 определяли у детей до 3 лет: в младшей возрастной группе — у 27 (82%) детей, в средней — у 36 (69%), в старшей — у 26 (48%) обследованных (р=0,004). При определении ДНК ВГЧ-7 выявлены тенденции к более частому выявлению у детей старше 7 лет: в младшей возрастной группе — у 16 (49%), в средней группе — у 35 (67%), в старшей — у 39 (72%) (р=0,071) (рис. 1).
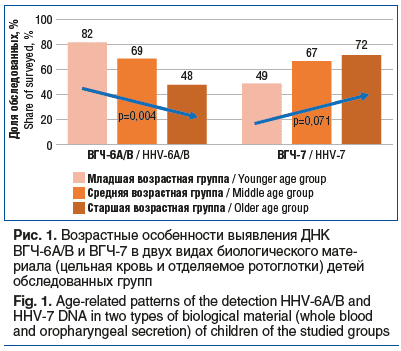
При определении ДНК ВГЧ-6A/B в крови маркеры вируса также чаще обнаружены в младшей возрастной группе — у 24 (75%), в средней возрастной группе выявлены у 29 (56%), в старшей группе — у 15 (28%) детей (р<0,001). В материале, полученном со слизистой оболочки ротоглотки, ДНК ВГЧ-6A/B чаще определяли в младшей группе — у 20 (61%), в средней и старшей возрастных группах — у 17 (33%) и 20 (37%) детей соответственно (р=0,029). В крови ДНК ВГЧ-7 выявлена у 15 (46%) детей в младшей группе, у 31 (60%) — в средней группе и у 27 (50%) детей в старшей группе (р=0,397). В отделяемом со слизистой оболочки ротоглотки маркеры ВГЧ-7 обнаружены с тенденцией к более частому выявлению у детей в старшей группе: в младшей группе у 14 (42%), в средней группе у 29 (56%), в старшей группе у 36 (67%) детей (р=0,084).
Медиана вирусной нагрузки ВГЧ-6A/B в крови составила 0,62 lg копий/105 клеток (Q1–Q3: 0,5–1,01 lg копий/105 клеток), в основной группе — 0,60 lg копий/105 клеток, в группе сравнения — 0,69 lg копий/105 клеток (р=0,156). В младшей возрастной группе медиана количества вирусной ДНК — 0,99 lg копий/105 клеток — была выше, чем в средней возрастной группе — 0,62 lg копий/105 клеток и старшей возрастной группе — 0,51 lg копий/105 клеток (р=0,031).
Среднее содержание ДНК ВГЧ-7 в том же виде биологического материала (цельная кровь) составило 1,05±0,65 lg копий/105 клеток, в основной группе медиана составила 0,97 lg копий/105 клеток, что было меньше медианы в группе сравнения — 1,03 lg копий/105 клеток (р=0,778). Наиболее высокая медиана количества вирусной ДНК была в младшей возрастной группе — 1,34 lg копий/105 клеток, в средней возрастной группе она составила 1,02 lg копий/105 клеток, в старшей возрастной группе — 0,78 lg копий/105 клеток (р=0,041).
На втором этапе исследования нами была выявлена ДНК хотя бы одного ВГЧ в исследованных средах у 38 (93%) детей. В основной группе у 27 (100%) детей обнаружена ДНК ВГЧ, тогда как в группе условно здоровых детей ДНК ВГЧ встречалась реже — у 11 (79%) детей (р=0,034) (рис. 2).
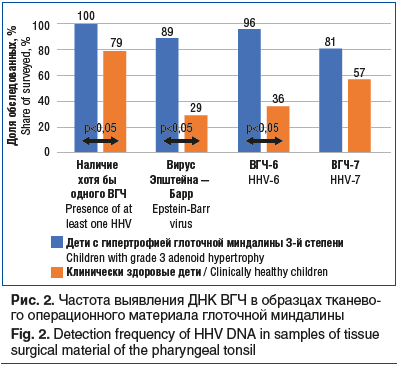
ДНК ВГЧ в основной группе обнаруживалась чаще, чем в группе сравнения: ДНК ВГЧ-6B у 26 (96%), ДНК ВГЧ-7 у 22 (81%). ДНК ВГЧ-6B выявлена в группе сравнения с меньшей частотой, чем в основной группе — у 5 (36%) детей (р<0,001), частота выявления ДНК ВГЧ-7 в группе сравнения статистически не отличалась от частоты выявления у детей с гипертрофией глоточной миндалины — 8 (57%) пациентов (р=0,140).
Обсуждение
Изучение клинического значения ВГЧ-6A/B и ВГЧ-7 представляет безусловный научный интерес в связи с тем, что маркеры данных инфекций достаточно часто встречаются среди взрослого и детского населения. Роль ВГЧ-6A/B в клинической практике изучена более детально, чем роль ВГЧ-7. Доказана схожесть генетического материала, строения, клинические проявления для ВГЧ-6A/B и ВГЧ-7, однако роль данных вирусов в развитии инфекционных заболеваний у детей до конца не изучена.
Ограничением исследований, посвященных изучению ВГЧ-7, часто является отсутствие группы сравнения. Так, в исследовании коллег из Ирака обследовано 180 детей с лихорадкой и кожной сыпью и 60 условно здоровых детей, однако для определения инфицирования ВГЧ-7 использовались непрямые методы диагностики — определение специфических анти-ВГЧ-7 IgG [26]. Исследования, в которых проводилось выделение ДНК ВГЧ-7, включали только пациентов с инфекционно-воспалительными заболеваниями ротоглотки [26, 28].
Нами обследованы не только условно здоровые дети с применением прямых методов этиологической диагностики, но и исследован материал мазков с глоточной миндалины пациентов без инфекционно-воспалительных заболеваний. Показано, что ВГЧ-6A/B и ВГЧ-7 являются наиболее часто выявляемыми ВГЧ у детей как условно здоровых, так и с острыми респираторными инфекциями, протекающими с поражением верхних дыхательных путей. Данные мировой литературы также говорят о высокой частоте регистрации лабораторных маркеров инфекции, вызванной этими вирусами [15, 26–28].
Что касается возрастных особенностей выявления исследуемых вирусов, то в мировой литературе имеются данные о высокой частоте обнаружения ДНК ВГЧ-6A/B у детей раннего и младшего возраста, а также уменьшении выявления вирусных маркеров с возрастом, что в полной мере соответствует результатам нашего исследования. Частота выявления ДНК ВГЧ-7, напротив, увеличивается по мере взросления детей [1, 3].
В мировой литературе имеются данные о высокой частоте обнаружения ДНК ВГЧ-6B и ВГЧ-7 в гипертрофированной ткани глоточной миндалины. Уровень регистрации ДНК ВГЧ-6B и ВГЧ-7 у детей с гипертрофией глоточной миндалины был выше по сравнению с детьми без гипертрофии глоточной миндалины и соответствовал данным мировой литературы [28]. Уникальность проведенного нами исследования состоит в исследовании материала мазков-отпечатков с глоточной миндалины пациентов без инфекционно-воспалительных заболеваний и получении сравнительных данных.
Высокой эффективностью при лечении инфекций, вызванных вирусами герпеса человека, обладает меглюмина акридонацетат, который является препаратом выбора при лечении инфекции, вызванной ВГЧ-6, у детей [29]. В ходе сравнительного рандомизированного исследования была продемонстрирована клиническая и лабораторная эффективность меглюмина акридонацетата (Циклоферон®) у детей с подтвержденной активной инфекцией ВГЧ-6 (как моноинфекцией, так и в сочетании с другими вирусами герпеса) в отличие от ацикловира [30]. При назначении меглюмина акридонацетата 68 детям с рецидивирующими инфекциями органов респираторного тракта, помимо клинического выздоровления, фиксировали уменьшение выделения респираторных бактериальных патогенов с поверхности небных миндалин [31]. Опубликованы данные метаанализа [32], подтверждающие эффективность меглюмина акридонацетата в отношении острых инфекций, вызванных респираторными вирусами и вирусами герпеса человека у пациентов разных возрастных групп. При клинико-лабораторном подтверждении активной инфекции, вызванной ВГЧ-6, необходимо рассмотреть применение препарата меглюмина акридонацетат в составе комплексной терапии у детей с гипертрофией глоточной миндалины.
Выводы
-
Наиболее часто выявляемой ДНК в крови и отделяемом со слизистой оболочки ротоглотки являлась ДНК ВГЧ-6A/B — в 64% случаев и ВГЧ-7 — в 65%. Частота выявления ДНК ВГЧ-6A/B и ВГЧ-7 в крови и отделяемом слизистой оболочки ротоглотки достоверно не отличалась у детей с тонзиллофарингитами в первые 2 сут от начала заболевания и условно здоровых.
-
При исследовании клеток цельной крови и отделяемого ротоглотки ДНК ВГЧ-6A/B чаще обнаруживали у девочек (45 (75%)), чем у мальчиков (44 (56%)), однако для ВГЧ-7 такой разницы не установлено.
-
ДНК ВГЧ-6A/B наиболее часто определяли у детей от 1 года до 3 лет 11 мес. — 27 (82%), тогда как ДНК ВГЧ-7 выявляли чаще у детей 7 лет — 39 (72%) случаев. Концентрация ДНК ВГЧ-6A/B и ВГЧ-7 в крови была выше в возрастной группе от 1 года до 3 лет 11 мес. (0,99 lg копий/105 клеток и 1,34 lg копий/105 клеток соответственно) и впоследствии снижалась с увеличением возраста до 0,51 lg копий/105 клеток и 0,78 lg копий/105 клеток соответственно (р<0,05).
-
При исследовании тканевого операционного материала, полученного из гипертрофированной глоточной миндалины у детей, ДНК ВГЧ встречалась чаще у пациентов с инфекционно-воспалительными заболеваниями — 27 (100%) случаев по сравнению с условно здоровыми — 11 (79%). ДНК ВГЧ-6B обнаруживалась в лимфоидной ткани гипертрофированной глоточной миндалины достоверно чаще по сравнению с детьми без гипертрофии — 26 (96%) и 5 (36%) соответственно. Данный вирус может являться этиологически значимым фактором, поддерживающим инфекционно-воспалительный процесс в тканях глоточной миндалины, в отличие от ВГЧ-7, который с большей вероятностью является частью вирома человека и встречается с одинаковой частотой в глоточной миндалине условно здоровых детей и у детей с гипертрофией аденоидов 3-й степени.
-
При выявлении инфекции, вызванной ВГЧ-6A/B, у детей с инфекционно-воспалительной патологией аденотонзиллярной зоны мы считаем необходимым подключение противовирусной терапии.
Сведения об авторах:
Власов Петр Владимирович — аспирант ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0009-0009-3947-4813
Сабинина Татьяна Сергеевна — младший научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0001-9896-1798
Музыка Анна Драгиевна — к.м.н., старший научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0002-2269-2533
Солдатова Евгения Юрьевна — к.м.н., младший научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А.
Домонова Эльвира Алексеевна — к.б.н., руководитель научной группы разработки новых методов диагностики оппортунистических и папилломавирусных инфекций отдела молекулярной диагностики и эпидемиологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0001-8262-3938
Сильвейстрова Ольга Юрьевна — научный сотрудник научной группы разработки новых методов диагностики оппортунистических и папилломавирусных инфекций отдела молекулярной диагностики и эпидемиологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0001-8412-9765
Мелехина Елена Валериевна — д.м.н., доцент по специальности «педиатрия», ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0002-9238-9302
Контактная информация: Власов Петр Владимирович, e-mail: vlsvpetr@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.08.2024.
Поступила после рецензирования 03.09.2024.
Принята в печать 26.09.2024.
About the authors:
Pyotr V. Vlasov — postgraduate student of the Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0009-0009-3947-4813
Tatyana S. Sabinina — Junior Researcher at the Clinical Department of Infectious Pathology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0001-9896-1798
Anna D. Muzyka — C. Sc. (Med.), Senior Researcher at the Clinical Department of Infectious Pathology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0002-2269-2533
Evgeniya Yu. Soldatova — C. Sc. (Med.), Junior Researcher of the Clinical Department of Infectious Pathology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation.
Elvira A. Domonova — C. Sc. (Bio.), Head of the Scientific Group for the Development of New Diagnostic Methods for Opportunistic and Papillomavirus Infections of the Department of Molecular Diagnostics and Epidemiology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0001-8262-3938
Olga Yu. Silveistrova — Researcher of the Scientific Group for the Development of New Diagnostic Methods for Opportunistic and Papillomavirus Infections of the Department of Molecular Diagnostics and Epidemiology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3А, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0001-8412-9765
Elena V. Melekhina — Dr. Sc. (Med.), Associate Professor in Pediatrics, Leading Researcher of the Clinical Department of Infectious Pathology, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being; 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0002-9238-9302
Contact information: Pyotr V. Vlasov, e-mail: vlsvpetr@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.08.2024.
Revised 03.09.2024.
Accepted 26.09.2024.
1Current ICTV Taxonomy Release. (Electronic resource.) URL: ictv.global/taxonomy (access date: 12.09.2024).
Информация с rmj.ru


