Введение
Комплекс метаболических нарушений, выявляющихся при сахарном диабете (СД), приводит к нарушению функций многих органов и систем [1], в том числе реологических свойств крови [2]. Реологические свойства крови (вязкость крови, способность эритроцитов к агрегации и деформации) во многом определяют кровоток по микрососудам [3]. Нарушение реологических свойств крови приводит к снижению капиллярного кровотока, к ишемии и гипоксии органов и тканей [4, 5]. В настоящее время СД рассматривается в парадигме сосудистой патологии [6]. В частности, в развитых странах СД — это ведущая причина развития терминальной почечной недостаточности в исходе диабетической нефропатии (ДН) [7]. ДН развивается у 48% больных СД 1 типа (СД1) при длительности заболевания более 30 лет [7].
Поиск предикторов развития осложнений СД является важной задачей для улучшения контроля заболевания в перспективе.
Цель исследования: изучение взаимосвязи и прогностической значимости нарушений реологических свойств крови при СД1 со снижением скорости клубочковой фильтрации (СКФ) при развитии ДН.
Содержание статьи
Материал и методы
Исследование было одобрено локальным этическим комитетом ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (протокол № 12 от 31 августа 2023 г.). Все участники подписали информированное согласие на участие в исследовании.
Всего было включено 52 больных СД1, из них 30 (57,7%) женщин, 22 (42,3%) мужчины, средний возраст 33±11 лет. Исследование выполняли на образцах венозной крови, взятой натощак. Образцы стабилизировали с EDTA (0,002 г/мл). Гематокрит приводился к стандартному (40%). Оценивали морфологию эритроцитов при помощи оптического микроскопа. Измерения проводили при температуре 25 °С.
При помощи капиллярного вискозиметра (диаметр капилляра 0,8 мм, длина — 118 мм) исследовали вязкость плазмы крови, которая определялась по формуле:
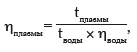
где t — время истечения плазмы крови, а ηводы — вязкость воды, равная 0,9 мПа×с (при 25 °С).
Исследование агрегации и деформации эритроцитов проводили при помощи коакциально-цилиндрического агрегометра-деформометра LADE (ReoMedLab, Россия) [8]. Оценка агрегации эритроцитов на приборе реализуется при помощи метода регистрации обратного светорассеяния от образца цельной крови. При оценке способности эритроцитов к деформации используется метод эктацитометрии [9].
Изученные параметры реологических свойств крови представлены в таблице 1.
Расчет СКФ выполняли на основании показателя креатинина по формуле CKD-EPI. Диагностика хронической болезни почек (ХБП) и установление степени альбуминурии проводились согласно общепринятой классификации [1].
Оценивали нарушения гемореологических свойств в зависимости от CКФ (выше или ниже 90 мл/мин/1,73 м2), а также в зависимости от уровня альбуминурии (при нарастании выше 100, 150, 300 мл/сут).
При статистической обработке данных использовали пакет IBM SPSS Statistics 26. Показатели в группах сравнивали при помощи критерия Манна — Уитни. Для представления данных использовали медиану и 1-й и 3-й квартили (Ме [Q1, Q3]). Выполняли ковариационный анализ для выявления взаимосвязей между переменными. Поиск математических прогностических признаков проводили с использованием регрессионного анализа. Была выбрана линейная регрессия для числовых рядов данных. Для характеристики связи использовали коэффициент ρ, принимавший значения от 0 до 1. Уровень значимости переменных принимался за значимый при p<0,05.
Результаты исследования
Показатели гликированного гемоглобина (HbA1c), общего холестерина (ОХ), альбумина, глюкозы, фибриногена у пациентов с СД1 приведены в таблице 2.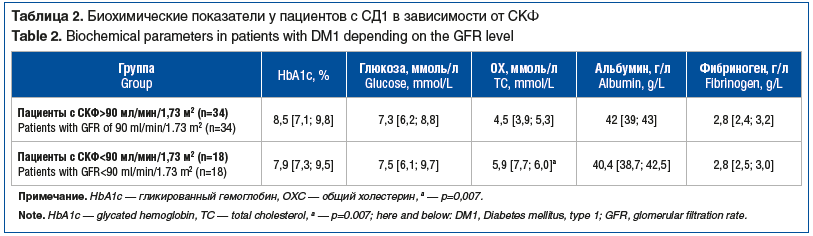
При оценке гемореологических параметров выявлено, что по мере снижения СКФ усиливалась гиперагрегация эритроцитов. При СКФ90 мл/мин/1,73 м2 (табл. 3). По результатам многофакторного анализа, гиперагрегация эритроцитов зависела от повышения ОХ у пациентов в группе с СКФ
При увеличении суточной альбуминурии свыше 100 мг повышалась I2,5 (р=0,02), которая продолжала увеличиваться при нарастании альбуминурии более 150 мг/сут (р=0,02), схожая тенденция наблюдалась при альбумин-урии более 300 мг/сут (р=0,067). Также при нарастании альбуминурии свыше 150 мг/сут ухудшалась деформируемость эритроцитов (повышалось (.)begun, р=0,01), которая продолжала ухудшаться при нарастании альбуминурии более 300 мг/сут (р=0,04) (табл. 4).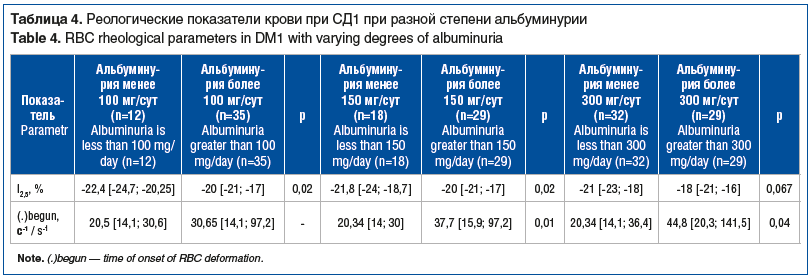
При вторичном анализе данных, проведенном с целью выявления реологических показателей — предикторов развития ХБП, выявлена предикция средней силы показателей агрегации эритроцитов на снижение СКФ. Индекс корреляции R между Т1 и СКФ составил 0,38, kTb и СКФ — 0,38, I2,5 и СКФ — 0,42 (p=0,005, 0,006 и 0,002 соответственно).
Также по результатам регрессионного анализа показано (табл. 5):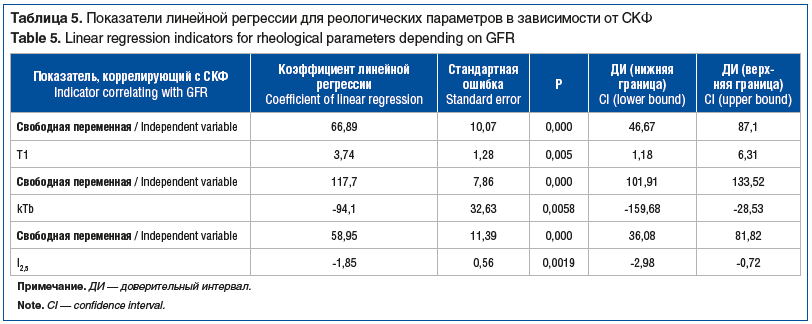
снижение T1 на 1 с-1 в среднем ассоциировано со снижением СКФ на 3,7 мл/мин/1,73 м2;
возрастание kTb на 0,1 с-1 также приводит к снижению СКФ на 9,4 мл/мин/1,73 м2;
возрастание I2,5 на 1 с-1 также приводит к снижению СКФ на 1,85 мл/мин/1,73 м2.
Обсуждение
При СД1 гиперагрегация эритроцитов усугублялась по мере снижения СКФ. Ускоренное образование агрегатов наблюдалось уже при СКФ
Также при нарастании альбуминурии более 100 мг/сут наблюдалось повышение прочности эритроцитарных агрегатов, при дальнейшем увеличении альбуминурии более 150 мг/сут происходило снижение деформации эритроцитов.
При оценке предикторной способности гемореологических нарушений выявлена математическая предикция средней силы гиперагрегации эритроцитов на снижение СКФ. Выявлено, что T1 на 1 с-1 эритроцитов ассоциировано со снижением СКФ на 3,74 мл/мин/1,73 м2. Повышение I2,5 на 1 с-1 ассоциировано со снижением СКФ на 1,85 мл/мин/1,73 м2.
Такие влияния гиперагрегации эритроцитов на функцию почек можно объяснить тем, что эритроцитарные агрегаты повышенной прочности приводят к закупорке отдельных капилляров и снижают кровоток в микрососудистом русле органов и тканей [11]. Нарушение кровоснабжения почки способствует снижению СКФ и развитию ХБП [12]. В работе О.А. Георгиновой [13] показано опережающее значение I2,5 и размера эритроцитарных агрегатов по отношению к прогрессии волчаночного нефрита. Таким образом, нарушения реологических свойств крови у больных СД1 может способствовать снижению почечного кровотока и снижению СКФ, что объясняет выявленные взаимосвязи.
Исследование агрегации эритроцитов (скорости и времени начальных фаз агрегации эритроцитов, прочности наиболее крупных агрегатов) способствует выявлению риска раннего снижения СКФ (<90 мл/мин/1,73 м2) при развитии ДН при СД1.
Заключение
У пациентов с СД1 обнаружена взаимосвязь между нарушением реологических свойств крови и снижением почечной функции; гиперагрегация эритроцитов прямо коррелирует со снижением СКФ. При СД1 увеличение альбуминурии более 100 мг/сут ассоциировано с гипер-агрегацией эритроцитов, при повышении альбуминурии более 150 мг/сут наблюдается снижение способности эритроцитов к деформации. Таким образом, нарушение реологических свойств крови при СД1 наблюдается уже на ранних стадиях развития ДН (ХБП 2–3а степени). Увеличение гиперагрегации эритроцитов является предиктором снижения СКФ
СВЕДЕНИЯ ОБ АВТОРАХ:
Фабричнова Анастасия Анатольевна — ассистент кафедры терапии факультета фундаментальной медицины МГУ имени М.В. Ломоносова; 119991, Россия, г. Москва, Ленинские горы, д. 1; ORCID iD 0000-0003-4922-0007
Мисникова Инна Владимировна — д.м.н., ведущий научный сотрудник отделения терапевтической эндокри-
нологии, профессор кафедры эндокринологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0003-1668-8711
Ковалева Юлия Александровна — к.м.н., старший научный сотрудник отделения терапевтической эндокринологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0001-7327-2486
Глазков Алексей Андреевич — к.м.н., старший научный сотрудник лаборатории медико-физических исследований ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0001-6122-0638
Кошелев Владимир Борисович — д.б.н., профессор, заведующий кафедрой физиологии и общей патологии факультета фундаментальной медицины МГУ имени М.В. Ломоносова; 119991, Россия, г. Москва, Ленинские горы, д. 1; ORCID iD 0000-0003-0354-5607
Контактная информация: Анастасия Анатольевна Фабричнова, e-mail: anastasia.fabrichnova@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 30.07.2024.
Поступила после рецензирования 22.08.2024.
Принята в печать 16.09.2024.
ABOUT THE AUTHORS:
Anastasia A. Fabrichnova — Assistant Professor of the Department of Therapy, Faculty of Fundamental Medicine, Lomonosov Moscow State University; 1, Leninskie Gory, Moscow, 119991, Russian Federation; ORCID iD 0000-0003-4922-0007
Inna V. Misnikova — Dr. Sc. (Med.), Leading Researcher at the Department of Therapeutic Endocrinology, Professor of the Department of Endocrinology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0003-1668-8711
Yulia A. Kovaleva — C. Sc. (Med.), Senior Researcher at the Department of Therapeutic Endocrinology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0001-7327-2486
Alexey A. Glazkov — C. Sc. (Med.), Senior Researcher at the Laboratory of Medical and Physical Research, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0001-6122-0638
Vladimir B. Koshelev — Dr. Sc. (Bio.), Professor, Head of the Department of Physiology and General Pathology, Faculty of Fundamental Medicine, Lomonosov Moscow State University; 1, Leninskie Gory, Moscow, 119991, Russian Federation; ORCID iD 0000-0003-0354-5607
Contact information: Anastasia A. Fabrichnova, e-mail: anastasia.fabrichnova@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 30.07.2024.
Revised 22.08.2024.
Accepted 16.09.2024.
Информация с rmj.ru





