Введение
Одним из самых распространенных дерматозов детского возраста является атопический дерматит (АтД), частота которого в детской популяции экономически развитых стран колеблется от 5 до 30,8% [1]. Основываясь на современном понимании парадигмы и мнении экспертов, АтД рассматривают как хроническое рецидивирующее воспаление кожи, возникающее вследствие нарушения эпидермального барьера, влекущее дальнейшую его дисфункцию, достигающую максимального развития на фоне предрасположенности к IgE-опосредованной гиперчувствительности, реализуемой в сенсибилизацию к окружающим аллергенам [2]. Более чем у трети пациентов дерматоз, возникший в младенчестве, имеет среднетяжелое и тяжелое течение, диффузный характер, как правило, торпидное к терапии течение и кратковременные ремиссии [3]. Тяжесть течения заболевания в большинстве случаев снижает качество жизни, приводя к эмоционально-физическим страданиям, когнитивно-эмоциональному дисбалансу и значимым финансовым затратам семьи и государства [4, 5]. Существующие в настоящее время методики лечения и попытки профилактики, основанные на характерных особенностях эволюции заболевания, в лучшем случае способны обеспечить контроль симптомов, но не гарантировать выздоровление. Выбор терапевтического подхода весьма проблематичен по причине множества фенотипов, обусловленных разнообразием цитокиновых профилей АтД [6–8]. Недостаточно изученные механизмы атопического марша (АМ) открывают перспективы дальнейших исследований в области прогнозирования, разработки стратегий первичной и вторичной профилактики, новых методик лечения.
В 2006 г. на кафедре поликлинической педиатрии и пропедевтики детских болезней ФГБОУ ВО КемГМУ Минздрава России был инициирован процесс по разработке и реализации программы «Первичная профилактика атопии». Ретроспективный анализ дебюта АМ у пациентов с бронхиальной астмой (БА) (n=375) и АтД (n=1218) в начале исследования выявил наличие колитического синдрома, проявляющегося на 3–4-й неделе жизни выраженными кишечными коликами, наличием патологических примесей в кале, нарушением моторной функции. Детальная оценка бактериальных высевов кала детей на средах Baird Parker Agar и Congo Red Agar (CRA) выявила наличие представителей семейств Micrococcaceae (Staphylococcus aureus) и Enterobacteriaceae (Klebsiella pneumoniae и Klebsiella oxytoca) соответственно и их сочетание со значительным превышением референсного диапазона во всех случаях.
В настоящее время имеется достаточно исследований, демонстрирующих связь увеличения числа некоторых представителей условно-патогенной микрофлоры (УПМ) с развитием АтД и атопических заболеваний (АЗ) в целом [9, 10]. В процессе нашей исследовательской работы изначально имело место предположение, которое впоследствии оформилось в твердое убеждение, что сверхустойчивые и агрессивные штаммы бактерий, ассоциированные с оказанием медицинской помощи (Healthcare-associated infections), вызывают нарушение процесса коаггрегации нормофлоры на биопленках (biofilm) кишечника, снижая общее число бифидобактерий и приводя к аутосенсибилизации и развитию IgE-опосредованной аллергии, т. е. являются основным фактором инициации АМ [11]. Микробиота кишечника ребенка первых недель жизни с наследственной предрасположенностью к атопии — это генетически детерминированная, эволюционирующая микроэкосистема облигатной, факультативной и транзиторной микрофлоры, требующая очень деликатных методов воздействия [12, 13]. Назревший на тот момент вопрос о путях воздействия на чрезмерный рост S. aureus, K. pneumoniae и K. oxytoca побудил наш коллектив исследователей в рамках проводимой программы коллегиально принять решение в пользу применения селективной фаговой деконтаминации (СФД).
В настоящее время активно ведутся исследования, посвященные бактериофагам как одному из ключевых факторов иммунного гомеостаза. По мере накопления опыта практического применения фагов растет вероятность появления в ближайшее время инструментов, влияющих на аллерген-индуцированную иммунопатологию [14]. В частности, имеется опыт достаточно эффективного наружного использования бактериофагов при АтД [15]. К сожалению, отсутствует опыт клинического применения энтерального употребления бактериофагов не только в форме монотерапии, но и в качестве дополнения к традиционной терапии в контексте АтД.
Представляя собой высокотехнологичный биологический объект биосферы размером 100 нм, бактериофаг способен направленно проникать внутрь бактериальной клетки, размножаться там, вызывать ее разрушение, имея при этом в своей структуре комплекс белков для совместной репликации, абсолютно исключая возможность воздействия на другие клетки biofilm и собственные клетки организма. Помимо избирательного литического действия на клетку, фаги кодируют широкий спектр высокоспеци-фичных ферментов, разрушающих экзополисахариды матрикса biofilm, что позволяет в значительной степени влиять на корректную структурную организацию кишечного биотопа [16].
Усиление фаготерапией традиционного подхода к лечению АтД приводило к быстрому клиническому эффекту, стойкой катамнестической ремиссии и в итоге остановке АМ. Дополнение базового лечения АтД фаготерапией позволило за 15 лет снизить заболеваемость контингента детей, включенного в исследование: БА с 9,7 до 3,6% и АтД с 7,7 до 1,1% без трансформации в БА. В 1,1% вошли дети, родители которых по той или иной причине отказались от лечения бактериофагами [17].
Цель исследования: определить эффективность СФД от чрезмерного роста S. aureus, K. pneumoniae и K. oxytoca как основного пускового механизма формирования АтД.
Материал и методы
Проведено когортное проспективное и ретроспективное исследование, в рамках которого было сформировано две группы.
Первую, проспективную, группу составили 47 детей, из них 22 мальчика, обратившихся в клинику аллергологии и иммунологии с диагнозом АтД в период 2019–2021 гг. Средний возраст дебютного обращения составил 4,57±0,71 нед. (1–3 мес.). Всем малышам проведена детальная индивидуальная клинико-лабораторная оценка состояния здоровья. По итогам бактериологического исследования кала у всех в высевах выявлено наличие S. aureus, K. pneumoniae и К. oxytoca, значительно превышающее референсные показатели, после чего в соответствии с протоколом выполнена СФД, проведено катамнестическое наблюдение на протяжении двух лет.
Для ретроспективного анализа была сформирована 2-я группа из 38 детей, из них 21 мальчик, с диагнозом АтД, наблюдавшихся и получивших лечение в условиях детской поликлинической сети, которым на момент первичного обращения в соответствии с протоколом обследования пациентов с АтД было проведено бактериологическое исследование кала, но не проводилась СФД S. aureus, K. pneumoniae и К. oxytoca. При дебютном обращении в клинику аллергологии и иммунологии возраст пациентов составил 13,92±3,44 мес. (1–1,5 года). Все дети 2-й группы имели постоянное место проживания в других регионах страны, медицинская помощь по профилю «аллергология-иммунология» оказывалась в соответствии с федеральным проектом «Экспорт медицинских услуг» [18].
По результатам проведенного бактериологического исследования кала культурально-зависимым способом всем малышам 1-й группы были проведены три 16-дневных курса фаготерапии бактериофагом стафилококковым (Bacteriophagum Staphylococcum) в дозе 3 мл per os 2 р/сут и 3 мл per rectum перед сном в течение 8 дней. Затем бактериофагом клебсиелл поливалентным очищенным (Klebsiella polyvalent bacteriophage purified) в случае ассоциации с K. pneumoniae и пиобактериофагом поливалентным очищенным (Piobacteriophage polyvalent purified) в случае ассоциации с K. oxytoca в дозе 3 мл per os 2 р/сут и 3 мл per rectum перед сном в течение 8 дней с 14-дневным перерывом.
Исследование проводилось на основании решения комитета по этике и доказательности медицинских научных исследований ФГБОУ ВО КемГМУ Минздрава России и информированного согласия законного представителя ребенка.
Данные групп исследования указывались в абсолютных значениях и процентных долях. Статистическая обработка вариационных рядов данных проводилась путем расчета средних арифметических величин (M) и средних ошибок средних арифметических (m). Для оценки значимости различий в нормально распределенных совокупностях рассчитывался t-критерий Стьюдента. Статистически значимыми различия показателей считали при p<0,05.
Результаты и обсуждение
Индивидуальная клинико-лабораторная оценка состояния здоровья детей выявила следующие закономерности. Все дети имели наследственную предрасположенность к атопии преимущественно по материнской линии (у 70,2 и 88,8% детей 1-й и 2-й групп соответственно). Значения относительного показателя (ОП) эозинофилов (EOS) гемограммы периферической крови при скрининговом исследовании в 1-е сутки жизни составили 4,68±1,69 и 5,07±1,93% в 1-й и 2-й группах соответственно (р=0,850). Многолетний успешный опыт лечения и профилактики детей с АЗ дает нам возможность расценивать значение ОП EOS гемограммы ребенка при скрининговом исследования в 1-е сутки 2% и более как биомаркер атопии [19].
Приоритетным пусковым механизмом дебюта атопии, по нашему мнению, является генерация дисбаланса симбионтной микрофлоры за счет активной пролиферации УПМ, представленной госпитальными штаммами S. aureus, K. pneumoniae и K. oxytoca [20]. Воздействие на химус патологической микробиоты приводит к колитическим проявлениям у детей первых недель жизни — метеоризму, кишечным коликам, увеличению интервала между дефекациями, появлению патологических примесей в виде слизи, зелени, крови. У всех малышей, включенных в исследование, дебютным клиническим проявлением атопии были кишечные колики, сопровождающиеся наличием в стуле слизи и зелени у 85,1% и крови у 25,5% детей в 1-й группе, у 63,1 и 10,5% детей во 2-й группе соответственно.
Колитический синдром в 1-й группе дебютировал в 3,74±0,74 нед., во 2-й группе — в 3,23±0,54 нед. (p>0,05). Явления проктоколита у всех курируемых малышей предшествовали дебютным проявлениям дерматоза. Так, в 1-й группе поражения кожи фиксировались в возрасте 4,55±0,74 нед., во 2-й группе — 4,28±0,56 нед. (p>0,05).
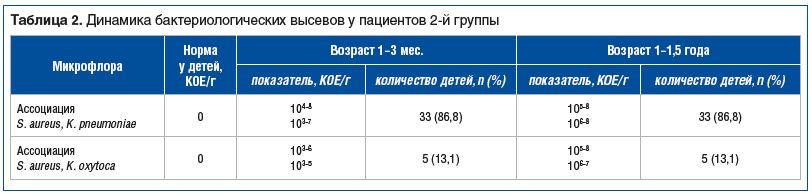
Наличие симптомов проктоколита явилось абсолютным показанием к проведению бактериологического исследования кала на УПМ (табл. 1, 2) [21, 22].
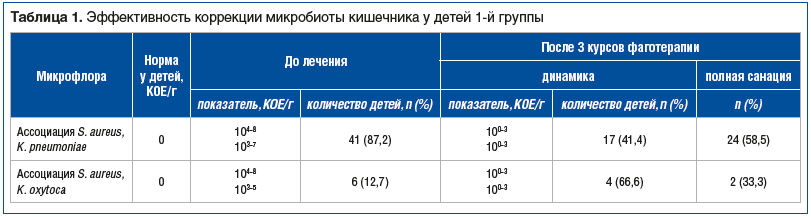
Оценка результатов микробиологических исследований кала позволила выявить наличие ассоциаций S. aureus с K. pneumoniae и K. oxytoca у всех детей исследуемых групп. Показатели титров S. aureus у детей 1-й группы составили 6,59±0,90 lg КОЕ/г, K. pneumoniae — 5,48±0,85 lg КОЕ/г, K. oxytoca — lg 5,00±1,78 lg КОЕ/г, во 2-й группе — 5,20±1,30, 5,21±0,90 и 5,75±1,26 lg КОЕ/г соответственно и статистически значимо между группами не различались (p>0,05).
С 2006 г. в повседневной практической работе в ходе лечения пациентов первых недель жизни с АтД при разнообразных формах проявления дерматоза, наряду с лекарственными препаратами, рекомендованными Федеральными клиническими рекомендациями по лечению АтД у детей (блокаторы H1-гистаминовых рецепторов, энтеросорбенты, стабилизаторы мембран тучных клеток, топические глюкокортикостероиды, эмоленты), специалисты нашей клиники начали активно использовать бактериофаги [23]. Многолетняя практика применения в комплексном лечении детей с АЗ бактериофагов демонстрирует достоверно ощутимый клинический эффект. В связи с этим возникшая идея монотерапии фагами была реализована на группе детей в дебюте АтД (1-я группа). Коррекцию избыточного роста S. aureus, K. pneumoniae и K. oxytoca путем СФД всем малышам, включенным в 1-ю группу, провели в форме монотерапии. По нашему мнению, при любом воздействии на микробиоту кишечника ребенка, особенно первых недель жизни, чрезвычайно важно учитывать индивидуальные генетические особенности микроэкосистемы. Любые методы воздействия на формирующийся микросимбиоз кишечника должны быть максимально корректными и обоснованными. Активный практический опыт применения бактериофагов для моделирования микросимбиоза у детей первых недель жизни не выявил негативных реакций как в процессе применения, так и в долгосрочной перспективе. Бережное воздействие фаговой частицы на biofilm является в настоящее время весьма оправданным и пока безальтернативным в контексте терапии АЗ [24].
Промежуточным клинически значимым результатом уже первого курса явилось отсутствие колитического синдрома у всех малышей. Кожный синдром был купирован у 36 (76,5%) детей после первого курса, у 11 (23,4%) — после второго. По нашим наблюдениям, минимальный оптимальный курс фаготерапии составляет 48 дней с перерывом между курсами 28 дней. Возможность проведения более длительных курсов имеет место, но для достижения адекватного проспективного клинического эффекта, по нашему мнению, достаточно трех курсов. После проведенной СФД S. aureus, K. pneumoniae и K. oxytoca всем детям 1-й группы в возрасте от 5,5 до 6,5 мес. был введен прикорм в соответствии с «Национальной программой оптимизации вскармливания детей первого года жизни в Российской Федерации» (2019). В процессе введения прикорма ни у кого из малышей не возникло каких-либо проявлений аллергии. В катамнезе до настоящего времени дети 1-й группы полностью социализированы и в дальнейшем до достижения 7-летнего возраста будут находиться на диспансерном наблюдении врача аллерголога-иммунолога.
В результате проведенной СФД удалось достичь существенного улучшения клинической симптоматики в виде уменьшения интенсивности и полного исчезновения кишечных колик уже на 2–3-й день применения. Сокращение патологических включений в стуле и нормализация кратности дефекации наблюдались в среднем уже через 3,82±0,63 дня, объективная динамика кожного синдрома имела место через 5,29±0,85 дня фаготерапии.
Контрольные бактериальные высевы у детей 1-й группы показали существенную динамику снижения титров S. aureus, K. pneumoniae и K. oxytoca. Однако отсутствие полной деконтаминации S. aureus и K. pneumoniae у 41,4% детей (n=17) и S. aureus и K. oxytoca у 33,3% (n=2) — свидетельство медленного in vivo литического эффекта фагов (см. табл. 1).
Анализ динамики результатов бактериологического исследования кала на патогенную и условно-патогенную микрофлору у детей 2-й группы выявил неблагоприятную динамику пролиферации S. aureus, K. pneumoniae и K. oxytoca, выражавшуюся в увеличении титров указанных микроорганизмов (см. табл. 2).
Одним из объективных оценочных индексов степени тяжести АтД является индекс SCORAD. На момент дебютного обращения пациентов 1-й группы индекс SCORAD варьировал в пределах от 10,4 до 21,5 балла и составлял в среднем 15,5±2,4 балла, по истечении первого курса составил 0 баллов у 36 (76,5%) детей, после второго курса — у 11 (23,4%).
Анализ динамики АМ у детей 2-й группы выявил следующие закономерности. В процессе проводимой терапии, направленной на лечение АтД в условиях городских детских поликлиник, отмечались лишь временные, преимущественно сезонные (в летние месяцы или на отдыхе в субтропических странах) улучшения. Индекс SCORAD во 2-й группе имел неуклонную тенденцию к увеличению. При дебютном обращении в детские поликлиники городов проживания индекс SCORAD варьировал от 11,4 до 21,5 балла, составив в среднем 15,7±2,4 балла. В период обращения в клинику аллергологии и иммунологии средний возраст пациентов 2-й группы составил 13,92±3,44 мес. и индекс SCORAD определялся в интервале от 27,9 до 58,9 балла, в среднем составляя 43,73±7,09 балла, что свидетельствовало о ежегодном возрастном расширении спектра сенсибилизации.
Заключение
Проблема неуправляемой пандемии АЗ, отсутствие общей концепции лечения и профилактики заставляют нас обратить пристальное внимание на способы лечения, предоставленные нам самой природой, неотъемлемой частью которой являются бактериофаги. Фаготерапия, проведенная в первые недели жизни детям с наследственной предрасположенностью к атопии, позволяет приостановить процесс формирования атопического фенотипа за счет максимально корректной СФД S. aureus, K. pneumoniae и K. oxytoca как основных представителей УПМ, способных индуцировать процесс атопии. Активное персонализированное применение бактериофагов в лечении детей с АтД в настоящее время является абсолютно оправданным в связи с быстрым наступлением клинического эффекта и отсутствием побочных реакций.
Информация с rmj.ru
