Содержание статьи
Введение
Ингибиторы контрольных точек представляют собой новый класс иммуноонкологических препаратов. Обнаружение роли гиперэкспрессии молекул иммунных контрольных точек в микроокружении опухоли, позволяющих ей уклоняться от противоопухолевого иммунитета, кардинальным образом изменило подход к лечению многих распространенных форм рака [1]. Ввиду того, что ингибиторы контрольных точек активируют Т-лимфоциты в различных тканях, применение данной группы препаратов зачастую сопряжено с активацией аутоиммунных процессов и развитием так называемых иммуноопосредованных нежелательных явлений (иНЯ). Аутоиммунное воспаление может возникать в различных органах-мишенях: коже, желудочно-кишечном тракте, печени, почках, гипофизе, щитовидной железе и других эндокринных железах, легких, органе зрения, нервной системе. Распространенность иНЯ, в том числе со стороны эндокринной системы, довольно высока и может достигать 15–30%, что демонстрируют данные, полученные в систематических обзорах литературы и метаанализах [2–4]. Наиболее частыми иНЯ со стороны эндокринной системы являются заболевания щитовидной железы: на фоне терапии препаратами анти-PD1/анти-PDL1 их распространенность достигает 17%, на фоне терапии анти-CTLA-4 возникновение гипофизитов отмечается в 4–17% случаев. Комбинированная терапия (анти-PD1/анти-PDL1 и анти-CTLA-4) ассоциирована с более высокой распространенностью эндокринных иНЯ в целом [2, 3]. Однако полученные данные обладают ограниченной информативностью, что связано в первую очередь с ошибками при классификации иНЯ. Так, тиреотоксическая фаза деструктивного тиреоидита нередко классифицируется как гипертиреоз и ассоциируется с болезнью Грейвса [5].
Учитывая постоянно расширяющиеся показания к использованию ингибиторов контрольных точек, можно ожидать, что их применение будет увеличиваться в последующие годы. Так, в настоящее время имеются данные, указывающие на то, что применение препаратов этой группы может быть эффективным при лечении таких заболеваний, как ВИЧ, вирусный гепатит В, вирусный гепатит С [6, 7]. В связи с этим вопрос о своевременной диагностике и лечении иНЯ становится актуальным для врачей многих специальностей.
В статье мы рассмотрим основные клинические характеристики эндокринных иНЯ, их патофизиологические механизмы и подходы к лечению данных состояний.
Механизм действия ингибиторов контрольных точек
Более глубокое понимание роли иммунной системы и появление новых методов иммуномодуляции открыли новую эру в терапии рака. Белки иммунных контрольных точек обеспечивают предотвращение действия иммунной системы против клеток собственного организма и быстрое прекращение иммунного ответа. Однако в случае злокачественных заболеваний клетки опухоли имеют ряд механизмов, позволяющих «ускользать» от ответа иммунной системы, в том числе посредством активации контрольных точек [8–10].
Молекулы иммунных контрольных точек, такие как протеин-4, ассоциированный с цитотоксическими Т-лимфоцитами (CTLA-4), рецептор программированной смерти (PD1) и его лиганд (PDL1), относятся к одному из подвидов тормозных путей иммунной системы и играют важную роль в регуляции иммунного ответа. Для активации Т-клеток требуются два сигнала: распознавание антигена Т-клеточным рецептором и костимуляция самого процесса активации. Первый сигнал реализуется посредством молекул главного комплекса гистосовместимости антигенпредставляющих клеток.
В неактивированных Т-лимфоцитах белок CTLA-4 находится внутри клетки и транслоцируется на мембранную поверхность вскоре после ее активации [11]. При инициации иммунного ответа CD28 — мембранный белок, экспрессируемый на поверхности Т-лимфоцитов и участвующий в их активации, связывается с костимулирующим лигандом В7 на антигенпрезентирующих клетках, тем самым инициируя второй сигнал, активирующий созревание Т-лимфоцитов. CTLA-4 связывается с В7 и конкурирует с CD28 с последующим ингибированием активации Т-лимфоцитов [12]. Этот механизм предотвращает второй сигнал, который поддерживает активацию Т-клеток и тормозит их участие в процессе иммунного ответа [13]. Ингибиторы CTLA-4 (такие как ипилимумаб) продемонстрировали высокую эффективность в лечении онкологических заболеваний [10–12, 14–16]. Ингибиторы CTLA-4 через каскад клеточных реакций способствуют активации Т-лимфоцитов и индуцируют экспрессию ИЛ-2 и рецептора ИЛ-2, что приводит к опосредованному росту и созреванию Т-клеток [17]. Таким образом, блокирование CTLA-4 приводит к пролиферации и активации Т-клеток и реализации противоопухолевого клеточного иммунитета [18].
Рецептор программируемой смерти клеток PD1 представляет собой специфический поверхностный рецептор, который экспрессируется на В- и Т-лимфоцитах и естественных киллерах [19, 20]. Основным действием PD1, по-видимому, является поддержание периферической толерантности к собственным клеткам организма. Также доказана его роль в поддержании противоопухолевого, инфекционного, аллергенного иммунитета [21].
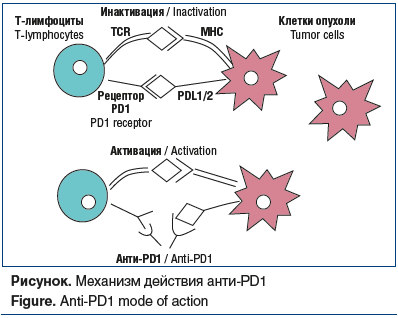
Лиганды PD1 (PDL1 и PDL2) обнаружены на покоящихся В- и Т-клетках, макрофагах и дендритных клетках, а также на клетках злокачественных новообразований [22, 23]. Связывание PD1 со своим лигандом ингибирует пролиферацию активированных Т-клеток [24]. Анти-PD1 моноклональные антитела могут блокировать этот путь и приводить к усилению противоопухолевого иммунного ответа (см. рисунок) [25]. Анти-PD1 блокируют связывание рецептора PD1 лимфоцитов и моноцитов с лигандами PDL1 и PDL2, таким образом активируя противоопухолевый иммунный ответ.
Ингибирование контрольных точек влечет за собой активацию иммуноопосредованной противоопухолевой активности, что было продемонстрировано в ряде клинических исследований [26]. Таким образом, анти-CTLA-4 и анти-PD1 имеют разные механизмы действия, что позволяет использовать их в составе комбинированной терапии [3]. Однако терапия ингибиторами контрольных точек сопряжена с высоким риском развития иНЯ, в том числе со стороны эндокринной системы.
Патогенез, распространенность и клинические проявления эндокринных иНЯ
В сравнении с другими иНЯ, эндокринопатии на фоне лечения ингибиторами контрольных точек имеют существенное отличие, так как в большинстве случаев являются необратимыми [27]. Точный механизм возникновения большинства иНЯ неясен. Многие иНЯ характеризуются развитием реакции со стороны клеточного иммунитета: Т-клетки и гистиоциты обнаруживаются в пораженных тканях. Данное явление, вероятнее всего, связано с возникновением перекрестной реакции Т-лимфоцитов как в отношении опухоли, так и в отношении органа-мишени [28, 29].
Как было показано в некоторых исследованиях, полиморфизм гена рецептора CTLA-4 увеличивает риск развития таких заболеваний, как болезнь Грейвса, первичная надпочечниковая недостаточность, тиреоидит Хашимото и сахарный диабет 1 типа [30, 31]. Возможно, полиморфизм генов рецепторов PD1 также играет роль в возникновении патологии щитовидной железы у пациентов, получающих терапию анти-PD1 [5].
Генетическая предрасположенность также может играть важную роль в патогенезе иНЯ, однако в настоящее время этот фактор малоизучен. Например, по данным систематического обзора, включавшего в себя описание 71 случая сахарного диабета на фоне терапии ингибиторами контрольных точек, у 27 из 32 обследованных был выявлен аллель HLA-DR4 [32].
Иммуноопосредованные нежелательные явления, связанные с применением ингибиторов контрольных точек, могут включать в себя гипотиреоз, гипертиреоз, гипофизит, сахарный диабет 1 типа, первичную надпочечниковую недостаточность. Поскольку многие симптомы поражения эндокринной системы являются неспецифическими и могут быть присущи другим острым состояниям, в том числе связанным с наличием злокачественных новообразований, диагностика данной группы патологий представляет определенные сложности даже для опытных клиницистов [33]. Кроме того, корректное определение генеза эндокринопатий — первичный или центральный (связанный с поражением гипофиза) — играет определяющую роль при выборе дальнейшей тактики ведения пациента.
Частота и структура эндокринных иНЯ может различаться при разных схемах терапии. Так, ятрогенное поражение щитовидной железы чаще развивалось на фоне терапии анти-PD1/анти-PDL1, в то время как применение анти-CTLA-4 характеризуется более высоким риском развития гипофизита. Другие виды эндокринных иНЯ, такие как первичная надпочечниковая недостаточность, сахарный диабет 1 типа, встречаются значительно реже. Комбинированная терапия приводила к более высокой распространенности ятрогенных эндокринопатий [3, 4, 34, 35]. Медиана времени возникновения эндокринных иНЯ на фоне терапии анти-CTLA-4 составляет от 1,75 до 5 мес., на фоне терапии анти-PD1/анти-PDL1 — от 1,4 до 4,9 мес. [3, 36].
По результатам метаанализа 2018 г., объединяющего в себе данные 38 клинических исследований с участием более чем 7500 пациентов, получавших монотерапию анти-PD1, анти-PDL1, анти-CTLA-4 или комбинированную терапию, предполагаемая распространенность гипотиреоза составила 3,8% на терапии ипилимумабом, и до 13,2% на терапии анти-PD1/анти-PDL1 или комбинированной терапии. Отмечалось, что риск развития гипертиреоза выше на фоне терапии анти-PD1 в сравнении с анти-PDL1. Частота развития гипофизитов на фоне комбинированной терапии составила 6,4%, 3,2% — на фоне анти-CTLA-4 и 0,4% и 0,1% — на фоне анти-PD1 и анти-PDL1 соответственно [35]. Редкая распространенность первичной надпочечниковой недостаточности и сахарного диабета не позволила провести статистическое сравнение в отношении частоты встречаемости этих осложнений [35]. Эндокринная патология, опосредованная применением ингибиторов контрольных точек, часто приводит к стойкому повреждению органа и требует пожизненного приема заместительной терапии [3, 37, 38].
В настоящее время нет убедительных данных о преимуществах назначения кортикостероидов при развитии эндокринных иНЯ, однако они могут назначаться для смягчения симптомов воспаления при гипофизите, адреналите и некоторых случаях тиреотоксикоза [3, 4, 37, 39, 40].
Патология щитовидной железы
Аутоиммунные заболевания щитовидной железы (аутоиммунный тиреоидит, болезнь Грейвса) чаще всего характеризуются наличием антител к тиреопероксидазе, тиреоглобулину и рецептору тиреотропного гормона (ТТГ), а также сенсибилизированных к данным антигенам Т-лимфоцитов. При аутоиммунном поражении щитовидной железы выявляется лимфоцитарная инфильтрация самого органа: при аутоиммунном тиреоидите — более выраженная, при болезни Грейвса — вариабельная по степени выраженности. Основную часть инфильтрирующих ткань тироцитов составляют Т-клетки, преимущественно 1-го и 2-го типов, и регуляторные Т-лимфоциты. Инфильтрация В-клетками значительно менее выражена при болезни Грейвса, чем при аутоиммунном тиреоидите.
Иммуноопосредованное поражение щитовидной железы чаще ассоциировано с применением анти-PD1/анти-PDL1 или комбинированной терапии, чем с монотерапией анти-CTLA-4, что может быть обусловлено экспрессией PDL1 в клетках щитовидной железы в норме [41, 42].
Дифференциальная диагностика между первичным (вследствие поражения щитовидной железы) и вторичным (вследствие поражения гипофиза) гипотиреозом является необходимой и имеет большое значение при определении дальнейшей тактики ведения пациента [43]. При первичном гипотиреозе наблюдается повышение уровня ТТГ в сочетании с низкими или нормальными уровнями свободного Т3 и свободного Т4, тогда как низкий или нормальный уровень ТТГ в сочетании с низким уровнем свободного Т4 более характерен для вторичного гипотиреоза. Чаще всего первичный гипотиреоз манифестирует с тиреотоксической фазы, сменяясь в последующем стойким гипотиреозом, требующим назначения терапии левотироксином [41]. Предшествующее носительство аутоантител увеличивает риск развития иммуноопосредованной патологии щитовидной железы [44].
Определение уровня ТТГ и свободного Т4 для оценки функции щитовидной железы на фоне иммунотерапии рекомендовано каждые 4–6 нед. При выявлении гипотиреоза тактика ведения соответствует общеклинической: рекомендовано назначение препаратов левотироксина при повышении уровня ТТГ более 10 мМЕ/л. До начала заместительной терапии следует определить уровень базального кортизола для исключения надпочечниковой недостаточности. При подозрении на наличие вторичного гипотиреоза целесообразно исключение вторичного гипокортицизма и гипогонадизма.
Наиболее частой причиной тиреотоксикоза является деструкция щитовидной железы. Снижение содержания ТТГ менее 0,01 мМЕ/л, сопровождающееся повышением уровня свободного Т4 и клиническими проявлениями, такими как учащенное сердцебиение, слабость, снижение массы тела, могут потребовать назначения пропранолола для устранения симптомов. Целесообразен повторный контроль функции щитовидной железы через 4–6 нед. и при стойком снижении ТТГ — дополнительное обследование для выявления причины тиреотоксикоза. Иммуноопосредованная патология щитовидной железы обычно не требует прекращения терапии основного заболевания [45].
Гипофизит
Частота развития гипофизита выше на фоне терапии ипилимумабом, что может быть обусловлено экспрессией CTLA-4 в нормальной ткани гипофиза [46]. Чаще всего поражается передняя доля гипофиза, что сопровождается нарушением функции осей «гипофиз — щитовидная железа», «гипофиз — надпочечники» [37, 47].
Острые симптомы гипофизита наиболее часто включают в себя тошноту, головную боль, слабость, а также симптомы, характерные для гипотиреоза и надпочечниковой недостаточности.
При подозрении на гипофизит необходимо оценить уровни адренокортикотропного гормона (АКТГ), утреннего кортизола, фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), ТТГ, свободного Т4, тестостерона у мужчин, эстрогена у женщин [45]. Также рекомендовано проведение МРТ для дифференциальной диагностики с метастазами в головной мозг. При острых проявлениях гипофизита, сопряженных с масс-эффектом, рекомендовано прервать иммунотерапию и назначить преднизолон/метилпреднизолон из расчета 1–2 мг/кг/сут до разрешения симптомов. Обычно через 1–2 нед. терапия ингибиторами контрольных точек может быть возобновлена.
Чаще гипофизит клинически проявляется признаками дефицита ТТГ, АКТГ и гонадостимулирующих гормонов, требуется возмещение недостатка гормонов посредством заместительной терапии, лечение ингибиторами контрольных точек может быть продолжено.
Первичное поражение надпочечников
Первичное поражение надпочечников чаще отмечается на фоне терапии анти-PD1/анти-PDL1 по сравнению с анти-CTLA-4 и сопровождается развитием таких симптомов, как слабость, снижение массы тела, гипотензия [24]. Обследование на предмет первичной надпочечниковой недостаточности должно включать в себя определение базального уровня кортизола, содержания ренина, электролитов. При выявлении отклонений следующим этапом необходимо оценить уровни АКТГ, ТТГ, ЛГ, ФСГ. При лабораторном контроле отмечается сниженный или низконормальный уровень утреннего кортизола в сочетании с повышенным АКТГ, также может отмечаться снижение уровня натрия и повышение уровня калия. Для снижения риска развития надпочечникового криза терапия кортикостероидами должна начинаться до возмещения дефицита других гормонов. После стабилизации состояния и разрешения клинических проявлений терапия ингибиторами контрольных точек может быть возобновлена. Обычно лечение кортикостероидами является пожизненным, пациенты должны быть информированы о необходимости коррекции терапии в случае инфекции, травмы, хирургического вмешательства.
Гипергликемия / сахарный диабет
По данным ретроспективного исследования, включавшего в себя 2960 пациентов, получавших терапию ингибиторами контрольных точек, распространенность впервые выявленного инсулинозависимого сахарного диабета составила 0,9% [48]. Все пациенты с впервые выявленным сахарным диабетом получали терапию анти-PD1/анти-PDL1. У 76% пациентов имелся генотип HLA-DR4, что значительно выше, чем в общей популяции, для уточнения роли данного аллеля требуются дальнейшие исследования. Сахарный диабет часто манифестирует фульминантной формой, сопровождающейся развитием кетоацидоза [49, 50]. Клиническая картина соответствует классической при сахарном диабете 1 типа и проявляется полиурией, полидипсией, усталостью, снижением массы тела, обезвоживанием. При обследовании выявляется низкий уровень с-пептида, уровень гликированного гемоглобина не всегда значительно повышен, антитела, выявляемые у пациентов с сахарным диабетом 1 типа, обнаруживаются приблизительно в половине случаев [51, 52]. Разрушение β-клеток поджелудочной железы, вызванное ингибиторами контрольных точек, носит необратимый характер и требует назначения инсулинотерапии. В качестве скрининга рекомендован регулярный контроль уровня глюкозы плазмы натощак [45]. Применение кортикостероидов не доказало своей эффективности в отношении реверсии развития сахарного диабета, однако само по себе может усложнять процесс нормализации гликемии.
Иммуноопосредованные нежелательные явления и прогноз выживаемости
Анализ семи проспективных исследований с участием пациентов, получавших терапию анти-PD1/анти-PDL1, продемонстрировал увеличение общей выживаемости среди пациентов, имевших любое иНЯ, при сравнении с пациентами, у которых подобные осложнения не развивались [53]. Однако при интерпретации результатов данного исследования следует учитывать, что пациенты с более длительной продолжительностью терапии ингибиторами контрольных точек имеют большую вероятность развития иНЯ, несмотря на то, что в основном медиана времени возникновения осложнений приходится, как правило, на первые месяцы после начала терапии.
Заключение
Препараты из группы ингибиторов контрольных точек обеспечивают длительную ремиссию заболевания у пациентов с метастатическим раком, но в то же время ассоциируются с высоким риском развития иНЯ. В то время как большинство токсических эффектов традиционной химиотерапии и таргетной терапии легко выявляются при клиническом, лабораторном и инструментальном обследовании, иНЯ до сих пор остаются малоизученными. Четкая и своевременная диагностика иНЯ играет решающую роль при определении дальнейшей тактики в отношении продолжения или прекращения терапии препаратами из группы ингибиторов контрольных точек. Существующие на данный момент рекомендации по диагностике и лечению иНЯ преимущественно основываются на экспертном мнении и потребуют обновления по мере накопления соответствующей информации.
Сведения об авторах:
Жеребчикова Кристина Юрьевна — ассистент кафедры эндокринологии № 1 Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-0292-5907.
Сыч Юлия Петровна — к.м.н., доцент кафедры эндокринологии № 1 Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-7000-0095.
Амосова Мария Вадимовна — ассистент кафедры эндокринологии № 1 Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-1848-8721.
Секачева Марина Игоревна — д.м.н., профессор, директор института персонализированной медицины, руководитель Центра персонализированной онкологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-0015-7094.
Фадеев Валентин Викторович — д.м.н., профессор, член-корр. РАН, заведующий кафедрой эндокринологии № 1 Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-2504-7468.
Виленский Алексей Александрович — заведующий отделением противоопухолевой лекарственной терапии МНОЦ МГУ имени М.В. Ломоносова; 119991, Россия, г. Москва, Ленинские горы, д. 1; ORCID iD 0000-0002-3094-7671.
Контактная информация: Жеребчикова Кристина Юрьевна, e-mail: k.y.zherebchikova@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 17.07.2022.
Поступила после рецензирования 09.08.2022.
Принята в печать 01.09.2022.
About the authors:
Kristina Yu. Zherebchikova — assistant of Department of Endocrinology No.1, N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-0292-5907.
Yulia P. Sych — C. Sc. (Med.), associate professor of Department of Endocrinology No.1, N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-7000-0095.
Maria V. Amosova — assistant of Department of Endocrinology No.1, N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-1848-8721.
Marina I. Sekacheva — Dr. Sc. (Med.), Professor, Director of the Institute for Personalized Medicine, Head of the Center for Personalized Oncology (OncoTarget), I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-0015-7094.
Valentin V. Fadeev — Dr. Sc. (Med.), Professor, Corresponding Member of the Russian Academy of Sciences, Head of Department of Endocrinology No.1, N.V. Sklifosovsky Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-2504-7468.
Aleksey A. Vilensky — Head of the Department of Anticancer Drug Therapy, Medical Research and Educational Centre, Lomonosov Moscow State University; 1, Leninskie Gory, Moscow, 119991, Russian Federation; ORCID iD 0000-0002-3094-7671.
Contact information: Kristina Yu. Zherebchikova, e-mail: k.y.zherebchikova@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 17.07.2022.
Revised 09.08.2022.
Accepted 01.09.2022.
Информация с rmj.ru
