Содержание статьи
Введение
Контраст-индуцированное острое повреждение почек (КИ-ОПП) — это развитие острого почечного повреждения (ОПП) после введения рентгеноконтрастного средства (РКС) при отсутствии альтернативной этиологии [1]. Существует несколько определений КИ-ОПП, но на сегодняшний день общепринятым является определение, предложенное «Инициативой по улучшению глобальных исходов лечения пациентов с болезнью почек» (Kidney Disease Improving Global Outcomes, KDIGO), согласно которому под КИ-ОПП понимают повышение сывороточного креатинина (СКр) более чем на 0,3 мг/дл, или 26,5 мкмоль/л, в течение 48 ч после введения РКС или его повышение более чем на 50% в течение 7 дней после введения РКС [2–4].
Частота КИ-ОПП у пациентов, перенесших чрескожное коронарное вмешательство (ЧКВ), варьирует от 5,3% до 44,5% [3, 4]. Развитие КИ-ОПП напрямую связано с неблагоприятными исходами, такими как увеличение сроков пребывания в стационаре и расходов на лечение, необратимое повреждение почек с исходом в хроническую болезнь почек (ХБП) различных стадий, а также неблагоприятные сердечно-сосудистые события, необходимость в заместительной почечной терапии и смерть [1, 5–7].
Специфического эффективного лечения КИ-ОПП не существует, поэтому первичной целью является профилактика ОПП. Несмотря на проведение множества исследований, посвященных различным фармакологическим стратегиям для предотвращения КИ-ОПП перед ЧКВ [1, 8], имеются ограниченные доказательства эффективности подобных стратегий в интра- или послеоперационном периоде. Данный обзор посвящен обсуждению доступных в настоящее время интра- и послеоперационных стратегий снижения частоты КИ-ОПП.
Патофизиология контраст-индуцированного острого повреждения почек
Патофизиология КИ-ОПП многофакторна и изучена в деталях лишь в последние годы (рис. 1). РКС индуцирует высвобождение эндотелина и аденозина из эндотелия почечного клубочка, а также влияет на снижение продукции оксида азота и простагландинов, что в совокупности вызывает сосудистый спазм. Гипоперфузия почечной паренхимы на фоне спазма приводит к гипоксии чувствительного к ишемии коркового вещества почек [1, 8]. Кроме того, РКС оказывает прямое токсическое воздействие на эпителиальные клетки канальцев (осмотический нефроз), а вязкость РКС препятствует доставке кислорода из крови. Эти механизмы запускают высвобождение активных форм кислорода, тем самым повышая окислительный стресс [1, 8]. Кроме прямого воздействия РКС существуют другие факторы, способствующие развитию КИ-ОПП, например эмболизация атеросклеротическим содержимым из аортальных атеросклеротических бляшек при работе через бедренный доступ [9], перипроцедурная гипотензия и кровотечение, вызывающие ишемическое повреждение почек. Эти механизмы сами по себе могут вызывать ОПП и усиливать вредное воздействие РКС, особенно при сложном ЧКВ у пациентов с высоким риском [8, 10].
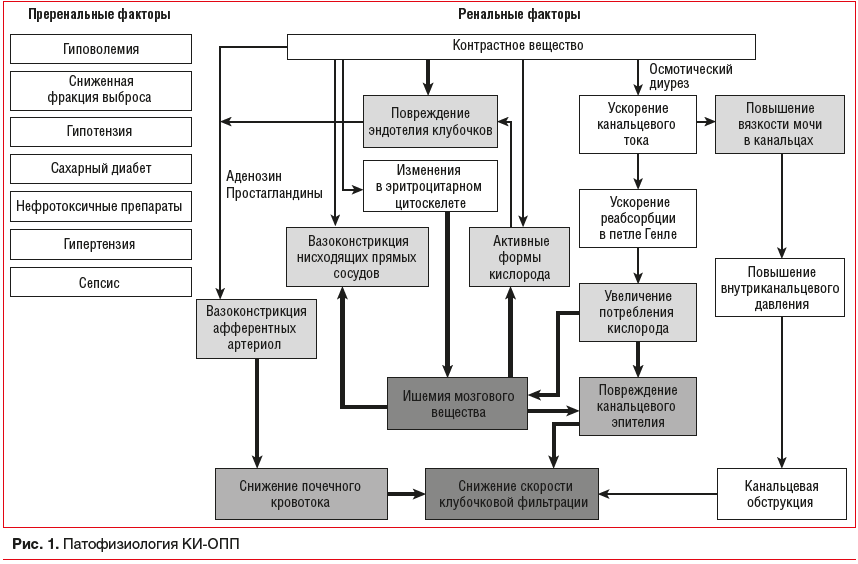
Факторы риска КИ-ОПП
Частота КИ-ОПП может достигать 47% у пациентов с тяжелой ХБП, определяемой при расчетной скорости клубочковой фильтрации (СКФ) <30 мл / мин / 1,73 м2 (по формуле CKD-EPI [Chronic Kidney Disease Epidemiology Collaboration]). СКФ ниже 30 мл / мин / 1,73 м2 более чем трехкратно повышает риск развития КИ-ОПП по сравнению с нормальной СКФ [11].
Почечная гипоперфузия является важнейшим фактором риска развития КИ-ОПП. Кардиологическими причинами гипотензии и гипоперфузии могут быть кардиогенный шок, острая сердечная недостаточность, острый коронарный синдром (ОКС) и другие состояния [7, 11, 12]. Прочие факторы, тесно связанные с развитием КИ-ОПП, — пожилой и старческий возраст (75 лет и старше), сахарный диабет, анемия любой этиологии и низкая фракция выброса левого желудочка [1, 7, 12]. Дегидратация является важным фактором риска развития КИ-ОПП, т. к. повышает концентрацию РКС в канальцах и замедляет его выведение [1, 13, 14]. Оценка риска имеет первостепенное значение у пациентов с выявленным высоким риском КИ-ОПП и проводится с помощью валидированных шкал (табл. 1 и 2).
![Таблица 1. Стратификация рисков развития КИ-ОПП по R. Mehran et al. (2004) [12] Таблица 1. Стратификация рисков развития КИ-ОПП по R. Mehran et al. (2004) [12]](https://medblog.su/wp-content/uploads/2021/04/1617565683_371_metody-snizheniya-chastoty-kontrast-indutsirovannogo-ostrogo-pochechnogo-povrezhdeniya-posle-chreskozhnyh-koronarnyh-vmeshatelstv-hilchuk-a-a-abugov-s-a-shherbak-s-g-gladyshev-d-v.png)
![Таблица 2. Стратификация рисков развития КИ-ОПП по M. Maioli et al. (2010) [14] Таблица 2. Стратификация рисков развития КИ-ОПП по M. Maioli et al. (2010) [14]](https://medblog.su/wp-content/uploads/2021/04/1617565683_731_metody-snizheniya-chastoty-kontrast-indutsirovannogo-ostrogo-pochechnogo-povrezhdeniya-posle-chreskozhnyh-koronarnyh-vmeshatelstv-hilchuk-a-a-abugov-s-a-shherbak-s-g-gladyshev-d-v.png)
Предоперационные стратегии профилактики КИ-ОПП
Одна из самых важных предоперационных мер, позволяющих снизить вероятность возникновения КИ-ОПП, — это достаточная гидратация до и после рентгеноконтрастного вмешательства. Она должна быть основана в первую очередь на внутривенном введении 0,9% раствора NaCl, поскольку прочие растворы не продемонстрировали каких-либо преимуществ в профилактике ОПП (раствор бикарбоната Na, 0,45% раствор NaCl и др.) [1, 2, 15–17]. В ряде исследований тем не менее продемонстрировано, что индивидуальный подбор объема гидратации, основанный на оценке конечно-диастолического давления левого желудочка [18, 19], центрального венозного давления [20], ведет к снижению уровня КИ-ОПП по сравнению со стандартным протоколом внутривенной гидратации. При планировании ЧКВ необходимо прекратить прием любых нефротоксических препаратов не менее чем за 24–48 ч до введения РКС [1, 7, 8].
В ряде небольших рандомизированных исследований (РКИ), в которых сравнивали эффективность различных лекарственных средств, таких как N-ацетилцистеин, бикарбонат натрия, триметазидин, фенолдопам и др., было продемонстрировано снижение частоты КИ-ОПП в группах пациентов, получавших указанные лекарственные средства. В крупных РКИ ни одно лекарственное средство на сегодняшний день не показало достоверной пользы с целью профилактики КИ-ОПП [16, 21]. Единственное исключение — сильнодействующие статины (главным образом, розувастатин), которые пациенты получали непосредственно до и сразу после введения РКС. Благодаря плейотропному эффекту статины действуют как стабилизаторы эндотелия сосудов почек, повышая выработку оксида азота. Также они обладают антиоксидантным, противовоспалительным и антитромботическим действием. В 2 контролируемых РКИ, включавших пациентов с высоким риском развития КИ-ОПП, которым выполнялись коронарная ангиография (КАГ) и ЧКВ, перипроцедурный прием розувастатина приводил к снижению частоты развития КИ-ОПП на 62% в сравнении со стандартной внутривенной профилактикой [22–24].
Стратегии уменьшения объема рентгеноконтрастного средства
Объем введенного РКС прямо пропорционален риску развития КИ-ОПП [3, 25], а его цитотоксическое воздействие более выражено при наличии у пациента ХБП. Отношение объема РКС к клиренсу креатинина (КК) (объем РКС/КК) >2 определяется как самостоятельный предиктор КИ-ОПП у пациентов с СКФ <30 мл / мин / 1,73 м2 [18], и, как следствие, предпочтительным является значение «объем РКС/КК» <1. У пациентов из группы риска применение разведенного РКС (50% 0,9% NaCl на 50% РКС) является известной мерой для уменьшения объема контраста и одновременного сохранения приемлемого качества изображения.
Предложены следующие стратегии интраоперационного уменьшения объема РКС [26]:
Использование диагностических катетеров 5F без боковых отверстий.
Просмотр ранее выполненных коронарных ангиограмм, чтобы избежать выполнения новых диагностических снимков без необходимости.
Использование по возможности двухпроекционной (бипланарной) ангиографии.
Использование разведенного РКС, ограничение его объема, вводимого за одну инъекцию.
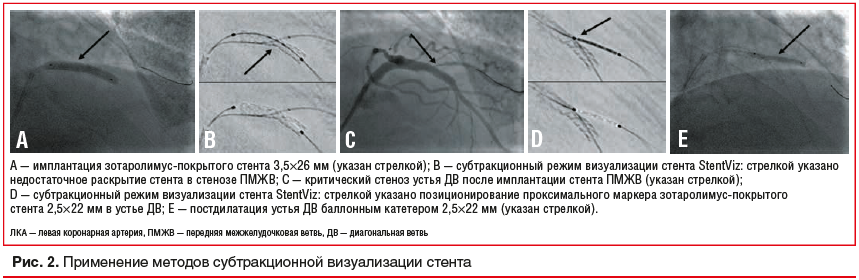
Применение методов субтракционной визуализации стента: StentViz и StentVesselViz (GE Healthcare, Франция), StentBoost (Phillips, Нидерланды) и др. (рис. 2) для минимизации контрольных съемок после этапов стентирования.
Использование увеличенной частоты кадров (15 или 30 в секунду) для повышения качества изображения диагностических ангиограмм и оценки конечного результата ЧКВ.
Уменьшение объема РКС в направляющем катетере путем забора пара или откачки перед введением оборудования.
Применение интракоронарного ультразвука (ИКУЗ), оптической когерентной томографии (ОКТ) c декстраном и измерение фракционного резерва кровотока (ФРК) или мгновенного безволнового соотношения (instantaneous wave-free ratio, iFR).
Выполнение трансторакальной эхокардиографии при бесконтрастном ЧКВ для выявления перикардиального экссудата до и после операции.
Обосновано применение специализированных систем для контролируемой гидратации. Система RenalGuard (RenalGuard Solutions, США) — устройство, которое позволяет оптимизировать внутривенную гидратацию путем регулировки вводимого объема раствора и контроля диуреза пациента. За 1 ч до операции внутривенно вводится фуросемид и по достижении диуреза, равного 300 мл/ч, выполняется ЧКВ. Контролируемая объемом диуреза сопоставимая внутривенная гидратация продолжается во время операции и 4 ч после нее. В результате достижения высокого диуреза концентрация РКС значительно разводится, следовательно, его токсическое воздействие на почки снижается. Рандомизированные исследования, в которых сравнивается гидратация, отрегулированная с помощью RenalGuard, со стандартными протоколами гидратации, показали снижение частоты КИ-ОПП на 53% у пациентов со средней и тяжелой формами ХБП, которым выполнялись КАГ и ЧКВ [4, 26, 27]. Использование RenalGuard должно рассматриваться как мера по снижению риска КИ-ОПП.
Внутрисосудистая визуализация
Внутрисосудистая визуализация — основа протокола ЧКВ с нулевым или сверхмалым объемом РКС (рис. 3). Самым часто используемым методом внутриартериальной визуализации является ИКУЗ. В исследовании MOZART [28] 83 пациента были рандомизированы на 2 группы: ЧКВ с помощью классической контрастной ангиографии и ЧКВ с помощью ИКУЗ для уменьшения объема вводимого РКС. Операторам рекомендовалось принимать меры по уменьшению объема контраста у пациентов из обеих групп. Средний объем РКС составил 20 (12,5; 30) мл у пациентов из группы ИКУЗ против 64,5 (42,8; 97) мл у пациентов из группы контрастной ангиографии (р<0,001). Достоверной разницы в показателях КИ-ОПП выявлено не было. Исследование MOZART II (ClinicalTrials.gov Identifier: NCT02743156), целью которого была оценка различий частоты КИ-ОПП, проводится в настоящий момент.
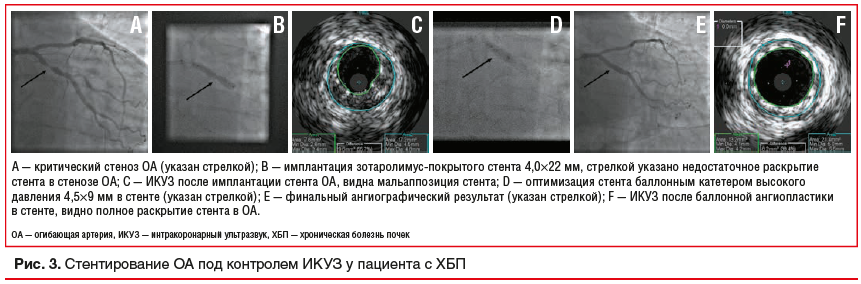
Z.A. Ali et al. (2016) [29] предложили протокол выполнения ЧКВ без РКС у 31 пациента со сниженной СКФ (16±8 мл / мин / 1,73 м2). ЧКВ без РКС выполнялось через несколько дней после КАГ с использованием минимального количества РКС. Протокол основан на рутинном выполнении ИКУЗ, а также измерении ФРК коронарных артерий. ФРК определялся перед ЧКВ для подтверждения физиологической значимости стенозов и после ЧКВ для оценки результата стентирования. ИКУЗ использовался для определения проксимальных и дистальных зон имплантации, выбора длины стента и оценки тактики постдилатации, а также для оценки конечного результата. Результатом такого подхода была меньшая частота неблагоприятных сердечно-сосудистых событий в краткосрочном и отдаленных периодах у всех пациентов в группе ИКУЗ.
ОКТ в сравнении с ИКУЗ обеспечивает лучшее разрешение и более четкое определение внутрисосудистой анатомии и артериальных структур, например включений кальция, тромбоза и др. ОКТ требует адекватного наполнения просвета артерии для получения изображения, что обычно достигается при помощи РКС, однако существует возможность выполнения ОКТ при помощи низкомолекулярного декстрана [30, 31]. ОКТ на основе декстрана дает сравнимое качество изображения и почти такие же пространственные характеристики среды. Тем не менее опыт проведения ЧКВ при помощи ОКТ на основе декстрана с нулевым или сверхмалым объемом РКС незначителен [30, 31]. Декстран не считается нефротоксическим в объемах, используемых при ЧКВ (<100 мл), несмотря на классический обзор о декстран-индуцированном ОПП при больших его объемах (>1 л) [32]. Среди других побочных эффектов декстрана — анафилактическая реакция и коагулопатия [30]. Необходимо дальнейшее изучение безопасности данного подхода, прежде чем давать рекомендации по его широкому применению.
Ишемическое прекондиционирование
Механизм ишемического прекондиционирования остается малоизученным. Одна из его теорий состоит в том, что повышение циркуляции брадикининов, оксида азота и эритропоэтина в крови снижает степень повреждения при ишемии/гипоперфузии почек, тем самым уменьшая риск развития КИ-ОПП [33]. Протокол прекондиционирования с 4 циклами попеременного 5-минутного раздувания и 5-минутного сдувания манжеты на правой руке пациента до ЧКВ испытывался в небольшом рандомизированном исследовании F. Er et al. (2012) [33]. Исследователи рандомизировали 100 пациентов с СКФ <60 мл / мин / 1,73 м2, которым выполнялись КАГ и КАГ с ЧКВ, на группу ишемического прекондиционирования и группу стандартного лечения. Прекондиционирование было связано с абсолютным снижением риска КИ-ОПП на 28% (отношение шансов [ОШ] 0,21; 95% доверительный интервал [ДИ] 0,07–0,57; р=0,002). В другом рандомизированном исследовании, включавшем 225 пациентов с инфарктом миокарда без элевации сегмента ST, которым выполнялось ЧКВ [34], проводилось ишемическое посткондиционирование — инфляция и дефляция баллонного катетера в инфаркт-связанной артерии в течение 30 с после стентирования. В результате наблюдалось снижение уровня КИ-ОПП (12,4% против 29,5%; р=0,002), однако возможность внедрения удаленного ишемического прекондиционирования в обычную клиническую практику требует более уверенных доказательств.
Сосудистый доступ
Использование лучевого доступа связано со снижением риска крупных кровотечений по сравнению с таковым при бедренном доступе. В метаанализе 6 исследований оценивали артериальный доступ и риск КИ-ОПП у 26 185 пациентов после ЧКВ. Лучевой доступ был связан с более низким риском развития КИ-ОПП (ОШ 0,51; 95% ДИ 0,39–0,67; р<0,0001) [7, 9], чем бедренный, однако мета-анализ был ограничен различными определениями КИ-ОПП во включенных исследованиях и различиями сопутствующих заболеваний и протоколов лечения в группах транс-радиального и трансфеморального доступов. В исследовании MATRIX-ACCESS 8210 пациентов с ОКС, которым выполнялось ЧКВ, были рандомизированы в группы лучевого и бедренного доступов [35]. КИ-ОПП было выявлено у меньшего числа пациентов из группы лучевого доступа в сравнении с группой бедренного доступа, — 15,4% против 17,4% соответственно (ОШ 0,87; 95% ДИ 0,77–0,98; р=0,02). Имеющиеся доказательства свидетельствуют о преимуществе лучевого доступа перед бедренным в снижении риска развития КИ-ОПП.
Выводы
Несмотря на широкое внедрение рекомендованных профилактических мер, КИ-ОПП остается частым осложнением после введения РКС при КАГ и ЧКВ, а пациенты с ХБП имеют высокий риск развития КИ-ОПП. Инновационные интра- и послеоперационные стратегии по минимизации риска КИ-ОПП обоснованы, а одна из самых важных мер — это уменьшение объема РКС. Бесконтрастная ЧКВ и ЧКВ со сверхмалым объемом РКС значительно снижают частоту КИ-ОПП, но требуют использования внутрисосудистой визуализации (ИКУЗ и ОКТ) и разведенного РКС. Артериальный доступ через лучевую артерию должен быть методом выбора, чтобы снизить риск крупного кровотечения и возможную эмболизацию атеросклеротическим содержимым при навигации катетера в нисходящей и брюшной аорте.
Использование гемодинамической поддержки у пациентов с высоким риском и ишемическое прекондиционирование представляют интерес, но необходимы дальнейшие исследования для подтверждения эффективности данных подходов. Дальнейшие исследования должны быть направлены на обоснование этих стратегий с целью улучшения качества оказания медицинской помощи пациентам с высоким риском развития КИ-ОПП.
Благодарность
Коллектив авторов выражает благодарность заведующему отделением рентгенэндоваскулярных методов диагностики и лечения СПб ГБУЗ «Городская больница № 40» к.м.н. С.В. Власенко за помощь в подготовке публикации.
Авторы заявляют об отсутствии конфликтов интересов, связанных с данной публикацией.
.
Информация с rmj.ru




