Введение
Трудности постановки диагноза первичной открытоугольной глаукомы (ПОУГ) на начальной стадии заключаются в отсутствии жалоб у пациента и сложностях дифференциальной диагностики между нормой и начальными проявлениями заболевания. Это подкрепляется наличием сомнительных и непостоянных колебаний уровня внутриглазного давления (ВГД), с клинически незначимой асимметрией, сохранным передним отрезком глаза и отсутствием морфометрических и функциональных изменений по данным дополнительных методов визуализации. Помимо этого, очевидными проблемами этой категории пациентов являются отсутствие мотивации к лечению и низкий уровень соблюдения рекомендованного режима назначений [1]. Большинство авторов согласны с тем, что для повышения приверженности лечению пациентам с ПОУГ следует рекомендовать более качественные стратегии лечебно-диагностического процесса. Знание предикторов, характеризующих повышенный риск развития и прогрессирования глаукомной оптической нейропатии (ГОН), важно для всех лиц, вовлеченных в управление лечебно-диагностическим процессом. Наиболее уязвимыми группами риска неудовлетворительного соблюдения врачебных рекомендаций являются пациенты среднего возраста (50–59 лет), а также старше 80 лет, пациенты с более длительной продолжительностью ПОУГ и необходимостью в постороннем уходе, с тремя или более тяжелыми соматическими заболеваниями в дополнение к глаукоме. В этой связи очевидной становится необходимость разработки и внедрения эффективных персонализированных инструментов, способствующих повышению осведомленности пациентов о заболевании и медицинского персонала о тактике ведения разных групп больных [2].
Далее представлен разбор клинического наблюдения, наглядно демонстрирующий эффективность диагностики и назначенного лечения при должном соблюдении пациентом врачебных рекомендаций.
Клиническое наблюдение
Пациентка М., 1946 г. р., обратилась в офтальмологическое отделение ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России в феврале 2006 г. во время проведения плановой диспансеризации при полном отсутствии жалоб на момент осмотра. Офтальмостатус был следующим: максимально корригируемая острота зрения (МКОЗ) OU=1,0; уровень ВГД (Рt) — 23 мм рт. ст. и 24 мм рт. ст. соответственно По данным биомикроскопии было отмечено наличие небольшого количества псевдоэксфолиативного материала, расположенного по зрачковой кайме (преимущественно на правом глазу), а по данным офтальмоскопии была выявлена разница в состоянии дисков зрительных нервов (ДЗН): краевой характер экскавации — умеренного размера (соотношение экскавации к ДЗН (Э/Д) — до 0,6), более выраженный на правом глазу. Были использованы дополнительные методы обследования. Так, по результатам стандартной автоматической периметрии (САП) по программе 24-2 (Humphrey Field Analyzer 740, Carl Zeiss, Германия) среднее отклонение (mean deviation, MD) OD/OS составило +0,16/-0,53 дБ; среднеквадратичное отклонение (pattern standart deviation, PSD) OD/OS — 1,49/1,26 дБ.
Ретинотомографические морфометрические результаты (Heidelberg Retina Tomograph, HRT, version 3.0.2/2078, Heidelberg Engineering, Германия): площадь нейроретинального пояска (НРП) — 1,03/1,08 мм3, объем НРП — 0,19/0,24 мм3, средняя толщина слоя нервных волокон сетчатки (СНВС) — 0,20/0,23 мм, объемный профиль экскавации — -0,16/-0,18, высота вариации поверхности сетчатки — 0,29/0,30 мм, Э/Д — 0,66/0,62. При изучении результатов Мурфилдского регрессионного анализа (Moorfields Regression Analysis, MRA) было установлено пограничное снижение профиля СНВС в височном, носовом и нижненосовом секторах на правом глазу, верхневисочном, верхненосовом и нижненосовом секторах на левом глазу.
Кератопахиметрические показатели OD/OS находились в пределах средней нормы (554/552 мкм). С учетом приведенных выше результатов обследования пациентке был установлен следующий клинический диагноз: «Подозрение на глаукому обоих глаз». Пациентке был рекомендован ежеквартальный режим наблюдения, который она тщательно соблюдала. В течение 2007 г. несколько раз отмечались колебания уровня ВГД (Pt) с преимущественным повышением офтальмотонуса на правом глазу (до 23 мм рт. ст.). Другие обнаруженные изменения переднего и заднего отрезка глаза (наличие псевдоэксфолиативного материала, увеличение соотношения Э/Д с потерей ретинальной ткани в нижневисочной краевой зоне и выявленный участок значительного снижения профиля СНВС в нижневисочном сегменте на левом глазу) позволили сформулировать окончательный клинический диагноз (декабрь 2007 г.): «Первичная открытоугольная Iа глаукома обоих глаз». Была назначена стартовая местная гипотензивная терапия с использованием аналогов простагландинов (АПГ) — латанопрост 0,005% в оба глаза. Контроль уровня ВГД через 2 дня после назначения гипотензивной терапии (Рt) показал снижение до 19/16 мм рт. ст.
В период динамического наблюдения с 2007 по 2009 г. характеристики морфометрической структуры ДЗН и САП были без клинически значимой отрицательной динамики. Уровень ВГД (Р0) OU в указанный период находился в пределах 19 мм рт. ст. В январе 2010 г. была отмечена отрицательная динамика (данные кластерного анализа показали депрессию толщины СНВС в нижневисочном секторе правого глаза, однако, по данным MRA, выявлены изменения толщины СНВС в верхненосовом и нижненосовом сегментах), что свидетельствовало в пользу прогрессирования ГОН. В марте 2010 г. повторно были отмечены выраженные флюктуации уровня ВГД (Р0) на правом глазу (субкомпенсация до 25 мм рт. ст.) [3]. С учетом данных находок была проведена смена медикаментозной терапии с назначением комбинации селективного бета-адреноблокатора (ББ) и АПГ. После этого в течение года уровень офтальмотонуса был нормализован.
На фоне вышеуказанной гипотензивной терапии, которая соблюдалась 1,5 года, в июле 2011 г. были выявлены очередные эпизоды субкомпенсации уровня ВГД (Р0)
на левом глазу (>25 мм рт. ст.). Было принято решение о смене гипотензивного режима на комбинированную местную гипотензивную терапию с применением фиксированной комбинации (ФК), включающей местный ингибитор карбоангидразы (ИКА) и неселективный ББ (тимолола малеат). На фоне указанных инстилляций пациентка практически сразу стала предъявлять жалобы на гиперемию и зуд век, которые в течение нескольких месяцев усиливались. Это состояние было расценено как индивидуальная непереносимость компонентов местных гипотензивных препаратов, возможно, их консервантов. Вместе с тем уровень ВГД (Р0) на данном режиме был компенсирован и находился в пределах 20 мм рт. ст. В связи с явлениями индивидуальной непереносимости была изменена схема лечения — назначена комбинированная терапия ББ + АПГ. По данным HRT (протокол анализа топографических изменений — Topographic Change Analysis, ТСА), с июля 2011 г. на правом глазу была отмечена тенденция к постепенному прогрессирующему истончению НРП в нижневисочном сегменте. Аналогичные прогрессирующие изменения НРП на левом глазу выявлены в мае 2015 г. Данный тип анализа отражает изменения морфометрических параметров ДЗН. Участки депрессии свидетельствуют об отрицательной динамике, участки экспрессии показывают улучшение морфометрических показателей после смены режима.
Такие находки послужили причиной смены медикаментозной терапии — в очередной раз была использована комбинированная схема ББ + ИКА как обладающая достаточным гипотензивным эффектом (несмотря на повышенную чувствительность пациентки к препарату). Уровень ВГД (Р0) на указанном режиме находился в пределах 19–20 мм рт. ст. По данным анализа прогрессирования периметрических изменений (Glaucoma Probability Analysis — GPA Summary) (САП, программа 24-2), в пе-риод наблюдения с 2006 по 2014 г. статистически значимого снижения световой чувствительности не было выявлено (периметрический индекс светочувствительности MD на обоих глазах за период с 2006 по 2014 г. находился в пределах от -0,81 до -1,82 дБ).
В течение следующих 2 лет уровень ВГД (Р0) был в пределах 19–20 мм рт. ст. на фоне применения вышеуказанной ФК (ББ + ИКА). С учетом продолжительности ее использования (и в этой связи с высокой вероятностью развития нарушения толерантности) была рекомендована плановая смена местной гипотензивной терапии на однократную инстилляцию ФК тимолола малеат 0,5% + биматопрост 0,03%. Уровень ВГД (Р0) на заданном режиме даже несколько понизился и в течение следующего года не превышал 16 мм рт. ст.
С июня 2014 г. для выявления прогрессирования ГОН стал использоваться глаукомный модуль оптического когерентного томографа (ОКТ) Spectralis Tracking Laser Tomography, Heidelberg Engineering, Германия. Его применение позволило определить снижение средней толщины СНВС верхнего сектора правого глаза (до 79 мкм, -14%). Показатели средней толщины СНВС ОКТ правого глаза соответствовали изменениям толщины СНВС по результатам HRT, тогда как толщина СНВС левого глаза по данным двух приборов не менялась, оставаясь в пределах возрастной нормы (92 мкм).
В период наблюдения с 2014 по 2016 г. при соблюдении прежнего гипотензивного режима уровень ВГД (Р0) находился в пределах 16–17 мм рт. ст., статистически значимой отрицательной динамики по данным HRT, ОКТ и САП обнаружено не было. После 2-летнего четкого соблюдения данного гипотензивного режима у пациентки появились и несколько усилились жалобы на гиперемию глаз и чувство инородного тела. Такое состояние было расценено как очередное проявление индивидуальной реакции на применение компонентов гипотензивного режима. Следствием этого осенью 2016 г. стала смена медикаментозной терапии: назначен бесконсервантный препарат в ФК (тимолола малеат 0,5% и тафлупрост 0,0015%). В результате смены терапии уровень ВГД (Р0) был компенсирован в пределах 17–19 мм рт. ст. Вместе с тем, по данным ОКТ (в ноябре 2018 г.), отмечалось статистически незначимое прогрессирующее снижение толщины СНВС в верхнем секторе, к которому добавились изменения в нижненосовом секторе (до 77 мкм) правого глаза, толщина СНВС левого глаза не уменьшалась. Эти изменения отражены в анализе ОКТ (протокол оценки толщины СНВС, Retinal Nerve Fiber Layer thickness, RNFL, векторный анализ) (рис. 1).
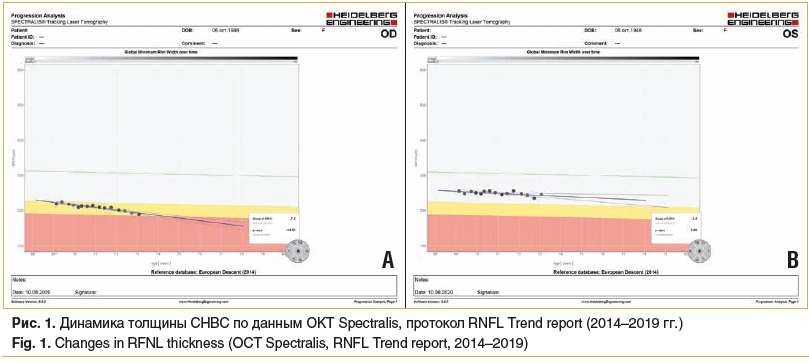
Также была отмечена и сомнительная отрицательная морфометрическая динамика согласно данным Гейдельбергской томографии на обоих глазах (рис. 2), а по результатам САП (протокол 24-2) показатели оставались в пределах возрастной нормы, прогрессирование ГОН выявлено не было. Обнаруженные изменения подразумевали прогрессирование у пациентки начальной катаракты, с преимущественными изменениями слоев хрусталика в проекции зрительного нерва, что объясняет различие в результатах применения разных методов диагностики, т. к. при выполнении САП оценивается периферическое поле зрения, а при анализе структурных показателей ДЗН с помощью ОКТ и Гейдельбергской томографии исследуется локально зона ДЗН.
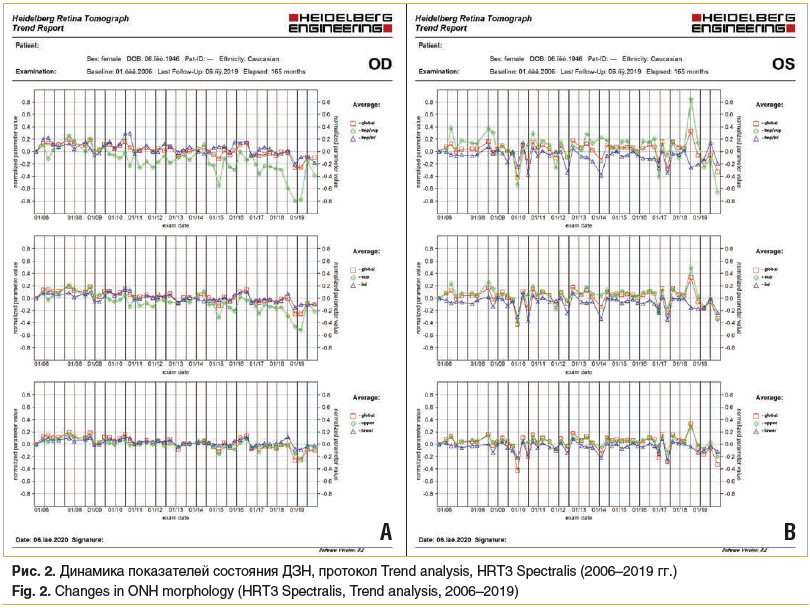
С учетом вышеприведенных данных принято решение о сохранении прежнего режима, т. к. у пациентки отмечалась индивидуальная непереносимость компонентов ФК ББ + ИКА. В январе 2019 г., во время проведения очередной диспансеризации, развитие катаракты было подтверждено увеличением миопической рефракции и понижением остроты зрения (МКОЗ OD/OS с sph -2,0 дптр = 0,5/0,6). Поскольку во время мониторинга глаукомы в марте 2019 г. была выявлена отрицательная динамика по данным анализа ОКТ и HRT, а стадия глаукомы, по данным САП (протокол 24-2), все еще соответствовала начальной, было принято решение о проведении селективной лазерной трабекулопластики на обоих глазах. Уровень ВГД (Р0) через 1 мес. после данной операции при сохранении прежнего гипотензивного режима составил 16 мм рт. ст., таким же он оставался и через 3 мес.
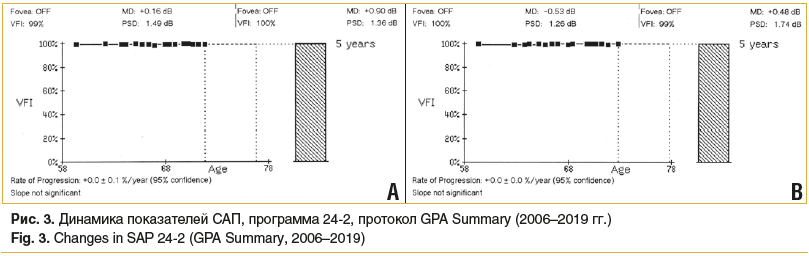
В период наблюдения с марта по ноябрь 2019 г. уровень ВГД (Р0) находился в пределах 17–19 мм рт. ст. на фоне прежнего гипотензивного режима. Оценка кластерного и векторного анализов, выполненных с использованием приборов HRT и ОКТ, не показала участков депрессии толщины СНВС. При проведении САП в 2019 г. (протокол GPA Summary) также не было выявлено фокальных изменений светочувствительности сетчатки на OD/OS (состояние индекса MD — -1,22/-2,13 дБ, PSD — 1,68/1,64 дБ) (рис. 3). С учетом наличия и характеристики прогрессирования катаракты, а также стабилизации глаукомного процесса пациентке было рекомендовано плановое оперативное лечение — факоэмульсификация катаракты с имплантацией интраокулярной линзы.
Описанное клиническое наблюдение демонстрирует не только важность своевременной диагностики ПОУГ и назначения комплекса лечебно-диагностических мероприятий врачом, но и необходимость соблюдения всех рекомендаций в полном объеме пациентом.
Обсуждение
Исследование по лечению офтальмогипертензии — Ocular Hypertension Treatment Study показало, что местное гипотензивное лечение является эффективным для замедления прогрессирования ПОУГ, а также понижает вероятность развития глаукомы у лиц с повышенным уровнем ВГД (так называемая офтальмогипертензия) без признаков глаукомного повреждения [4]. Долгосрочное соблюдение режима лечения хронического бессимптомного состояния является сложной задачей для многих пациентов. Оценка терапии прогрессирующей глаукомы также может вызывать затруднения у врачей, поскольку допущение об эффективности лечения основано на их предположении о соблюдении пациентом всех рекомендаций. Приверженность является сложным многофакторным явлением, на которое может влиять любое количество переменных, включая факторы, связанные с пациентом, терапией, сопутствующими заболеваниями, системой здравоохранения, а также социально-экономические факторы [5].
Несмотря на повышенную осведомленность о заболеваниях, плохая приверженность лечению хронических патологий остается глобальной проблемой. Всемирная организация здравоохранения определила приверженность как «степень, в которой поведение человека — прием лекарств, соблюдение диеты или изменение образа жизни — соответствует согласованным рекомендациям поставщика медицинских услуг» [6, 7]. Результаты других исследований демонстрируют, что врачебные рекомендации выполняют лишь 50% пациентов. Ретроспективный анализ Т.Н. Малишевской и соавт. (2016) показал, что к концу 5-го года наблюдения 15% пациентов с продвинутыми стадиями глаукомы остаются комплаентными, 52% не соблюдают назначения врача, 33% недостаточно комплаентны и составляют группу риска некомплаентности [7].
В ретроспективном исследовании Р.А. Newman-Casey et al. (2015) обнаружили, что у пациентов с впервые выявленной глаукомой, уже получавших гипотензивную терапию, приверженность лечению в течение 1-го года лечения обычно хорошо предопределяет, как люди будут выполнять назначения врача на протяжении более продолжительного срока. Почти все те, у кого в течение 1-го года сохранялась хорошая приверженность, сохраняли ее и в течение последующих 4 лет [8]. Разные исследования последовательно выявляли различные причины, препятствующие соблюдению режима лечения, а именно: отсутствие у пациентов знаний о долгосрочных последствиях глаукомы, проблемы, связанные с чтением инструкций, трудности с закапыванием капель или плохую технику, полипрагмазию, финансовые расходы на лекарства и побочные эффекты в отношении компонентов препаратов [9]. С.Ю. Казанова и В.В. Страхов (2016) определили темпы прогрессирования глаукомного процесса в группах с различными вариантами некомплаентности пациентов и установили, что в среднем переход заболевания на одну стадию происходит за 2,5 года на худшем глазу. На парном глазу скорость прогрессирования ниже и составляет одну стадию в 6 лет. С одной стороны, это подчеркивает асимметричность течения глаукомы, с другой — свидетельствует о том, что на парных глазах ПОУГ диагностируется раньше и лечится активнее (а пациент лучше выполняет рекомендации), имея в качестве отрицательного примера худший глаз [10]. Комбинации с фиксированными дозами в одной лекарственной форме упрощают прием и улучшают приверженность лечению. Индивидуальный подход к пациенту необходим для соблюдения схем лечения. Достижение приверженности может оказать гораздо большее влияние, чем любой другой подход, на улучшение лечения и прогноза заболевания, а система здравоохранения должна прилагать усилия для решения этой проблемы [11, 12].
Заключение
Представленное клиническое наблюдение демонстрирует низкую скорость прогрессирования ГОН, которая была достигнута длительной компенсацией уровня ВГД и достижением так называемого «давления цели» при своевременной диспансеризации, включающей своевременную смену схем местной гипотензивной терапии с целью профилактики нарушения толерантности. Четкое соблюдение режима терапии и достаточные знания об имеющемся заболевании свидетельствуют о высокой степени компетентности пациентки и хорошо налаженном контакте между ней и врачом. Большая часть препаратов, применяемых для снижения уровня ВГД при глаукоме, содержит консервант. Длительное применение таких капель приводит к росту индивидуальной непереносимости лекарственных препаратов у некоторых пациентов. Стоит отметить, что достижению высокого уровня приверженности лечению способствовала хорошая переносимость используемой пациенткой бесконсервантной ФК (тафлупрост 0,0015% + тимолола малеат 0,5%), обеспечившей достаточный гипотензивный эффект на протяжении длительного промежутка времени.
Сведения об авторах:
1Диордийчук Светлана Владимировна — врач-офтальмолог консультативного отделения, ORCID iD 0000-0002-0668-8171;
1,2Куроедов Александр Владимирович — д.м.н., профессор кафедры офтальмологии, начальник офтальмологического отделения, ORCID iD 0000-0001-9606-0566;
1,2Фомин Николай Евгеньевич — врач-офтальмолог консультативного отдела, ассистент кафедры офтальмологии, ORCID iD 0000-0001-9516-7396;
1,2Гапонько Олеся Владимировна — к.м.н., врач-офтальмолог офтальмологического отделения, ассистент
кафедры офтальмологии, ORCID iD 0000-0001-5893-7371;
1Городничий Виталий Владимирович — врач-офтальмолог офтальмологического отделения, ORCID iD 0000-0002-7276-5753;
1Кондракова Ирина Владимировна — врач-офтальмолог консультативного отдела, ORCID ID 0000-0002-8394-0094;
1Сольнов Николай Михайлович — к.м.н., врач-офтальмолог, ORCID iD 0000-0003-3970-039X.
1ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России. 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А.
2ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Фомин Николай Евгеньевич, e-mail: nikolay.fomin2608@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.06.2020.
About the authors:
1Svetlana V. Diordiychuk — ophthalmologist of the Consultative Department, ORCID iD 0000-0002-0668-8171;
1,2Aleksandr V. Kuroyedov — Doct. of Sci. (Med.), Professor of the Department of Ophthalmology, Head of the Division of Ophthalmology, ORCID iD 0000-0001-9606-0566;
1,2Nikolay E. Fomin — ophthalmologist of the Consultative Department, assistant of the Department of Ophthalmology, ORCID iD 0000-0001-9516-7396;
1,2Olesya V. Gapon’ko — Cand. of Sci. (Med.), ophthalmologist of the Division of Ophthalmology, assistant of the Department of Ophthalmology, ORCID iD 0000-0001-5893-7371;
1Vitaliy V. Gorodnichiy — ophthalmologist of the Division of Ophthalmology, ORCID iD 0000-0002-7276-5753;
1Irina V. Kondrakova — ophthalmologist of the Consultative Department, ORCID ID 0000–0002–8394–0094;
1Nikolay M. Sol’nov — Cand. of Sci. (Med.), ophthalmologist, ORCID iD 0000-0003-3970-039X.
1P.V. Mandryka Military Clinical Hospital. 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation.
2Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117437, Russian Federation.
Contact information: Nikolay E. Fomin, e-mail: nikolay.fomin2608@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.06.2020.
.
материал rmj.ru

