
Содержание статьи
- 1 Введение
- 2 Биологические роли магния и реакция организма на стресс
- 3 Магний в контексте патофизиологии COVID-19
- 4 Магний-зависимые белки защиты от РНК-вирусов
- 5 Недостаточность магния и хронические стресс-зависимые коморбидные патологии
- 6 О подходах к фармакотерапии COVID-19 и потерях магния
- 7 Заключение
Введение
Объявление в Китае эпидемической ситуации, связанной с распространением COVID-19, 20 января 2020 года имело психологические последствия. Пандемия COVID-19 стимулировала широкий спектр психологических и психиатрических проблем среди широких слоев населения (беспокойство, депрессия, панические расстройства и др.) [1, 2]. Например, при психологическом тестировании 285 жителей Уханя и соседних городов Китая наиболее пострадавших во время вспышки коронавируса, через месяц после начала вспышки COVID-19 установлен более высокий показатель посттравматического стресса (негативное настроение, перевозбуждение, плохое качество сна, снижение длительности ночного сна и т.д.), особенно среди женщин. В целом, почти каждый десятый человек в некоторых регионах Китая пострадал от посттравматического стресса [3].
Среди медицинских работников 34 госпиталей КНР, в которых лечились пациенты с COVID-19, были широко распространены симптомы депрессии (50.4%), беспокойства (44.6%), расстройства сна (34.0%), на фоне высокого уровня стресса и перегрузок (71.5%) [4]. Мета-анализ 38 исследований среди медицинских работников, работавших с пациентами инфицированными COVID-19, показал, что как острый, так и посттравматический психологический стресс был выше у медицинского персонала находившегося в прямом контакте с пациентами, заболевшими COVID-19 (отношение шансов (ОШ) 1,71, 95% доверительный интервал (ДИ) 1,28-2,29) [5].
Анализ сообщений в социальных сетях на платформе Weibo в Китае методами искусственного интеллекта указал возрастание беспокойства, депрессивных настроений, негодования, падение позитивных эмоций и удовлетворенности жизнью. Такие изменения указывают на необходимость заблаговременной профилактики соответствующих эмоциональных и психических расстройств [6]. В настоящее время, КНР повсеместно применяет меры противодействия психологическому кризису у населения [7].
Действительно, длительная «добровольно-обязательная» самоизоляция (уже не говоря о строгом карантине) отнюдь не способствуют повышению оптимистического настроения. Как известно, воспроизведение модели «иммобилизационного стресса» в экспериментальной фармакологии приводит к комплексу негативных изменений: возрастанию уровней катехоламинов, нарушениям гемодинамики, формированию язвенной болезни желудка и др. Поскольку карантинные меры носят исключительно массовый характер, у некоторых людей могут обостряться упоминаемые выше нежелательные психологические явления. При этом важно понимать абсолютную неприемлемость использования «тяжелой» психофармакологии (антидепрессанты, седативные средства) в масштабах населения целой страны.
Стрессовый новостной фон, связанный с пандемией коронавируса и с экономическими проблемами, безработицей, вынужденной самоизоляцией, ломкой стереотипов поведения, информацией об отсутствии лекарственных средств, способных противостоять распространению вируса, постоянное нагнетание коронавирусной истерии через СМИ способствуют формированию стресса и тревожности. Уже с начала февраля 2020 г отмечен неуклонный рост потребления безрецептурных снотворных и седативных средств (+37.5% по отношению к аналогичному периоду 2019 г). Эпидемия спровоцировала рост продаж легких противотревожных средств типа препаратов валерианы, пустырника и антидепрессантов (амитриптилин, трициклических антидепрессантов и других). С середины февраля продажи антидепрессантов в России показывают стабильный прирост [8].
Гораздо более правильным представляется использование «мягкой силы», т.е. восполнения дефицитов тех микронутриентов, которые повышают стрессоустойчивость организма. Например, цинк активирует системы противовирусной защиты организма [9]. Органические соли лития характеризуются нормотимическими свойствами [10, 11]. Магний повышает резервы адаптации организма, способствуя снижению стресса, активации белков противовирусной защиты и снижению хронического воспаления [12].
В настоящей работе рассмотрены антистрессорные эффекты магния. Представлены результаты анализа патофизиологии COVID-19, показывающие, что магний не только способствует снижению стресса, но и поддерживает противовирусный иммунитет, необходим для компенсации хронического и острого воспаления, провоцирующего т.н. «цитокиновый шторм». Дотации магния необходимы для предотвращения потерь магния, возникающих в результате приёма противовирусных препаратов и антибиотиков.
Биологические роли магния и реакция организма на стресс
Слова «стресс» и «адаптация» прочно вошли в повседневный лексикон. Однако, следует помнить, под стрессом могут пониматься, по меньшей мере, два феномена [1] «стресс-реакция», т.е. физиологическая реакция организма на внешний раздражитель, включающая резкое повышение выработки адреналина и других катехоламинов (в 10-100 раз) и глюкокортикоидов, активацию симпатического отдела вегетативной нервной системы (повышение частоты сердечных сокращений, артериального давления) и [2] «стрессор», т.е. сам внешний раздражитель, вызывающий стресс реакцию организма – страх, высокая или низкая внешняя температура, гиподинамия, воздействие вирусов и др. [12].
Способность адекватно реагировать на стресс, заключающаяся в адаптации организма к окружающей среде, относится к наиболее важным свойствам организма. Стресс-адаптация зависит от сложных взаимодействий между эндокринной и нервными системами. Поэтому, нарушения баланса гормонов и нейротрансмиттеров, обусловленные теми или иными факторами, неизбежно приведут к снижению адаптационного резерва организма.
Магний является одним из важнейших адаптогенных факторов. Хотя количество связанного белками магния не превышает 0,1% от общего количества магния в организме, магний является кофактором 720 различных белков протеома человека. Дефицит магния, приводит к частичной потере функции магний-связывающих белков, задействованных в таких процессах, как поддержание энергетических и пластических процессов, синтез АТФ[1]; обмен электролитов и поддержание электрического равновесия клетки [2]; окисление жирных кислот, метаболизм простагландинов [3]; процессы возбуждения/торможения в ЦНС, обмен катехоламинов и других нейротрансмиттеров [4].
Следует отметить, что отклонения в функционировании нервной системы являются одним из ранних признаков недостаточности магния. Дефицит магния в нервной и мышечной ткани приводит к гиперакузии, парестезиям, непроизвольным вздрагиваниям, спазму пищевода и ощущению «кома в горле», судорогам, зябкости, головным болям, усталости, беспокойству и страху (или, наоборот, к апатии и депрессии). Это обусловлено тем, что магний является физиологическим регулятором возбудимости нервных клеток. При недостатке магния клетка становится сверхвозбудимой вследствие нарушений функции, по крайней мере, трёх типов белков: NMDA-рецепторов, катехол-О-метилтрансферазы и аденилат циклаз (Рис. 1).
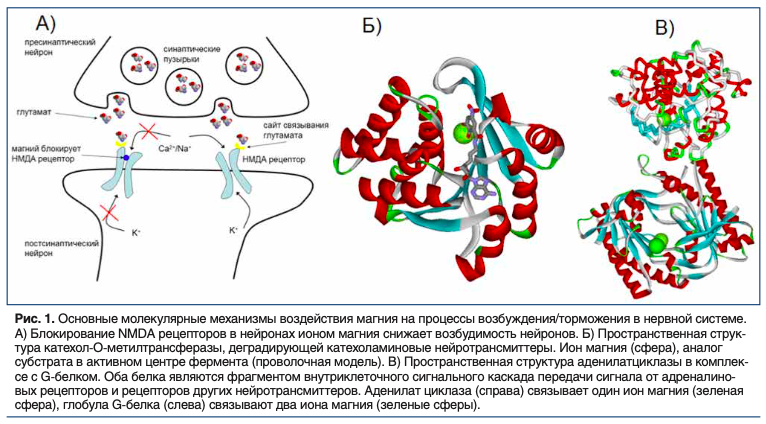
Наиболее известным молекулярным механизмом влияния магния на возбудимость нейронов является ингибирование активности NMDA-рецепторов (глутаматных рецепторов). Активация NMDA рецепторов необходима для быстрой синаптической передачи сигнала в головном мозге, которая происходит в результате изменения потока натрия/калия через мембрану. Чрезмерная стимуляция NMDA рецепторов может ухудшает реакцию на стресс и приводить к судорогам, в то время как блокирование NMDA рецепторов магнием снижает возбудимость нервных путей (рис. 1A).
NMDA рецепторы надпочечников вовлечены в реагирование на стресс и, в частности, в секрецию катехоламинов. Вызываемое стрессом подавление активности нейронов может быть предотвращено путем ингибирования NMDA рецепторов их антагонистами. Ингибирование NMDA рецепторов магнием приводит к уменьшению нервной возбудимости практически всех отделов головного мозга, что способствует снижению острой реакции на стресс и нормализации цикла сон-бодрствование [12].
Состояние и острого, и хронического стресса сопровождается повышенными катехоламиновыми влияниями, тесно взаимосвязанными с недостаточностью магния. В стрессовой ситуации увеличивается выброс норадреналина и адреналина, способствующих выведению магния из клеток. Насыщенная магнием моча образуется после острых переживаний, состояния страха, волнения (экзамен, соревнование, жизнь в условиях карантина). Недостаточность магния усугубляет нарушения баланса катехоламинов за счет снижения активности катехол-О-метилтрансферазы (КОМТ), в которой ион магния образует часть активного центра (Рис. 1Б). Поэтому, при недостаточности магния уровни катехоламинов и их метаболитов в крови будут возрастать, что приводит к неадекватной реакции на стресс. Повышение концентрации катехоламинов соответствует усилению стресса и повышению артериального давления (АД).
Действительно, дефицит магния приводит к повышению АД, одного из клинических признаков стресса. Регулярные дотации магния тормозят подъём АД в условиях стресса и альдостерон-стимулирующий эффект ангиотензина II. И наоборот, недостаточность магния усиливает спастическую реакцию сосудов на ангиотензин. Мета-анализ подтвердил дозо-зависимый эффект уменьшения артериального давления при терапии магниевыми препаратами [13]. Дотации магния способствуют значительному уменьшению как систолического, так и диастолического АД [14].
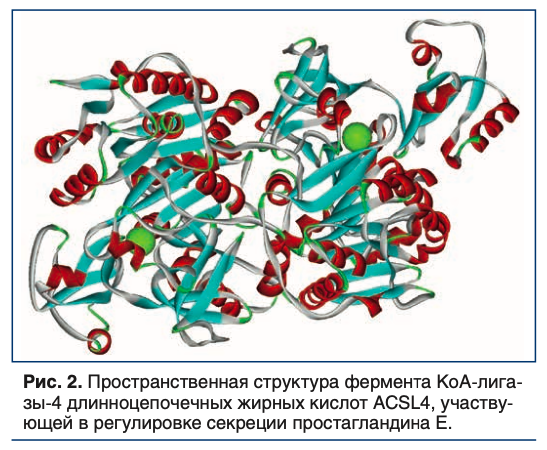
Магний модулирует простагландиновый метаболизм, состояние которого также важно для адекватной реакции на стресс. В частности, магний-зависимый фермент КоА-лигаза-4 длинноцепочечных жирных кислот (ACSL4) модулирует секрецию простагландина Е и инсулина [15] (Рис. 2).
Магний-зависимые аденилатциклазы активируются или тормозятся G-белками которые, в сочетании с мембранными рецепторами, обеспечивают реакцию клетки на гормональные и другие стимулы (в частности, на катехоламины). Ферменты аденилатциклаз катализируют превращение аденозинмонофосфата (АМФ) в циклический AMP (цАМФ). Магний принципиально необходим для каталитического действия всех известных аденилатциклаз [12].
Поэтому, недостаточность магния будет приводить к систематическому снижению активности аденилатциклаз всех типов. Снижение активности ADCY1 и ADCY8 негативно повлияет на функционирование памяти (амнезия — один из симптомов острого стресса). Пониженная активность ADCY2, ADCY3 и ADCY4 приведет к «притуплению» обонятельных реакций, в т.ч. при стрессе. Снижение активности аденилатциклазной системы отмечается на фоне депрессии [16].
С точки зрения влияния на стресс следует выделить активность аденилатциклазы ADCY9, влияющей на передачу сигнала от β-адрено-рецепторов (ADCY9), и аденилатциклазы ADCY5, опосредующей эффекты опиоидных рецепторов. Снижение активности ADCY9 при недостаточности магния приведет к снижению отклика клеток различных типов на катехоламины и к повышению секреции катехоламинов надпочечниками. Снижение активности ADCY5 вследствие недостаточности магния будет блокировать эффекты эндогенных опиоидов, приводя к обострению болевых реакций, гиперчувствительности, раздражительности.
Клинико-эпидемиологические исследования показали, что степень обеспеченности организма магнием ассоциирована с тяжестью протекания стресс-зависимых психических расстройств. Например, в крупномасштабном кросс-секционном исследовании, проведенном в Иране (n=3172, возраст 18-55 лет), более высокое потребление магния с пищей было связано с более низким риском тревожного расстройства (ОШ 0.61, 95% ДИ 0.41-0.90) [17].
Недостаточность магния усиливает нейротоксические свойства свинца, при накоплении которого обостряется реакция на стресс, формируется агрессивный тип поведения. Например, хроническая интоксикация свинцом у рабочих свинцового производства сопровождается гипомагнемией и развитием специфической симптоматики хронического стрессового состояния (неустойчивое эмоциональное состояние, эпизоды крайней раздражительности, вспышки гнева, которые чередуются с астенией и усталостью). Гипомагнеземия способствует усилению этих негативных проявлений интоксикации свинцом [18].
Таким образом, стресс способствует формированию недостаточности магния. И наоборот, недостаточность магния усиливает неадекватную реакцию организма на стресс. Широкая распространенность недостаточности магния в России (не менее 50% россиян) [12] и в других регионах (70-80% населения в странах ЕС [19, 20]) указывает на необходимость восполнения недостаточности магния, что важно для повышения адаптации. Однако, магний необходим не только для формирования адекватной реакции организма на стресс, но и для противодействия различным патофизиологическим процессам при COVID-19.
Магний в контексте патофизиологии COVID-19
Коронавирусная инфекция COVID-19, несмотря на высокую контагиозность, может течь относительно легко или даже без симптомов. Опасность этой коронавирусной инфекции в том, что у пациентов с нарушениями иммунитета COVID-19 приводит к тяжёлой пневмонии и к острой дыхательной недостаточности. Выявление групп риска с потенциально тяжёлым течением заболевания и снижение соответствующих рисков являются актуальнейшими задачами профилактики и терапии COVID-19.
Мы осуществили систематический компьютерный анализ всего массива публикаций имеющейся научной литературы по коронавирусам (20600 публикаций в базе данных биомедицинских публикаций PUBMED, в т.ч. 6500 публикаций по COVID-19 и SARS-CoV-2). Анализ был проведен с использованием современных методов анализа больших данных, развиваемых в рамках топологического [21, 22] и метрического подходов к задачам распознавания/классификации [23, 24]. В результате анализа литературы были выделены 49 наиболее информативных рубрик, достоверно отличавших публикации по COVID-19 от публикаций по всем остальным коронавирусам (Рис. 3).
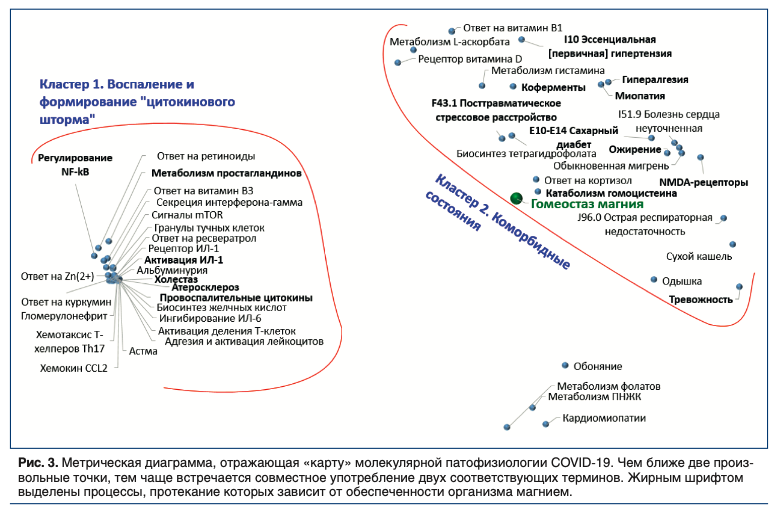
Анализ полученной «карты» молекулярной патофизиологии COVID-19 показал, что наиболее информативные биомедицинские термины, достоверно чаще встречающиеся в публикациях по COVID-19, сгруппированы в Кластер 1 «Воспаление и формирование цитокинового шторма» и в Кластер 2 «Коморбидные состояния». Точка, соответствующая гомеостазу магния и его нарушениям, находится на границе Кластера 2 на Рис. 3.
Цитокиновый шторм, т.е. лавинообразное нарастание концентраций провоспалительных цитокинов, является опасным осложнением COVID-19, приводящим к необходимости применения искусственной вентиляции лёгких (ИВЛ). Если у пациента имеется любой очаг хронического воспаления (при таких заболеваниях, как атеросклероз, ожирение, сахарный диабет, гломерулонефрит и др.) стимулируется более быстрое усиление синтеза провоспалительных цитокинов интерлейкина (ИЛ)-1, CCL2, ИЛ-6, интерферона-гамма и других. Интерлейкины повышают активацию лейкоцитов и распад гранул тучных клеток. Эти процессы обостряются на фоне дефицита определенных микронутриентов (цинк, магний, витамины В1, РР, С).
Коморбидные состояния ассоциированы с хроническим воспалением существенно утяжеляют течение COVID-19. Риск более тяжелого течения COVID-19 ассоциирован с наличием у пациента ожирения, артериальной гипертонии, ишемической болезни сердца, сахарного диабета, кардиомиопатии и др. Снижение избыточного хронического воспаления связано с повышением обеспеченности магнием и другими микронутриентами (витамин D, цинк, фолаты, витамин B1, омега-3 ПНЖК, витамин С).
На Рис. 3 представлены результаты анализа публикаций по COVID-19. К настоящему времени, эти результаты достаточно ограничены и не представляют всего спектра ролей магния в противодействии патофизиологии инфекции. В частности, в имеющихся публикациях недостаточно полно описаны роли врожденного противовирусного иммунитета. Такая информация может быть получена посредством системно-биологического анализа белков протеома человека.
Магний-зависимые белки защиты от РНК-вирусов
Оптимальный статус питания является важным фактором защиты от вирусных инфекций. Роль питания в поддержке иммунной системы хорошо известна. Микроэлементы магний, цинк, медь, витамины А, D, Е, С, витамины группы В и омега-3 ПНЖК играют важную и взаимодополняющую роль в поддержке иммунной системы. Недостаточное потребление этих микронутриентов широко распространено, что способствует снижению противовирусного и антибактериального иммунитета [25].
Протеомный анализ позволяет выявить детальные молекулярные механизмы участия магния и других микронутриентов в противовирусной защите организма. В протеоме человека содержится более 35000 белков, из которых 19820 были аннотированы (т.е. для которых известны выполняемые ими биологические роли). Методом анализа функциональных взаимосвязей [26] мы выделили 820 белков, вовлеченных в защиту организма против вирусов, из которых 178 имели те или иные нутриентные кофакторы (цинк, магний, производные витаминов и др.). При этом, 8 из 178 белков являлись магний-зависимыми белками, вовлеченными в защиту от одноцепочечных РНК вирусов, в т.ч от SARS-CoV-2.
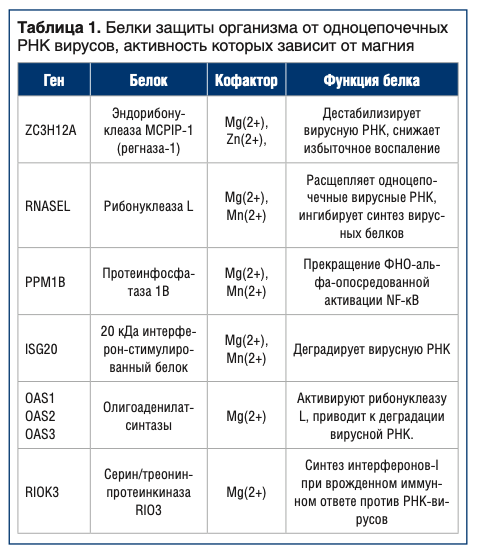
Магний-зависимые 2′-5′-олигоаденилатсинтазы (OAS1, OAS2, OAS3, см. Рис. 4) являются интерферон-индуцируемыми ферментами врожденного иммунного ответа против РНК-вирусов. Ферменты OAS1-3 синтезируют олигомеры 2′-5′-олигоаденилатов из АТФ, которые затем связываются с неактивной мономерной формой рибонуклеазы L, что приводит к ее димеризации и активации. Активация магний-зависимой рибонуклеазы L приводит к деградации как клеточной, так и вирусной РНК. Известны эффекты фермента OAS1-3 против вирусов, вызывающих стоматит, простой герпес, энцефалит и миокардит [27], а также вирусов чикунгунья (CHIKV), денге, синдбис (SINV) [28], вируса гриппа А [29].
Магний/марганец-зависимая рибонуклеаза L (RNASEL) — основная эндорибонуклеаза интерферонового противовирусного ответа, которая расщепляет одноцепочечные вирусные РНК. Расщепление молекулы РНК вирусов делает невозможным синтез вирусных белков, способствует индукции других генов противовирусной защиты и ускоряет апопотоз инфицированных вирусом клеток [30]. Магний/марганец-зависимый интерферон-стимулированный белок ISG20 также является противовирусной рибонуклеазой, которая разрушает одноцепочечные РНК различных вирусов (HCV, HAV и др.) [31, 32].
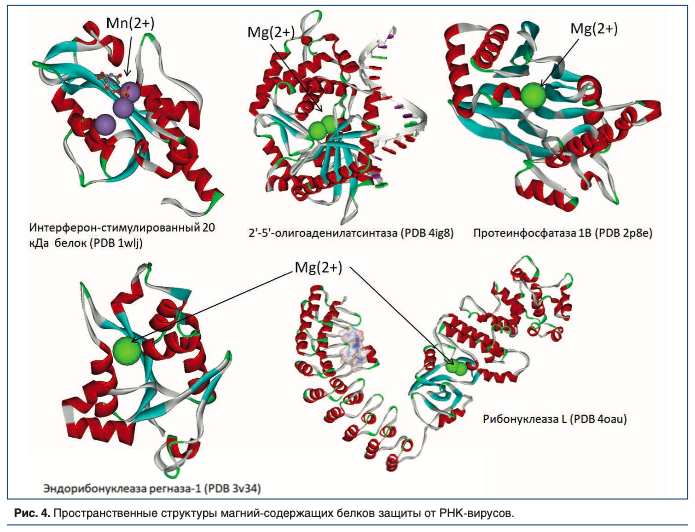
Магний-зависимые белки выполняют и другие роли, важные для противовирусной защиты. Протеинфосфатаза 1B (ген PPM1B) необходима для прекращения ФНО-альфа-опосредованной активации NF-кB посредством инактивации киназы IKKB [33] (что важно для торможения цитокинового шторма). Серин/треонин-протеинкиназа RIO3 является адаптером белка-активатора TBK1 к регуляторному фактору-3 интерферона, который необходим для синтеза интерферонов I-го типа при врожденном иммунном ответе против ДНК- и РНК-вирусов [34]. Протеинкиназа RIO3 также ингибирует CASP10-опосредованную активацию сигнального пути NF-kB [35].
Недостаточность магния и хронические стресс-зависимые коморбидные патологии
Коморбидные патологии или т.н. «болезни цивилизации» являются следствием хронического стресса, гиподинамии, потребления неполноценных продуктов питания, приверженности вредным привычкам (курение и алкоголь), влиянию на здоровье загрязнения окружающей среды и дефицитов многих микронутриентов, в т.ч. магния. Недостаточность магния является ядром ряда «болезней цивилизации» [12] (сахарный диабет 2-го типа, ожирение, атеросклероз, артериальная гипертония, тромбоэмболия, астма, псориаз и др.), многие из которых существенно отягощают клиническую картину COVID-19.
Наличие у пациента нескольких хронических коморбидных патологий является патофизиологическим объяснением более тяжелого течения COVID-19 у пожилых пациентов. Например, в многоцентровом китайском исследовании (n=280) доля пациентов старше 65 лет достоверно выше среди тяжелых случаев (59%), чем в случае пациентов с лёгким течением инфекции (10.2%, P <0.05). При этом, 85.5% пациентов с тяжелым течением COVID-19 имели сахарный диабет или стенокардию, которые встречались в 7-10 раз чаще (P=0.042), чем у пациентов с лёгкой формой COVID-19 [36].
Анализ когорты пациентов (n=1590) из 575 госпиталей КНР с лабораторно-подтвержденным SARS-CoV-2 показал, что 25% пациентов имели, по крайней мере, одну коморбидную патологию (гипертонию — 16.9% пациентов или сахарный диабет 2 типа- 8.2%). Риск при наличии одного коморбидного состояния повышался в 1.8 раза (ОР 1.79 95% ДИ 1.16-2.77), при наличии двух и более – в 2.6 раза (ОР 2.59 95% ДИ 1.61-4.17) [37].
Мета-анализ 8 клинических исследований пациентов с COVID-19 (n=46248) подтвердил, что наиболее распространенными коморбидными состояниями были АГ (17%), сахарный диабет 2 типа (8%), ишемическая болезнь сердца (ИБС) (5%), заболевания лёгких и/или бронхов. Коморбидные состояния соответствовали увеличению риска тяжелого течения инфекции COVID-19: АГ – в 2.4 раза (95% ДИ 1.5-3.8), респираторные – в 2.5 раза (95% ДИ 1.8-3.4), ИБС – в 3.4 раза (95% ДИ 1.88-6.22) [38].
Особенно наглядно взаимодействие между коморбидными состояниями и недостаточностью магния были продемонстрированы в результате проведения крупномасштабного многоцентрового скрининга, в котором приняло участие более 2400 пациентов из медицинских учреждений 8 регионов центральной России [12].Установлены достоверные взаимосвязи между сниженными уровнями магния в плазме крови (менее 0.80 ммоль/л) и в эритроцитах (менее 1.65 ммоль/л) с повышенным риском диагнозов E66.3 «Избыточный вес», E11.7 «Инсулин-независимый сахарный диабет», I10 «Эссенциальная первичная гипертония», I63.0 «Ишемический инфаркт мозга», I20.0 «Нестабильная стенокардия», F43.0 «Острая реакция на стресс», R56.8 «Судороги» и др. [39].
Проведенный скрининг указал на очень высокую степень распространения коморбидных состояний в обследованной когорте россиян. В исследованной выборке участников, на каждого пациента приходилось, в среднем, 1.9±1.3 коморбидных диагноза. Пациенты, имевшие 2 и более диагнозов, составили большинство — 1251 (51%). Важно отметить, что число диагнозов по МКБ-10, отражающее степень проявления коморбидности, показало достоверную корреляцию с уровнями магния в плазме крови и в эритроцитах. Даже при наличии единственного диагноза, уровни магния были значительно снижены (плазма, 0.86±0.19 ммоль/л, эритроциты — 1.74±0.57 ммоль/л). При наличии двух и более диагнозов, средние уровни магния в плазме были ниже 0.8 ммоль/л [39].
О подходах к фармакотерапии COVID-19 и потерях магния
В настоящее время, активно разрабатываются практически приемлемые схемы терапии коронавирусной инфекции. К сожалению, большинство из препаратов, предлагаемых для терапии COVID-19, отличаются высокой токсичностью (например, известные противовирусные препараты лопинавир, ритонавир, сакинавир, используемые в терапии СПИДа [40]). Кроме того, в многоцентровом исследовании лопинавир и ритонавир не давали никаких преимуществ в лечении COVID-19 [41]. Эффекты этих препаратов на гомеостаз магния практически не изучены, но их структурные формулы позволяют предположить существенные потери магния с мочой при их использовании.
Лечение кортикостероидами при COVID-19 может парадоксальным образом спровоцировать выброс цитокинов и формирование «цитокинового шторма», что является одной из причин возникновения повреждения лёгких и острого респираторного дистресс-синдрома [42]. Кроме того, кортикостероиды существенно ослабляют барьерную функцию лёгких и способствуют колонизации лёгких патогенной грибковой флорой Candida albicans, Candida glabrata и др. В одном из исследований было показано, что использование на поздних стадиях поражения легких при COVID-19 высоких доз корстикостероидов было ассоциировано с повышенным риском летального исхода [43]. Кортикостероиды способствуют усиленному выведению магния [12].
Изучалась роль противомалярийных препаратов хлорохина, гидроксихлорохина и др. против вируса SARS-CoV-2 in vitro, в одном из исследований было показано, что данные препараты могут снизить время пребывания пациентов с COVID-19 в стационаре [44]. Тем не менее, использование этих антималярийных лекарств ограничено токсичностью таких препаратов и необходимостью подбора индивидуальных дозировок [45]. Данные противомалярийные препараты способствуют усилению потерь магния с мочой [46].
Другие фармакологические препараты, которые могут быть использованы при лечении COVID-19, также стимулируют развитие гипомагнеземии. Например, при отеке лёгких могут быть назначены диуретики. Гипомагнеземия возникает при использовании практически всех видов диуретиков, в т.ч. калий-сберегающих [47]. Антибиотики, которые могут быть назначены при пневмонии (фторхинолоны, аминогликозиды, макролиды, амфотерицины, сульфаниламиды и др.) приводят к быстрому развитию гипомагнеземии (в течение 24 часов) [48]. Некоторые из препаратов, назначаемых пациентам с хроническими коморбидными патологиями (диуретики, ингибиторы АПФ, ингибиторы протонной помпы, противоопухолевые препараты) также способствуют усиленным потерям магния с мочой.
Развивающиеся при употреблении перечисленных препаратов потери магния повышают риск развития артериальной гипертонии, судорог, аритмий и других описанных выше коморбидных состояний, которые утяжеляют течение COVID-19. Выведение магния из организма способствует формированию синдрома удлинённого интервала QT, что повышает риск эпизодов смертельно опасной аритмии типа «пируэт» [12].
Следует подчеркнуть, что при стрессе многие пациенты начинают использовать синтетические антидепрессанты. При этом, у 20-30% пациентов отмечается резистентность к антидепрессантам. Одной из основных причин формирования этой резистентности является гипомагнеземия. Например, в модели пост-стрессорной депрессии, устойчивой к трициклическим антидепрессантам, восполнение магния восстанавливало чувствительность к антидепрессантам [49].
Заключение
Для борьбы со стрессом в условиях пандемии COVID-19 важно не только адекватное поведение, чёткое соблюдение жизненно-важных инструкций, общение с позитивными людьми, но и адекватная компенсация дефицитов микронутриентов. Недостаточность магния является одним из лидирующих микронутриентных дефицитов, особенно у пациентов в состоянии стресса. Восполнение недостаточности магния необходимо для активации белков противовирусной защиты от SARS-CoV-2 и от других одноцепочечных РНК-вирусов, это тормозит развитие хронического и острого воспаления, предотвращает потери магния, вызванные приемом противовирусных препаратов и антибиотиков. Поэтому, регулярный приём магния в период пандемии COVID-19 создает условия для более лёгкого течения заболевания.
Наилучшим способом компенсации недостаточности магния является приём водных растворов цитрата магния в сочетании с рибофлавином и с другими витаминами группы В. Для приготовления раствора для питья подходит препарат Магний Диаспорал 300, содержащий синергидную композицию (300 мг элементного магния в форме цитрата магния и 2 мг рибофлавина в одном саше). Как известно, цитрат магния – одна из наиболее растворимых в воде солей магния с высокой биодоступностью магния [12]. Цитрат магния и его синергист рибофлавин не только являются эффективными транспортёрами иона магния внутрь клеток, но и способствуют поддержке энергетического метаболизма и других адаптационных ресурсов в условиях стресса.
Информация об авторах:
Громова Ольга Алексеевна – д-р мед. наук, проф., в.н.с., научный руководитель Института Фармакоинформатики, ФИЦ «Информатика и Управление» РАН, Адрес: 119333, Москва, ул. Вавилова, 42, Телефон: +7(916) 108-09-03 e-mail: unesco.gromova@gmail.com, сайт: pharmacoinformatics.ru; http://bigdata-mining.ru, Научный сотрудник Центра хранения и анализа больших данных, МГУ, Россия, РИНЦ SPIN-код: 6317-9833, AuthorID: 94901, Scopus Author ID: 7003589812, ORCID iDhttps://orcid.org/0000-0002-7663-710X, WOS ID J-4946-2017
Торшин Иван Юрьевич, к.х.н., с.н.с. Институт Фармакоинформатики, ФИЦ «Информатика и Управление» РАН, Адрес: 119333, Москва, ул. Вавилова, 42, Телефон: (499) 135-2489 Scopus Author ID: 7003300274, РИНЦ SPIN-код: 1375-1114, AuthorID: 54104, ORCID iD 0000-0002-2659-7998, WOS ID C-7683-2018, Scopus AuthorID : 7003300274, https://www.scopus.com/authid/detail.uri?authorId=7003300274
Калачева Алла Геннадьевна к.м.н., доцент кафедры фармакологии ФГБОУ ВО ИвГМА Минздрава РФ, Адрес: 153000, Иваново, Шереметевский пр., 8, Телефон: (4932) 41-65-25. Ivanovo, Sheremetevskyi pr. 8, Tel. (84932) 30-1766 ORCID https://orcid.org/0000-0001-6144-5781
Электронное периодическое издание rmj.ru («РМЖ.ру»), июль 2020
.
Информация с rmj.ru







