Ключевые слова: неалкогольная жировая болезнь печени, стетогепатит, средиземноморская диета, полиненасыщенные жирные кислоты, эссенциальные фосфолипиды.
Для цитирования: Вовк Е.И. Неалкогольная жировая болезнь печени как проатерогенное заболевание: диагностика и лечение в общей практике // РМЖ. Медицинское обозрение. 2017. №2. С. 68-79
Vovk E.I.
Moscow State Medical Stomatological University named after А.I. Evdokimov
Non-alcoholic fatty liver disease (NAFLD) is an interdisciplinary problem of gastroenterology, therapy and endocrinology. NAFLD is an etiologically heterogeneous disease characterized by excessive accumulation of neutral fat — triglycerides and free fatty acids both inside the hepatocytes and extracellularly with progressive aseptic inflammation and subsequent fibrogenesis. Meanwhile, knowledge of therapists and endocrinologists about this disease as a predictor of cardiovascular pathology and type 2 diabetes, as well as associated mortality, is completely insufficient for early diagnosis and organization of comprehensive treatment of non-alcoholic fatty liver disease. The purpose of this publication is to discuss the problem of non-alcoholic fatty liver disease in the framework of the GP and therapist of the polyclinic. The article highlights the proven mechanisms of the development of the disease and its progression, depending on the phenotypic factors. Modern recommendations on personalized modification of nutrition, lifestyle and pathogenetic therapy for the normalization of lipid metabolism are given. For the first time the therapist is proposed the possible algorithms of interaction with the patient to achieve compliance with the modification of lifestyle.
Key words: non-alcoholic fatty liver disease, stetho-hepatitis, Mediterranean diet, polyunsaturated fatty acids, essential phospholipids.
For citation: Vovk E.I. Non-alcoholic fatty liver disease as pro-atherogenic disease: diagnosis and treatment in general practice // RMJ. MEDICAL REVIEW. 2017. № 2. P. 68–79.
Статья посвящена возможностям диагностики и лечения неалкогольной жировой болезни печени, как проатерогенного заболевания. Освещены механизмы развития заболевания и его прогрессирования в зависимости от фенотипических факторов. Даны рекомендации по персонифицированной модификации питания, образа жизни и терапии. Предложены алгоритмы взаимодействия с пациентом для достижения комплаентности в отношении модификации образа жизни.
Содержание статьи
Введение
Неалкогольная жировая болезнь печени (НАЖБП) стала самым распространенным хроническим заболеванием в индустриальных странах мира [1]. Согласно последним эпидемиологическим данным, в западных странах НАЖБП встречается у 20‒30% взрослого населения, а в Азии – в пределах 5‒18% [2].
Распространенность НАЖБП в мире:
• Встречается у 20‒33% взрослых и 10% детей, живущих в городах [3].
• Выявляется у 31–35% населения на Ближнем Востоке и в Южной Америке и у 19% взрослого населения в США [4].
• В России в 2007‒2008 гг. выявлена у 26% пациентов амбулаторной практики (DIREG 1). В 2013‒2014 гг., по данным исследования DIREG 2, распространенность у амбулаторных пациентов увеличилась до 37% [5].
• В России НАЖБП – самое распространенное (71,6%) из диффузных заболеваний печени [6].
НАЖБП – этиологически неоднородное заболевание, объединенное общим патоморфологическим феноменом: избыточным накоплением нейтрального жира – триглицеридов и свободных жирных кислот как внутри гепатоцитов, так и внеклеточно с прогрессирующим асептическим воспалением и последующим фиброгенезом (табл. 1) [7‒10]. ![Таблица 1. Этиология НАЖБП [7–10] Таблица 1. Этиология НАЖБП [7–10]](https://medblog.su/wp-content/uploads/2018/12/nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
При продолжительном воздействии этиологических факторов НАЖБП проходит последовательно развивающиеся клинико-морфологические формы:
• cтеатоз печени (Международная классификация болезней (МКБ) – К 76.0) – избыточное (более 5% от веса паренхимы) накопление триглицеридов в паренхиме печени. Согласно современным данным, выделяют изолированный стеатоз и стеатоз с начальным воспалением, при котором имеет место баллонная дистрофия гепатоцитов, но еще нет характерной для гепатита клеточной инфильтрации;
• неалкогольный стеатогепатит (НАСГ) (К 73.0) ‒ стеатоз с развитием хронического диффузного воспаления и некрозом, воспалительной инфильтрацией паренхимы и началом формирования фиброза;
• фиброз I‒IV стадий / цирроз печени (К 74.6) ‒ фиброз печени на фоне стеатоза и хронического некротического воспаления в паренхиме [8, 11‒14].
Эпидемиология НАЖБП
В зависимости от этиологии и возраста НАСГ встречается у 5–8% взрослого населения или у 12‒40% пациентов с НАЖБП. В США частота встречаемости НАЖБП у людей среднего возраста достигает 46%, из них НАСГ диагностируют у 30% пациентов, чаще – у испаноговорящего населения. У 15–20% пациентов с НАСГ развивается фиброз печени различной тяжести, который существенно увеличивает риск гепатоцеллюлярного рака печени, ‒ до 15% всех случаев рака печени выявляют у пациентов с НАЖБП [6‒8] (рис. 1). ![Рис. 1. Соотношение клинико-морфологических форм НАЖБП (модифицировано по L.S. Bhatia et al., 2012 [7]) Рис. 1. Соотношение клинико-морфологических форм НАЖБП (модифицировано по L.S. Bhatia et al., 2012 [7])](https://medblog.su/wp-content/uploads/2018/12/1544975104_838_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Эволюция научных знаний в течение последних 30 лет привела к пониманию того, что наиболее распространенным и социально значимым заболеванием является НАЖБП, ассоциированная с ожирением. Частота встречаемости НАЖБП при ожирении достигает 75‒95% [15]. Однако фоновым заболеванием для НАЖБП становится только метаболически неблагоприятное ожирение с висцеральным отложением жира и развитием инсулинорезистентности. Клиническим отражением такого ожирения служит метаболический синдром (МС) с кардиометаболическими последствиями и практически неизбежным развитием сахарного диабета (СД) 2-го типа при дальнейшем увеличении массы жировой ткани. Частота встречаемости НАЖБП при CД 2-го типа колеблется в пределах 50‒75%, а у пациентов c диабетом и ИМТ > 30 – 70–90% [3, 15]. При морбидном ожирении НАСГ диагностируют у 18‒26%, фиброз печени ‒ у 20–37%, а цирроз ‒ у 10% больных [4, 8, 11–15]. Среди пациентов с СД 2-го типа доля имеющих НАСГ составляет 56–69%, а фиброз печени формируется у 37–50% [3]. Доля НАСГ среди всех форм НАЖБП с каждым годом увеличивается [4]. По данным российских исследований, в 2007‒2008 гг. (DIREG 1) в амбулаторной практике около 80% случаев НАЖБП составлял стеатоз, 17% ‒ НАСГ, 3% – стеатофиброз/цирроз. В 2013‒2014 гг. (DIREG 2) одновременно с ростом общей распространенности НАЖБП частота стеатогепатита среди всех форм НАЖБП увеличилась до 24% (рис. 2) [5]. ![Рис. 2. Динамика частоты встречаемости и структура морфологических форм НАЖБП в России среди амбулаторных пациентов [5] Рис. 2. Динамика частоты встречаемости и структура морфологических форм НАЖБП в России среди амбулаторных пациентов [5]](https://medblog.su/wp-content/uploads/2018/12/1544975104_126_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Характерно, что стеатоз печени и НАСГ на фоне ожирения и СД 2-го типа чаще выявляются у относительно молодых пациентов и с увеличением возраста частота встречаемости НАЖБП снижается (рис. 3) [16]. ![Рис. 3. Частота встречаемости НАЖБП в зависимости от возраста [16] Рис. 3. Частота встречаемости НАЖБП в зависимости от возраста [16]](https://medblog.su/wp-content/uploads/2018/12/1544975104_495_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Ранее считалось, что НАЖБП в целом чаще развивается у мужчин [17]. К настоящему времени установлено, что НАЖБП формируется у мужчин в относительно раннем возрасте. Однако понимание демографических предикторов НАЖБП радикально изменилось, поскольку в абсолютном исчислении большинство пациентов с НАЖБП – женщины в менопаузе или более молодые женщины с синдромом поликистозных яичников или дисфункцией яичников другой этиологии. Так или иначе, дефицит эстрогенов и его метаболические последствия гендерно сближают пациентов с НАЖБП и в амбулаторной практике формируют целевую группу пациентов из женщин менопаузального возраста [18].
Среди других предикторов НАЖБП выделяют семейную предрасположенность к гипертонии, ожирению и нарушению липидного обмена. Установлено, что с высоким риском НАЖБП и риском гепатоцеллюлярного рака ассоциированы мутации генов PNPLA3-I148M и NCAN rs2228603 [19]. Однако доля наследственных случаев НАЖБП, по данным генетических исследований последних двух десятилетий, составляет около 10%, что закономерно требует внимания исследователей к фенотипическим механизмам развития заболевания, в частности к взаимодействию генома с окружающей средой, к расовым различиям, факторам, влияющим на развитие хронического воспаления [19].
Патогенез НАЖБП
В формировании НАСГ выделяют несколько основных патогенетических механизмов – так называемых ударов или толчков. При ожирении в роли «первого толчка» выступает первичное накопление свободных жирных кислот и триглицеридов в гепатоците. Печень становится местом накопления триглицеридов, которые синтезируются из алиментарных жирных кислот или углеводов – глюкозы и фруктозы [20]. При инсулинорезистентности и СД источником поступления в печень жирных кислот служит липолиз триглицеридов из жировой клетчатки [21]. При отсутствии ожирения в случае пищевой перегрузки готовыми или вновь синтезированными из углеводов жирными кислотами нейтральный жир накапливается в подкожной бурой жировой клетчатке как запасной энергоноситель (рис. 4) [21]. Эктопическое отложение жира (в печени, поджелудочной железе, миокарде и скелетных мышцах) происходит после перегрузки жировой ткани циркулирующими в крови триглицеридами. Иначе говоря, печень становится дополнительным местом складирования триглицеридов и, как бурая жировая ткань, – становится резервуаром энергетических субстратов – в гепатоцитах развивается микровезикулярный стеатоз [22]. ![Рис. 4. Источники накопления в печени триглицеридов при НАЖБП [21] Рис. 4. Источники накопления в печени триглицеридов при НАЖБП [21]](https://medblog.su/wp-content/uploads/2018/12/1544975104_748_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Само по себе избыточное накопление триглицеридов (как в жировой ткани, так и эктопическое) всегда сопровождается повреждением какой-то части гипертрофированных клеток (адипоцитов или гепатоцитов) – к ним мигрируют активированные макрофаги, которые в результате фагоцитоза выделяют цитокины и первично активируют иммунные реакции замедленного типа – развивается хроническое системное воспаление (рис. 5) [23]. Относительно выделяемых жировой тканью перилипинов особое значение для патогенеза НАЖБП имеют снижение секреции адипонектина и увеличение секреции лептина, что приводит к потере контроля над чувством насыщения. ![Рис. 5. Провоспалительная активность адипоцитов при НАЖБП (модифицировано по W.Wang et al., 2014 [23]) Рис. 5. Провоспалительная активность адипоцитов при НАЖБП (модифицировано по W.Wang et al., 2014 [23])](https://medblog.su/wp-content/uploads/2018/12/1544975104_817_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Перегруженная жиром ткань становится инсулинорезистентной, поскольку стремится ограничить дальнейший синтез триглицеридов – в гепатоцитах развивается макровезикулярный стеатоз, и жир начинает накапливаться внеклеточно. Инсулинорезистентность ‒ это снижение реакции на инсулин чувствительных к инсулину тканей при его достаточной концентрации. Фактически печень принимает на себя функции белой жировой ткани – синтезирует провоспалительные и прогипергликемические перилипины, что углубляет инсулинорезистентность (рис. 6). Сегодня известно, что инсулинорезистентность имеет полигенный характер. В ее развитии участвуют мутации генов субстрата инсулинового рецептора (СИР-1), гликогенсинтетазы, гормон-чувствительной липазы, β3-адренорецепторов, фактора некроза опухоли α, разобщающего протеина (UCP-1), а также молекулярные дефекты белков, передающих сигналы инсулина (увеличение экспрессии Rad-белка и UPC-1 ингибитора тирозинкиназы инсулинового рецептора в мышечной ткани, снижение мембранной концентрации и активности внутриклеточных транспортеров глюкозы GLUT-4 в мышечной ткани). Остается неясным вопрос: какие механизмы у каждого конкретного пациента на тканевом и системном уровне настраивают тот предел ожирения, при превышении которого развиваются инсулинорезистентность и, как следствие, гиперинсулинемия с дальнейшим набором веса и перспективой СД 2-го типа. Фактически достаточно много людей остаются «метаболически здоровыми» даже при тяжелом ожирении [24]. Инсулинорезистентность приводит к развитию компенсаторной гиперинсулинемии и одновременно переводит обмен веществ с окисления глюкозы на β-окисление жира. Не только в мышечной ткани, но и в печени и мозге свободные жирные кислоты конкурируют с глюкозой как основным энергетическим субстратом – этот путь получения энергии всегда сопряжен с развитием феномена липотоксичности. 
Липотоксичность – второй «толчок» в патогенезе НАЖБП и главная причина развития НАСГ. Развивается как следствие оксидативного стресса гепатоцитов при активации в них липолиза и напряженном синтезе жирных кислот, которые происходят в митохондриях и эндоплазматическом ретикулуме. Кроме того, липотоксичность приводит к появлению в гепатоцитах большого количества свободных перекисей, которые активно повреждают полиненасыщенные жирные кислоты (ПНЖК) фосфолипидов клеточных мембран: цитоплазматической мембраны клетки и, главное, мембран, из которых состоят сами митохондрии и эндоплазматический ретикулум [25‒27].
Разрушение ПНЖК фосфолипидов нарушает структуру, метаболическую активность и сигнальную функцию клеточных мембран. Перекиси также опасны для ДНК и РНК гепатоцитов. Липотоксичность запускает апоптоз гепатоцитов, приводит к НАСГ: в паренхиме печени на фоне жировой инфильтрации развиваются первичное хроническое воспаление и фиброз, формируется воспалительный статус плазмы [28]. Таким образом, НАСГ обладает внутренним потенциалом к прогрессированию и приводит к развитию более или менее выраженного фиброза печени у каждого пациента, находится в фокусе научных исследований [12, 13]. Однако в общей медицинской практике НАСГ рассматривается как мультисистемное заболевание в связи с его ролью в атерогенезе и формировании кардиометаболического континуума [29]. Действительно, в глобальном масштабе социально значимым при НАСГ является увеличение риска развития СД 2-го типа, сердечно-сосудистых заболеваний (ССЗ), хронической болезни почек, а также рака печени и толстой кишки [30]. НАСГ в 6‒10 раз увеличивает риск смерти от цирроза и рака печени, в 5 раз – от ССЗ, независимо от всех других сердечно-сосудистых рисков [3, 7].
G. Marchesini et al. в относительно ранней работе показали, что у пациентов без диабета и с гистологически верифицированной формой НАЖБП МС на 35% чаще встречается при НАСГ, чем при простом стеатозе печени (рис. 7). Авторы показали, что тяжесть НАСГ вне зависимости от пола, возраста и степени ожирения тесно коррелирует со степенью фиброза печени (OR 3,5; 95% CI 1,1‒11,2; P=0,032) и тяжестью МС, которую маркирует инсулинорезистентность (OR 3,2; 95% CI 1,2‒8,9; P=0,026) [31]. ![Рис. 7. Частота развития НАСГ при метаболическом синдроме (МС) (модифицировано по G. Marchesini et al., 2003 [31]) Рис. 7. Частота развития НАСГ при метаболическом синдроме (МС) (модифицировано по G. Marchesini et al., 2003 [31])](https://medblog.su/wp-content/uploads/2018/12/1544975105_630_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Механизм такого кардиометаболического влияния заключается в том, что прямо или опосредованно НАСГ приводит к накоплению в организме проатерогенного, токсичного для клеточных мембран и вызывающего ускоренный апоптоз клеток свободного холестерина (ХС) (рис. 8) [32]. ![Рис. 8. Нарушения метаболизма холестерина при НАСГ (модифицировано по H.K. Min et al., 2012 [32]) Рис. 8. Нарушения метаболизма холестерина при НАСГ (модифицировано по H.K. Min et al., 2012 [32])](https://medblog.su/wp-content/uploads/2018/12/1544975105_963_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
При ожирении первичное нарушение утилизации циркулирующего в организме ХС развивается вследствие уменьшения экспрессии скавендер-рецепторов к липопротеинам низкой плотности (ЛПНП) на наружной цитоплазматической мембране гепатоцитов, что стимулирует синтез ХС de novo, для чего используются уже накопленные и целенаправленно накапливаются дополнительные триглицериды, жирные кислоты и липопротеины очень низкой плотности (ЛПОНП) [33]. Таким образом, НАСГ является причиной формирования главного предиктора атерогенеза – дислипидемии: повышения титров и размера ЛПОНП, хиломикронов, циркулирующих ЛПНП, титров циркулирующих триглицеридов и ремнантных частиц, снижения титров липопротеинов высокой плотности (ЛПВП) 2-го типа. При этом активность синтеза ХС в гепатоците и титры ЛПНП при НАСГ выше, чем при стеатозе печени, и коррелируют со степенью инсулинорезистентности/гиперинсулинемии и титрами аланинаминотрансферазы (АЛТ) [32, 34].
Вследствие нарушения работоспособности клеточных мембран и прямого подавления синтеза желчных кислот при НАСГ в гепатоците нарушаются основные пути утилизации избытков ХС – синтез из ХС желчных кислот и активный транспорт ХС в желчь [35]. Оба процесса тесно связаны с метаболической активностью клеточных мембран гепатоцита: мембран органелл и наружной мембраны – ее базолатеральной части, отвечающей за активный транспорт избытка ХС в желчь и синусоидальной ‒ отвечающей за захват гепатоцитом ХС ЛПНП. Нарушение вязкости, текучести и метаболической активности клеточных мембран является универсальным патогенетическим механизмом, который на молекулярном уровне ложится в основу формирования тканевых и системных осложнений НАСГ: апоптоза гепатоцитов и активности воспаления в печени и организме в целом, дислипидемии, билиарной недостаточности, нарушения метаболического ресурса печени. Одна из причин дисфункции клеточных мембран гепатоцита – оксидативный стресс, вторая ‒ избыток в гепатоците свободного ХС.
Свободный ХС легко проникает в клеточные мембраны и уменьшает относительное содержание эссенциальных фосфолипидов (ЭФЛ) ‒ основных метаболически активных компонентов мембраны, обеспечивающих ее вязкость и текучесть. Имбибирование свободным ХС особенно негативно влияет на метаболическую активность митохондрий, эндоплазматического ретикулума и аппарата Гольджи, в мембранах которых соотношение ХС/ЭФЛ (в частности – фосфатидилхолина) не должно превышать 0,2 (рис. 9) [23]. ![Рис. 9. Нормальное соотношение «холестерин / эссенциальные фосфолипиды» в различных клеточных мембранах гепатоцита [23] Рис. 9. Нормальное соотношение «холестерин / эссенциальные фосфолипиды» в различных клеточных мембранах гепатоцита [23]](https://medblog.su/wp-content/uploads/2018/12/1544975105_638_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Кроме того, существует гипотеза, что избыток свободного ХС способен увеличивать образование в цитоплазматической мембране различных клеток дополнительных сигнальных зон – липидных рафтов. Известно, что липидные рафты участвуют в образовании сигнального пути иммуноглобулина Е, рецептора эпидермального фактора роста, Т- и В-клеточных антигеновых рецепторов, инсулинового рецептора, а также сигнального пути с участием toll-like-рецепторов, опосредующих секрецию ядерного фактора транскрипции Κβ и запуск апоптоза и хронического воспаления [36]. Таким образом, НАСГ приводит к кардинальному нарушению метаболизма ХС и накоплению в печени его прекурсоров, а также формирует второй важнейший предиктор атерогенеза – системное воспаление (рис. 10) [37]. ![Рис. 10. Проатерогенные эффекты НАЖБП (модифицировано по G.Targher et al., 2010 [37]) Рис. 10. Проатерогенные эффекты НАЖБП (модифицировано по G.Targher et al., 2010 [37])](https://medblog.su/wp-content/uploads/2018/12/1544975105_554_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
С клинической точки зрения развитие НАСГ сопровождается мультисистемными проявлениями раннего атеросклероза и ССЗ [37, 38]. В метаанализе 27 перекрестных исследований вне зависимости от классических предикторов ССЗ и МС установлена связь между НАСГ и маркерами субклинического течения атеросклероза:
– увеличение толщины комплекса интима – медиа сонных артерий – 16 исследований;
– повышенная кальцификация коронарных артерий – 7 исследований;
– нарушение вазодилатации (эндотелиальная дисфункция) – 7 исследований;
– уменьшение эластичности артерий – 6 исследований [39].
У пациентов с НАСГ вследствие нарушения обмена высокоэнергетических фосфатов и инсулинорезистентности увеличивается толщина эпикардиального жира, развиваются ранние изменения субстратного метаболизма миокарда, приводящие к диастолической дисфункции сердца, ранней гипертрофии миокарда левого желудочка, жировой дистрофии и очаговому фиброзу миокарда с увеличением риска развития застойной сердечной недостаточности [1, 40]. При верифицированных ССЗ у пациентов с НАСГ раньше образуются атеросклеротические бляшки в коронарных и каротидных артериях, увеличивается прокоагулянтная активность плазмы, чаще развиваются безболевая ишемия миокарда, фибрилляция предсердий и желудочковые нарушения ритма сердца [37, 38, 41‒43]. В ходе 10-летнего наблюдения у пациентов с НАСГ и СД 2-го типа риск фибрилляции предсердий был в 5 раз выше, чем у пациентов без НАЖБП, независимо от наличия МС и других факторов риска ССЗ [44]. В российском эпидемиологическом исследовании у 76% амбулаторных пациентов с НАЖБП имела место атерогенная дислипидемия, у 70% ‒ артериальная гипертензия [5, 6]. В клинических исследованиях накапливаются доказательства прямой связи НАСГ и раннего развития хронической болезни почек, базирующейся на нарушении секреции фетуина-А и адипонектина [45]. При гистологически верифицированной НАЖБП (метаанализ 20 перекрестных и 13 долгосрочных исследований, n=63 902) хроническая болезнь почек встречается почти в 2 раза чаще (OR 1,79; 95% CI 1,65–1,95). НАСГ связан с еще более высокой частотой хронической болезни почек (OR 2,12, 95% CI 1,42–3,17), чем простой стеатоз [46].
Клиническая картина и диагностика НАЖБП
Таким образом, в общей практике НАЖБП как ранний предиктор высокого риска сердечно-сосудистой патологии и СД должна выявляться целенаправленно. Однако ранняя диагностика НАЖБП осложнена отсутствием специфических симптомов, особенно на ранних стадиях болезни. Простой стеатоз печени может протекать бессимптомно и диагностироваться случайно при обследовании пациента по другому поводу. Симптомы НАСГ зависят от активности процесса. Часть пациентов предъявляют жалобы неспецифического характера: на повышенную утомляемость, ноющую боль или дискомфорт в области правого подреберья без четкой связи с приемом пищи. В тех случаях, когда НАЖБП приводит к развитию цирроза печени, появляются симптомы, которые служат проявлением печеночной недостаточности или портальной гипертензии: увеличение размеров живота, отеки, геморрагический синдром, энцефалопатия.
Согласно международному консенсусу и клиническим практическим рекомендациям Европейской ассоциации по изучению печени (EASL, European Association for the Study of the Liver) 2016 г., активный скрининг НАЖБП прежде всего необходим при ожирении – основном факторе риска развития и прогрессирования НАЖБП и инсулинорезистентности (уровень доказательности А1) [47].
Скрининговое обследование для выявления НАЖБП показано пациентам, имеющим:
• ожирение;
• СД 2-го типа;
• МС;
• дислипидемию;
• гипотиреоз;
• синдром мальабсорбции;
• увеличение титра АЛТ.
1. Физикальное исследование. При объективном осмотре выявляются признаки ожирения печени: умеренное увеличение печени, край ее закруглен, консистенция тестоватая. При выраженном фиброзе печень становится плотной, на стадии цирроза могут быть обнаружены «печеночные знаки», спленомегалия, портальная гипертензия.
2. Лабораторные исследования: титры триглицеридов, ХС, ЛПВП, ЛПНП; аполипопротеин В, АЛТ, аспартатаминотрансфераза (АСТ), билирубин, щелочная фосфатаза (ЩФ), гамма-глютамилтранспептидаза (ГГТП), альбумин, коагулограмма.
Отклонения липидного профиля при НАЖБП характерны для МС: повышение содержания триглицеридов (≥1,7 ммоль/л) и снижение уровня ХС ЛПВП (
3. Глюкоза крови натощак троекратно – при устойчивой гипергликемии натощак необходимо определить иммуно-реактивный инсулин в плазме натощак (ИРИ). Значение ИРИ больше 18 мкед/мл расценивается как базальная гиперинсулинемия; одновременное определение повышенного уровня С-пептида подтверждает полученный результат.
4. Тест на инсулинорезистентность (НОМА>2). Гомеостатическая модель оценки инсулинорезистентности: расчет показателя HOMA-IR (Homeostasis Model Assessment-Insulino Resistance). HOMA-IR = инсулин плазмы натощак (мкед/мл) × глюкоза плазмы натощак (ммоль/л)/22,5. Значение НОМА-IR>2,27 указывает на инсулинорезистентность. Необходимо помнить о том, что диагностическая точность теста резко снижается у пациентов с СД.
5. Определение ферритина, церулоплазмина, маркеров вирусного гепатита с целью дифференциального диагноза.
НАСГ необходимо дифференцировать:
• с алкогольной болезнью печени;
• токсическим гепатитом / ятрогенным липидозом;
• гемохроматозом;
• болезнью Вильсона – Коновалова;
• вирусным гепатитом;
• аутоиммунным гепатитом.
Методы инструментальной диагностики НАЖБП
При ультразвуковом исследовании (УЗИ) печени определяются:
• диффузная гиперэхогенность паренхимы печени и неоднородность ее структуры;
• нечеткость и/или подчеркнутость сосудистого рисунка;
• дистальное затухание ЭХО-сигнала.
При компьютерной томографии печени основными признаками НАЖБП служат:
• снижение лучевой плотности печени на 3–5 HU, которая в норме составляет 50–75 HU;
• более низкая лучевая плотность печени в сравнении с селезенкой;
• более высокая плотность внутрипеченочных сосудов, воротной и нижней полой вен в сравнении с печеночной тканью.
Магнитно-резонансная томография (МРТ) печени с фазовым контрастированием позволяет количественно оценить степень жировой инфильтрации. Очаги снижения интенсивности на Т1-взвешенных изображениях могут свидетельствовать о локальном накоплении жира. У пациентов с СД 2-го типа в качестве метода скрининга НАСГ рекомендуются МРТ с определением степени жировой инфильтрации посредством расчета протонной плотности жира и определение степени фиброза печени посредством МРТ-эластографии (рис. 11) [16].
Эластография печени проводится на аппарате «ФиброСкан» и позволяет судить об изменении эластических свойств печени на основании отраженных вибрационных импульсов и их последующего компьютерного анализа. Применение эластометрии возможно на всех стадиях фиброза (F0—F4). К преимуществам метода относятся: неинвазивность; воспроизводимость; больший, чем при биопсии (в 100‒200 раз), оцениваемый объем ткани печени; быстрота и удобство применения (обследование занимает в среднем 5 мин); немедленный ответ; оценка эффективности терапии; возможность обследования детей. Интерпретация результатов эластометрии затруднена в случаях: избыточной массы тела (ИМТ>35 кг/м2); выраженного стеатоза печени; значительной активности АЛТ и АСТ выше верхней границы нормы в 3 раза и более. Критерии успешного результата исследования: интерквартильный коэффициент (IQR) не более 30% показателя эластичности; не менее 10 достоверных измерений в одной точке исследования; не менее 60% успешных измерений. ![Рис. 11. МРТ-эластограмма у пациента с СД 2-го типа [16] Рис. 11. МРТ-эластограмма у пациента с СД 2-го типа [16]](https://medblog.su/wp-content/uploads/2018/12/1544975105_430_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
В рамках общероссийского национального проекта «Дни заботы о печени» проведено обследование на аппарате «ФиброСкан» 55 участников акции – жителей г. Москвы и Московской области. Средний возраст участников проекта составил 35±17 лет. Распределение по полу: 22 мужчины и 33 женщины. Распределение по ИМТ: 18–25 кг/м2 – 34 человека, 25–30 кг/м2 – 17 человек, более 30 кг/м2 – 4 человека. По данным эластографии печени: F0 (отсутствие фиброза печени) выявлено у 31 (56,3%) человека, F1 (минимальный фиброз) – у 12 (21,9%) человек, F2 (умеренный фиброз) – у 8 (14,5%) человек, F3 (выраженный фиброз) – у 3 (5,5%) человек, F4 (цирроз печени) – у 1 (1,8%) человека. По данным проведенного комплексного обследования: 31 (56,3%) человек оказался абсолютно здоровым, однако у 24 (43,7%) выявлена различная патология со стороны печени: маркеры HBV-инфекции выявлены у 5 (9,1%), маркеры HCV-инфекции – у 4-х (7,3%) человек. По данным УЗИ органов брюшной полости жировая инфильтрация печени выявлена у 15 (27,3%) человек. Таким образом, у 1/3 участников проекта выявленные при эластографии фиброзные изменения ткани печени рассматривались как результат НАЖБП [6].
Пункционная биопсия с морфологическим исследованием ‒ современный «золотой стандарт» диагностики стеатоза, воспаления и стадии фиброза при НАЖБП. Данный метод позволяет с высокой степенью достоверности подтвердить наличие НАЖБП, провести дифференциальный диагноз между стеатозом и НАСГ, оценить стадию фиброза и на основании гистологических данных прогнозировать дальнейшее течение заболевания, а также исключить другие причины поражения печени. В 2005 г. на основе консенсуса экспертов (CRN) морфологов для оценки НАЖБП предложена Шкала оценки активности НАЖБП (NAFLD activity score ‒ NAS), которая является модификацией использовавшихся ранее шкал Е. Brunt и Matteoni 1999 г. и позволяет оценить степень морфологических изменений в баллах (от 0 до 8). По шкале NAS оценивают следующие признаки:
1) степень активности NAS (0–8 баллов). Стеатоз (0–3): 66%; внутридольковое воспаление: 0, 4; баллонная дистрофия (0–2): нет, минимальная, умеренная, выраженная;
2) стадия фиброза (0–4): 1 а, b: зона 3-го ацинуса; 1 с: портальный фиброз; 2: зона 3-го ацинуса+; портальный/перипортальный фиброз; 3: фиброзные септы; 4: цирроз печени.
Показания для пункционной биопсии печени при НАЖБП [48]:
• мотивированный пациент;
• СД 2-го типа;
• андроидное ожирение;
• тромбоцитопения 140 тыс. и менее;
• инсулинорезистентность (НОМА>2);
• любые косвенные признаки цирроза печени.
Для верификации НАЖБП разработаны лабораторные методы, которые позволяют неинвазивно оценить степень некровоспалительной активности и стеатоза, стадию фиброза печени, – Фибромакс®, Фибротест®, включают 5 не коррелирующих между собой биохимических показателей: α-2-макроглобулин, гаптоглобин, аполипопротеин А1, ГГТП и общий билирубин, которые позволяют оценивать выраженность фиброза с помощью дискриминантной функции. С его помощью можно дифференцировать фиброз (Fl‒F3) от цирроза печени (F4).
В Европейских клинических практических рекомендациях по ведению НАЖБП (2016) было впервые подчеркнуто, что УЗИ и КТ не могут использоваться в дифференцировании стеатоза печени от НАСГ. Однако УЗИ имеет преимущества при скрининговой диагностике стеатоза печени, особенно у пациентов без клинических и лабораторных симптомов. Консенсус европейских специалистов признает:
– лабораторный и ультразвуковой скрининг НАЖБП у пациентов с ожирением, СД и другими факторами риска должен стать рутинным (уровень доказательности АII);
– при выявлении стеатоза печени независимо от титров печеночных проб необходимо диагностировать МС (уровень доказательности АI);
– у пациентов с СД 2-го типа необходимо мониторировать титры печеночных проб для выявления НАСГ (уровень доказательности АII);
– при стойком повышении титров печеночных проб (АЛТ) необходимо диагностировать НАЖБП как основную причину бессимптомного повышения уровня ферментов (уровень доказательности АI) [47].
Необходимо понимать, что верификация диагноза НАЖБП в медицинской практике подразумевает отсутствие у пациента значимого злоупотребления алкоголем, поскольку хроническая алкогольная интоксикация ‒ залог негативного прогноза и отсутствия терапевтической перспективы при любой из форм хронического заболевания печени. Гепатотоксичным считается прием более 40 г чистого этанола в сутки для мужчин и более 20 г – для женщин. Однако это не означает, что этиологические факторы ожирения печени – НАЖБП и алкогольная болезнь не могут существовать одновременно, потенцируя развитие друг друга. Установлено, что при сочетании алкогольной болезни печени и НАЖБП риск смерти от цирроза печени возрастает экспоненциально (в 9,53 раза) по сравнению с не пьющими или людьми с нормальным весом [49]. С другой стороны, ожирение фатально увеличивает риск цирроза печени у злоупотребляющих алкоголем женщин, поскольку активно потенцирует воспалительный каскад и ассоциированный с ним фиброгенез. Установлено, что морбидное ожирение на 17% увеличивает частоту встречаемости неалкогольного и на 42% – частоту алкогольного цирроза печени (рис. 12) [50].![Рис. 12. Риск развития цирроза печени у женщин в течение 5 лет с сочетанной алкогольно-метаболической этиологией жировой инфильтрации печени (модифицировано по B. Liu et al., 2010 [50]) Рис. 12. Риск развития цирроза печени у женщин в течение 5 лет с сочетанной алкогольно-метаболической этиологией жировой инфильтрации печени (модифицировано по B. Liu et al., 2010 [50])](https://medblog.su/wp-content/uploads/2018/12/1544975105_13_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Таким образом, выяснение степени употребления алкоголя у пациента с вероятным НАЖБП имеет принципиальное значение для оценки этиологии и, следовательно, прогноза заболевания. В общей практике существует целый ряд технологий для уточнения алкогольного анамнеза (тесты АUDIT, CAGE и др.). Как следует из представленного ниже клинического примера, игнорирование этого важнейшего морбидного фактора может приводить к драматическим последствиям для жизни пациента (рис. 13).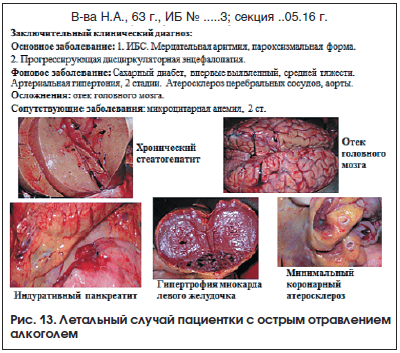
К сожалению, специфичных морфологических признаков НАЖБП и НАСГ, как и клинических симптомов, не существует. При доступности гистологической диагностики диагноз НАЖБП считается сомнительным в случае выявления в биоптате печени мелкокапельного стеатоза, преобладания портального воспаления и/или фиброза над лобулярным, признаков поражения желчных протоков, веноокклюзионной болезни. Характерными находками, позволяющими заподозрить алкогольную этиологию стеатоза и гепатита, являются:
• неоднородность стеатоза ткани;
• тельца Меллори (гиалин);
• признаки холестаза;
• перивенулярный склероз;
• алкогольная гидропическая дистрофия.
Лечение НАЖПБ
Лечение НАЖБП, как и ее ранняя диагностика, является прерогативой врача общей практики, поскольку нацелено на модификацию образа жизни и преимущественно применение нелекарственных методов воздействия. Согласно международному консенсусу, в настоящее время лекарственной терапии НАЖБП/НАСГ, эффективность которой подтверждена в рандомизированных контролируемых исследованиях (РКИ), не существует.
Ключом к лечению НАЖБП/НАСГ являются раннее выявление болезни и модификация нездорового образа жизни пациентов (уровень доказательности AI):
• снижение веса само по себе или в сочетании с увеличением физической активности уменьшает жировую инфильтрацию печени при НАЖБП (уровень доказательности АI);
• коррекция диеты предполагает уменьшение калорийности рациона, исключение жареного и продуктов с фруктозой (уровень доказательности BI);
• состав макронутриентов рациона должен соответствовать таковому средиземноморской диеты (уровень доказательности BI) [47, 51].
На первый взгляд выполнение указанных выше рекомендаций кажется простым и очевидным, однако на практике встречает значительные трудности. Прежде всего вследствие отсутствия конкретных знаний и единой стратегии нутрицевтической терапии, во-вторых, в связи с низкой комплаентностью больных в отношении изменения пищевого поведения. Между тем у пациентов с НАЖБП выявлены специфические паттерны пищевого поведения (переедание / большие порции, повышенное потребление калорий, недостаточное потребление пищи на завтрак, большое количество пищи вечером, редкие приемы пищи, большое количество легких углеводов, сатурированных и трансжиров, ХС, недостаточное потребление ω-3 жиров, витаминов Е и D и пробиотиков), которые на фоне «западного городского образа жизни и питания» неуклонно ведут к набору веса и требуют направленной коррекции в любом возрасте [52‒54].
Согласно современным научным данным, основная цель коррекции пищевого поведения при НАЖБП – снижение массы тела на 5‒10% до ИМТ ![Рис. 14. Эндокринная роль основных желчных кислот (модифицировано по M. Watanabe et al., 2006 [61]) Рис. 14. Эндокринная роль основных желчных кислот (модифицировано по M. Watanabe et al., 2006 [61])](https://medblog.su/wp-content/uploads/2018/12/1544975105_107_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Однако важнейшей целью нутрицевтической коррекции является коррекция жирового рациона – не только как его наиболее калорийной части, но и как прямого стимулятора эктопического отложения жира и причины провоспалительной деформации внутренней среды организма. Согласно международному консенсусу, доля «жирных калорий» в рационе для лечения НАЖБП не должна превышать 30–35% от суммарной калорийности, а доля калорий, полученных из насыщенных жиров, должна быть менее 7% от общей калорийности рациона. Поступление ХС с пищей не должно превышать 200 мг/дл при обязательном исключении трансжиров. Основным источником «жирных калорий» должны быть 8‒10 г/сут жиров с ПНЖК [53–56].
В качестве модели для построения лечебного пищевого рациона при НАЖБП Международный консенсус клинических практических рекомендаций предлагает средиземноморскую диету (уровень доказательности BI) [47, 51]. Средиземноморская диета как понятие была введена в медицинскую практику после 1960 г., когда Ансель и Маргарет Кейс опубликовали результаты эпидемиологического исследования Seven Countries’ Study, согласно которым в 7 странах Средиземноморского бассейна заболеваемость ССЗ и раком оказалась значительно ниже, чем в США, Северной Европе и Японии [62].
Отличительными признаками средиземноморской диеты являются:
• высокое потребление свежих фруктов, овощей, картофеля, бобов, орехов, кунжута, льняного семени и других семян;
• хлеб, макаронные изделия и другие продукты на основе зерновых культур;
• оливковое масло для готовки и заправок, а также другие источники жиров, которые не содержат насыщенных жирных кислот; обеспечивающих 25–35% суммарной калорийности;
• умеренное потребление кисломолочных продуктов из цельного молока и йогуртов;
• умеренное употребление рыбы и морепродуктов, изредка ‒ мяса;
• умеренное потребление красного вина, обычно во время приема пищи;
• выбор свежих сезонных продуктов [63].
Начиная с 1970-х гг. во множестве теоретических и экспериментальных исследований было показано, что средиземноморская диета является оптимальным рационом для сохранения здоровья, снижения риска ССЗ и ожирения, хронических, дегенеративных заболеваний, уменьшения массы тела [64–66]. В новейших исследованиях на фоне средиземноморской диеты уменьшались жировая инфильтрация печени и лабораторные проявления НАСГ (уменьшение AСT/AЛT) [67–69]. В ряде работ, по данным авторов, приверженность средиземноморской диете приводила к увеличению чувствительности к инсулину у больных с инсулинорезистентностью даже без достижения существенного уменьшения массы тела [70–72].
Эффективность средиземноморской диеты и близких к ней рационов питания («северный рацион»: рыба + капуста + ржаной хлеб + овсяная каша + яблоки + корнеплоды или «восточный рацион»: рыба + морепродукты + продукты из сои и других бобовых + столовая зелень) обусловлена высоким содержанием в ней антиоксидантов и незаменимых (эссенциальных) для человека ПНЖК [73]. В указанных продуктах ω-3 ПНЖК могут содержаться в свободной форме (α-линоленовая кислота в семенах, орехах, водорослях, растительных маслах – кроме оливкового; эйкозапентаеновая и докозагексаеновая кислоты – в жирной морской рыбе) или в форме ЭФЛ (бобовые, соя, яичный желток, цельное молоко). Для поддержания «здоровья» клеточных мембран организма и успешной борьбы с оксидативным стрессом пищевой рацион современного горожанина должен содержать не менее 2 г взаимозаменяем-
ых ω-3 α-линоленовой/эйкозапентаеновой и 6–8 г ω-6 линолевой/арахидоновой ПНЖК из любых пищевых источников или из биологически активных добавок и лекарственных препаратов [74]. Доказано, что при перманентном поступлении с пищей ПНЖК насыщают фосфолипиды клеточных мембран, чем и обусловлено их кардиопротективное, антиагрегантное и противовоспалительное действие – как системное, так и в печени (табл. 2, 3) [75–77]. ![Таблица 2. Различия в содержании мембранных фосфолипидов в тромбоцитах, обусловленные этническим фактором (модифицировано по Rodriguez – Leyva D. et al., 2010 [76]) Таблица 2. Различия в содержании мембранных фосфолипидов в тромбоцитах, обусловленные этническим фактором (модифицировано по Rodriguez – Leyva D. et al., 2010 [76])](https://medblog.su/wp-content/uploads/2018/12/1544975105_65_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
![Таблица 3. Интегральное влияние ω-3 ПНЖК на липидный обмен и его нарушения [22, 23, 78] Таблица 3. Интегральное влияние ω-3 ПНЖК на липидный обмен и его нарушения [22, 23, 78]](https://medblog.su/wp-content/uploads/2018/12/1544975105_918_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Однако важнейший механизм лечебного действия ПНЖК, особенно ω-3 α-линоленовой и эйкозапентаеновой жирных кислот при НАЖБП, обусловлен их антиатерогенным влиянием на липидный обмен: способностью активировать окисление триглицеридов и уменьшать жировую инфильтрацию печени, минимизировать последствия липотоксичности и уменьшать инсулинорезистентность во всех тканях-мишенях, а также препятствовать избыточному синтезу ХС и его обратному всасыванию в кишечнике [22, 23, 78, 79].
Согласно консенсусу практических рекомендаций по лечению НАЖБП, употребление не менее 2–4 г/сут ω-3 жирных кислот рекомендовано и как фармакологическая стратегия первого выбора для пациентов с высокими титрами триглицеридов в плазме, в т. ч. одновременно с назначением статинов (уровень доказательности ВI) [47, 51]. Среди препаратов, содержащих ПНЖК, в нашей стране хорошо известны поливитаминные биологически активные добавки (БАДы) и препараты, содержащие комбинацию эйкозапентаеновой и докозагексаеновой жирных кислот, и препараты ЭФЛ (Эссенциале форте Н).
В одной капсуле Эссенциале форте Н содержится 76% ЭФЛ: 50% – дилинолеоил-фосфатидилхолина и до 11% ω3-линоленоил-фосфатидилхолина, которые обладают 90% биодоступностью и служат источником биоидентичных эссенциальных ω3, 6-ПНЖК растительного происхождения, получаемых из соевых бобов [80]. К настоящему времени накоплена солидная доказательная база данных РКИ, которые показывают эффективность терапии ЭФЛ в отношении нормализации высокоатерогенной дислипидемии, улучшения лабораторной и ультразвуковой картины печени, уменьшения инсулинорезистентности, минимизации системного и тканевого воспаления и уменьшения активности фиброгенеза в печени, в т. ч. при сочетанной алкогольно-метаболической этиологии жировой инфильтрации [80–86].
Другую лекарственную терапию указанные рекомендации настойчиво советуют назначать только пациентам с верифицированным НАСГ и значимым уровнем фиброза печени (>F2), с СД, МС и стойким повышением АЛТ (уровень доказательности BI). Такой осторожный подход рекомендован для терапии пиоглитазоном (высокая частота побочных эффектов: увеличение веса, остеопороз, сердечная недостаточность) и высокими дозами витамина Е (увеличивают риск канцерогенеза и тромботических осложнений), притом что оба метода лечения приводят к улучшению гистологической структуры у пациентов с НАСГ (уровень доказательности BI). В рекомендациях 2016 г. было вновь подчеркнуто, что терапия метформином (АI) и урсодезоксихолевой кислотой (ВI) не оказывает значимого влияния на гистологию печени при НАЖБП и не рекомендована как метод специфической терапии НАСГ у взрослых. Среди перспективных препаратов для специфической терапии НАСГ можно выделить обетихолевую кислоту и арахидиламидохолановую кислоту (закончены клинические исследования III фазы) и эзетимиб (рис. 15). К сожалению, ни один из указанных препаратов не является оптимальным, поскольку не показал хорошей эффективности при удовлетворительной безопасности лечения [87]. ![Рис. 15. Перспективные методы таргетной терапии НАСГ (модифицировано по N. Mazzella et al., 2014 [87]) Рис. 15. Перспективные методы таргетной терапии НАСГ (модифицировано по N. Mazzella et al., 2014 [87])](https://medblog.su/wp-content/uploads/2018/12/1544975105_922_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Заключение
Ранняя диагностика НАЖБП и выявление НАСГ врачами общей практики ‒ это важнейшие задачи первичного звена здравоохранения и, по-видимому, единственная возможность противопоставить возможности медицины набирающей обороты эпидемии метаболического ожирения и СД 2-го типа. Однако для модификации образа жизни пациентов с НАЖБП недостаточно только знаний о патологии и верификации диагноза. Для достижения этой терапевтической цели врачу общей практики помимо профессиональной и гуманистической мотивации необходимы стратегия действий и технические возможности для ее реализации. В частности, сформировать у пациента с НАЖБП первичную мотивацию для изменения образа жизни может модель врачебного консультирования за 20 мин (рис. 16), предложенная K. Hallsworth et al. [88]. ![Рис. 16. Алгоритм врачебного консультирования, направленный на модификацию образа жизни при НАЖБП (модифицировано по K. Hallsworth и соавт., 2016 [88]) Рис. 16. Алгоритм врачебного консультирования, направленный на модификацию образа жизни при НАЖБП (модифицировано по K. Hallsworth и соавт., 2016 [88])](https://medblog.su/wp-content/uploads/2018/12/1544975105_110_nealkogolnaya-zhirovaya-bolezn-pecheni-kak-proaterogennoe-zabolevanie-diagnostika-i-lechenie-v-obshhej-praktike-vovk-e-i.png)
Литература
1. Byrne C.D., Targher G. NAFLD: a multisystem disease // J. Hepatol. 2015. Vol. 62. Suppl. 1. P. 47–64.
2. Sayiner M., Koenig A., Henry L., Younossi Z.M. Epidemiology of Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis in the United States and the Rest of the World // Clin Liver Dis. 2016. Vol. 20. P. 205–214.
3. www.the-nash-education-program.com.
4. Koenig A.B., Younossi Z.M., Koenig A.B. et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes // Hepathology. 2016. Vol. 64 (1). P. 73–84. doi: 10.1002/hep.28431.
5. Ивашкин В.Т., Драпкина О.М., Маев И.В. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования DIREG 2 // РЖГГК. 2015. № 6. С. 31–41 [Ivashkin V.T., Drapkina O.M., Maev I.V., i dr. Rasprostranennost’ nealkogol’noj zhirovoj bolezni pecheni u pacientov ambulatorno-poliklinicheskoj praktiki v Rossijskoj Federacii: rezul’taty issledovanija DIREG 2 // RZhGGK. 2015. № 6. S. 31–41 (in Russian)].
6. Диагностика и лечение неалкогольной жировой болезни печени / под ред. акад. РАН, проф. В.Т. Ивашкина. Методические рекомендации для врачей. Российское общество по изучению печени. М., 2015. 29 с. [Diagnostika i lechenie nealkogol’noj zhirovoj bolezni pecheni / рod red. akad. RAN, prof. V.T. Ivashkina. Metodicheskie rekomendacii dlja vrachej. Rossijskoe obshhestvo po izucheniju pecheni. M., 2015. 29 s. (in Russian)].
7. Bhatia L.S. et al. Non-alcoholic fatty liver disease: a new and important cardiovascular risk factor? // European Heart Journal. 2012. Vol. 33. P. 1190–1200. doi:10.1093/eurheartj/ehr453.
8. Chalasani N., Younossi Z., Lavine J.E. et al. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association // Hepatology. 2012. Vol. 55. P. 2005–2023.
9. Harrison’s Principles of Internal Medicine, 17th ed.New York: McGraw-Hill Medical Publishing Division.
10. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: практ. руководство; пер. с англ. / под ред. З.Г. Апросиной, Н.А. Мухина. М.: Гэотар-Медицина., 1999. 864 с. [Sherlok Sh., Duli Dzh. Zabolevanija pecheni i zhelchnyh putej: рrakt. rukovodstvo; рer. s angl. / рod red. Z.G. Aprosinoj, N.A. Muhina. M.: Gjeotar-Medicina., 1999. 864 s. (in Russian)].
11. Musso G., Gambino R., Cassader M. Non-alcoholic fatty liver disease from pathogenesis to management: an update // Obesity Reviews. 2010. Vol. 11(6). Р. 430–445.
12. McPherson S., Hardy T., Henderson E. et al. Evidence of NAFLD progression from steatosis to fibrosing-steatohepatitis using paired biopsies: implications for prognosis and clinical management // J. Hepatol. 2015. Vol. 62. № 5. P. 1148–1155.
13. Musso G., Gambino R., Cassader M., Pagano G.F. Meta-analysis: natural history of non-alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non-invasive tests for liver disease severity // Ann Med. 2011. Vol. 43. P. 617–649.
14. Benedict M., Zhang X. Non-alcoholic fatty liver disease: An expanded review // World Journal of Hepatology. 2017. Vol. 9(16). P. 715–732. doi:10.4254/wjh.v9.i16.715.
15. Lazo M., Clark J. The epidemiology of nonalcoholic fatty liver disease: a global perspective // Semin Liver Dis. 2008. Vol. 28(4). Р. 339–350.
16. Doycheva I., Cui J., Nguyen P. et al. Non-invasive screening of diabetics in primary care for NAFLD and advanced fibrosis by MRI and MRE // Alimentary Pharmacology and Therapeutics. 2016. Vol. 43 (1). P. 83–95.
17. Lonardo A., Bellentani S., Argo C.K. et al. Epidemiological modifiers of non-alcoholic fatty liver disease: Focus on high-risk groups // Dig Liver Dis. 2015. Vol. 47(12). P. 997–1006. doi: 10.1016/j.dld.2015.08.004.
18. Ballestri S., Nascimbeni F., Baldelli E. et al. NAFLD as a Sexual Dimorphic Disease: Role of Gender and Reproductive Status in the Development and Progression of Nonalcoholic Fatty Liver Disease and Inherent Cardiovascular Risk // Adv Ther. 2017. Vol. 34(6). P. 1291–1326. doi: 10.1007/s12325-017-0556-1.
19. Sookoian S., Pirola C.J. Genetic predisposition in nonalcoholic fatty liver disease // Clinical and Molecular Hepatology. 2017. Vol. 23(1). P. 1–12. doi:10.3350/cmh.2016.0109.
20. Caligiuri A., Gentilini A., Marra F. Molecular Pathogenesis of NASH // International Journal of Molecular Sciences. 2016. Vol. 17(9). P. 1575. doi:10.3390/ijms17091575.
21. Green C.J., Hodson L. The Influence of Dietary Fat on Liver Fat Accumulation // Nutrients. 2014. Vol. 6(11). P. 5018–5033. doi:10.3390/nu6115018.
22. Ferramosca A., Zara V. Modulation of hepatic steatosis by dietary fatty acids // World Journal of Gastroenterology : WJG. 2014. Vol. 20(7). P. 1746–1755. doi: 10.3748/wjg.v20.i7.1746.
23. Wang W. et al. ω-3 polyunsaturated fatty acids-derived lipid metabolites on angiogenesis, inflammation and cancer // Prostaglandins Other Lipid Mediat. 2014. Vol. 1. P. 13–20. doi: 10.1016/j.prostaglandins.2014.07.002.
24. Byrne C.D. Ectopic fat, insulin resistance and non-alcoholic fatty liver disease // Proc Nutr Soc. 2013. Vol. 72(4). P. 412–419. doi: 10.1017/S0029665113001249.
25. Rutkowski J.M., Stern J.H., Scherer P.E. The cell biology of fat expansion // J Cell Biol. 2015. Vol. 208 (5). P. 501–512. doi: 10.1083/jcb.201409063.
26. Schaffer J.E. Lipotoxicity: Many Roads to Cell Dysfunction and Cell Death: Introduction to a Thematic Review Series // Journal of Lipid Research. 2016. Vol. 57(8). P. 1327–1328. doi:10.1194/jlr.E069880.
27. Byrne C.D. Dorothy Hodgkin Lecture 2012: non-alcoholic fatty liver disease, insulin resistance and ectopic fat: a new problem in diabetes management // Diabet Med. 2012. Vol. 29(9). P. 1098–1107. doi: 10.1111/j.1464-5491.2012.03732.x
28. Tsochatzis E.A. Adipokines in Nonalcoholic Steatohepatitis: From Pathogenesis to Implications in Diagnosis and Therapy // Mediators Inflamm. 2009. 2009: 831670. doi: 10.1155/2009/831670.
29. Lonardo A., Sookoian S., Chonchol M. et al. Cardiovascular and systemic risk in nonalcoholic fatty liver disease – atherosclerosis as a major player in the natural course of NAFLD // Curr Pharm Des. 2013. Vol. 19(29). P. 5177–5192.
30. Wende A.R., Symons J.D., Abel E.D. Mechanisms of Lipotoxicity in the Cardiovascular System // Current hypertension reports. 2012. Vol. 14(6). P. 517–531. doi: 10.1007/s11906-012-0307.
31. Marchesini G., Bugianesi E., Forlani G. et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome // Hepatology. 2003. Vol. 37(4). P. 917–923.
32. Min H.K. et al. Increased hepatic synthesis and dysregulation of cholesterol metabolism is associated with the severity of nonalcoholic fatty liver disease // Cell Metab. 2012. Vol. 15(5). P. 665–674.
33. Brown M.S., Goldstein J.L. A receptor-mediated pathway for cholesterol homeostasis // Nobel lecture. 9 December. 1985.
34. Fuchs M., Seneshaw M., Patel A. et al. Tu1030 Formation and Maturation of High Density Lipoproteins (HDL) is Impaired in Nonalcoholic Steatohepatitis (NASH) // Gastroenterology. 2012. Vol. 142. Issue 5. P. S–1015.
35. Musso G., Gambino R., Cassader M. Cholesterol metabolism and the pathogenesis of non-alcoholic steatohepatitis // Prog Lipid Res. 2013. Vol. 52(1). P. 175–191. doi: 10.1016/j.plipres.2012.11.002. Epub 2012 Dec 1.
36. Веснина Л. Э. Липидные рафты: роль в регуляции функционального состояния клеточных мембран // Актуальные проблемы современной медицины. 2013. Т. 13 (2). С. 5–10 [Vesnina L. Je. Lipidnye rafty: rol’ v reguljacii funkcional’nogo sostojanija kletochnyh membran // Aktual’nye problemy sovremennoj mediciny. 2013. T. 13 (2). S. 5–10 (in Russian)].
37. Targher G., Day C.P., Bonora E. Risk of Cardiovascular Disease in Patients with Nonalcoholic Fatty Liver Disease // N Engl J Med. 2010. Vol. 363. P. 1341–1350. doi: 10.1056/NEJMra0912063.
38. Oni E.T. et al. A systematic review: burden and severity of subclinical cardiovascular disease among those with nonalcoholic fatty liver; should we care? // Atherosclerosis. 2013. Vol. 230. P. 258–267.
39. Драпкина О.М., Чапаркина С.О. Взаимосвязь метаболического синдрома, асептического воспаления и дисфункции эндотелия // Российские медицинские вести. 2007. Т. 12. № 3. C. 67–75 [Drapkina O.M., Chaparkina S.O. Vzaimosvjaz’ metabolicheskogo sindroma, asepticheskogo vospalenija i disfunkcii jendotelija // Rossijskie medicinskie vesti. 2007. T. 12. № 3. C. 67–75 (in Russian)].
40. Fracanzani A.L., Pisano G., Consonni D. et al. Epicardial Adipose Tissue (EAT) Thickness Is Associated with Cardiovascular and Liver Damage in Nonalcoholic Fatty Liver Disease // PLoS ONE. 2016. Vol. 11(9). e0162473. doi:10.1371/journal.pone.0162473.
41. Sookoian S. et al. Cardiovascular phenotype of nonalcoholic fatty liver disease: Hanging the paradigm about the role of distant toxic fat accumulation on vascular disease // Hepatology. 2012. Vol. 56(3). P. 1185–1186.
42. Targher G., Valbusa F., Bonapace S. et al. Non-Alcoholic Fatty Liver Disease Is Associated with an Increased Incidence of Atrial Fibrillation in Patients with Type 2 Diabetes // PLoS ONE. 2013. Vol. 8(2). e57183. doi:10.1371/journal.pone.0057183.
43. Ballestri S., Lonardo A., Bonapace S. et al. Risk of cardiovascular, cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease // World Journal of Gastroenterology: WJG. 2014. Vol. 20(7). P. 1724–1745. doi: 10.3748/wjg.v20.i7.1724.
44. Targher G., Valbusa F., Bonapace S. et al. Association of nonalcoholic fatty liver disease with QTc interval in patients with type 2 diabetes // Nutr Metab Cardiovasc Dis. 2014. Vol. 24. Р. 663‒669.
45. Ix J.H., Sharma K. Mechanisms Linking Obesity, Chronic Kidney Disease, and Fatty Liver Disease: The Roles of Fetuin-A, Adiponectin, and AMPK // Journal of the American Society of Nephrology: JASN. 2010. Vol. 21(3). P. 406–412. doi: 10.1681/ASN.2009080820.
46. Musso G., Gambino R., Tabibian J.H. et al. Association of Non-alcoholic Fatty Liver Disease with Chronic Kidney Disease: A Systematic Review and Meta-analysis. // PLoS Medicine. 2014. Vol. 11(7):e1001680. doi:10.1371/journal.pmed.1001680.
47. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease // J Hepatol. 2016. Vol. 64 (6). P. 1388–1402.
48. Chalasani N. Who should be screened for NASH? // Ann N Y Acad Sci. 2013. Vol. 1281. P.106–122.
49. Hart C., Morrison D., Batty G. et al. Effect of body mass index and alcohol consumption on liver disease: analysis of data from two prospective cohort studies // BMJ. 2010. Vol. 340. P. 1240.
50. Liu B. et al. Body mass index and risk of liver cirrhosis in middle aged UK women: prospective study // BMJ. 2010. Vol. 340. P. 912.
51. World Gastroenterology Organisation Global Guidelines Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis. June, 2012. www.who.org.
52. Yasutake K., Kohjima M., Kotoh K. et al. Dietary habits and behaviors associated with nonalcoholic fatty liver disease // World Journal of Gastroenterology: WJG. 2014. Vol. 20(7). P. 1756–1767. doi:10.3748/wjg.v20.i7.1756.
53. Ferolla S.M., Silva L.C., Ferrari M. de L.A. et al. Dietary approach in the treatment of nonalcoholic fatty liver disease // World Journal of Hepatology. 2015. Vol. 7(24). P. 2522–2534. doi:10.4254/wjh.v7.i24.2522.
54. Zelber-Sagi S., Ratziu V., Oren R. Nutrition and physical activity in NAFLD: An overview of the epidemiological evidence // World Journal of Gastroenterology: WJG. 2011. Vol. 17(29). P. 3377–3389. doi:10.3748/wjg.v17.i29.3377.
55. Promrat K., Kleiner D.E., Niemeier H.M. et al. Randomized Controlled Trial Testing the Effects of Weight Loss on Nonalcoholic Steatohepatitis (NASH) // Hepatology (Baltimore, Md). 2010. Vol. 51(1). P. 121–129. doi:10.1002/hep.23276.
56. Loria P., Adinolfi L.E., Bellentani S. et al. Practice guidelines for the diagnosis and management of nonalcoholic fatty liver disease. A decalogue from the Italian Association for the Study of the Liver (AISF) Expert Committee // Dig Liver Dis. 2010. Vol. 42(4). P. 272–282.
57. Castro-Quezada I., Sánchez-Villegas A., Estruch R. et al. A High Dietary Glycemic Index Increases Total Mortality in a Mediterranean Population at High Cardiovascular Risk // PLoS ONE. 2014. Vol. 9(9):e107968. doi:10.1371/journal.pone.0107968.
58. Zelber-Sagi S., Godos J., Salomone F. Lifestyle changes for the treatment of nonalcoholic fatty liver disease: a review of observational studies and intervention trials // Therapeutic Advances in Gastroenterology. 2016. Vol. 9(3). P. 392–407. doi:10.1177/1756283X16638830.
59. Jesch E.D., Carr T.P. Food Ingredients That Inhibit Cholesterol Absorption // Preventive Nutrition and Food Science. 2017. Vol. 22(2). P. 67–80. doi:10.3746/pnf.2017.22.2.67.
60. Lefebvre P., Cariou B., Lien F. et al. Role of bile acids and bile acid receptors in metabolic regulation // Physiol Rev. 2009. Vol. 89(1). P. 147–191. doi: 10.1152/physrev.00010.2008.
61. Watanabe M., Houten S.M., Mataki C. et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation // Nature. 2006. Vol. 26. P. 439(7075):484–489.
62. Willett W.C., Sacks F., Trichopoulou A. et al. Mediterranean diet pyramid: a cultural model for healthy eating. // Am J Clin Nutr. 1995. Vol. 61(6 Suppl). P. 1402S–1406S.
63. WHO/FAO (2003) Diet nutrition and the prevention of chronic diseases. Geneva, Switzerland. Available at www.who.int.
64. Hu F.B., Willett W.C. Optimal diets for prevention of coronary heart disease // JAMA. 2002. Vol. 27. P. 288(20):2569–2578.
65. Estruch R., Ros E., Salas-Salvadó J. et al. PREDIMED Study Investigators. Primary prevention of cardiovascular disease with a Mediterranean diet // N Engl J Med. 2013. Vol. 368(14). P.1279–1290.
66. Gunge V.B., Andersen I., Kyrø C. et al. Adherence to a healthy Nordic food index and risk of myocardial infarction in middle-aged Danes: the diet, cancer and health cohort study // Eur J Clin Nutr. 2017. Vol. 71(5). P. 652–658. doi: 10.1038/ejcn.2017.1. Epub 2017 Mar 1.
67. Sofi F., Casini A. Mediterranean diet and non-alcoholic fatty liver disease: New therapeutic option around the corner? // World Journal of Gastroenterology: WJG. 2014. Vol. 20(23). P. 7339–7346. doi:10.3748/wjg.v20.i23.7339.
68. Eckard C., Cole R., Lockwood J. et al. Prospective histopathologic evaluation of lifestyle modification in nonalcoholic fatty liver disease: a randomized trial // Therapeutic Advances in Gastroenterology. 2013. Vol. 6(4). P. 249–259. doi:10.1177/1756283X13484078.
69. Tzima N., Pitsavos C., Panagiotakos D.B. et al. Adherence to the Mediterranean diet moderates the association of aminotransferases with the prevalence of the metabolic syndrome; the ATTICA study // Nutr Metab (Lond). 2009. Vol. 6. P. 30.
70. Martinez-Gonzalez M.A., de la Fuente-Arrillaga C., Nunez-Cordoba J.M. et al. Adherence to Mediterranean diet and risk of developing diabetes: prospective cohort study // BMJ. 2008. Vol. 14. P. 336(7657):1348–1351.
71. Ryan M.C., Itsiopoulos C., Thodis T. et al. The Mediterranean diet improves hepatic steatosis and insulin sensitivity in individuals with non-alcoholic fatty liver disease // J Hepatol. 2013. Vol. 59(1). P. 138–143. doi: 10.1016/j.jhep.2013.02.012. Epub 2013 Feb 26.
72. Tuomilehto J., Lindström J., Eriksson J. et al. For the Finnish Diabetes Prevention Study Group. Prevention of Type 2 Diabetes Mellitus by Changes in Lifestyle among Subjects with Impaired Glucose Tolerance // N Engl J Med. 2001. Vol. 344. P. 1343–1350. doi: 10.1056/NEJM200105033441801.
73. Nadtochiy S.M., Redman E.K. Mediterranean diet and cardioprotection: the role of nitrite, polyunsaturated fatty acids and polyphenols // Nutrition (Burbank, Los Angeles County, Calif). 2011. Vol. 27(7–8). P. 733–744. doi:10.1016/j.nut.2010.12.006.
74. Simopoulos A.P. Human requirement for Ω-3 polyunsaturated fatty acids // Poult Sci. 2000. Vol. 79(7). P. 961–970.
75. Weber P.C., Leaf A. Cardiovascular effects of omega-3 fatty acids. Atherosclerosis risk factor modification by omega 3 fatty acids // W Rev Nutr Diet. 1991. Vol. 66. P. 218–232.
76. Rodriguez-Leyva D. et al. The cardiovascular effects of flaxseed and its omega-3 fatty acid, alpha-linolenic acid // Can J Cardiol. 2010. Vol. 26(9). P. 489–496.
77. Leyva D.R., Zahradka P., Ramjiawan B. et al. The effect of dietary flaxseed on improving symptoms of cardiovascular disease in patients with peripheral artery disease: rationale and design of the FLAX-PAD randomized controlled trial // Contemp Clin Trials. 2011. Vol. 32. P. 724–730.
78. Parker H.M., Johnson N.A., Burdon C.A. et al. Omega-3 supplementation and non-alcoholic fatty liver disease: a systematic review and meta-analysis // J Hepatol. 2012. Vol. 56(4). P. 944–951. doi: 10.1016/j.jhep.2011.08.018.
79. Sonne D.P., Knop F.K. Cardiovascular effects of alpha-linolenic acid—a possible role of glucagon-like peptide-1 // Exp Biol Med (Maywood). 2013. Vol. 238(10). P. 1116–1117. doi: 10.1177/1535370213503434.
80. Gundermann K.J., Kuenker A., Kuntz E., Drozdzik M. Activity of essential phospholipids (EPL) from soybean in liver diseases // PharmacolRep. 2011. Vol. 63. P. 643–659.
81. Kidd P.M. Cell membranes, endothelia, and atherosclerosis – the importance of Phosphatidylcholine // Altern Med Rev. 1996. Vol. 1. P. 148–167.
82. Un C., Zheng X., Tan Z. et al. Clinical Observation on Polyene Phosphatidyl Choline and Metformin in the Treatment of Type 2 Diabetes and Non-alcoholic Fatty Liver Disease // Clin Focus. 2008. Vol. 23 (17). P. 1272–1273.
83. Yin Kong. Observation for curative effect of Essentiale in treatment of fatty liver caused by diabetes mellitus // Med J Q ilu. 2000. Vol. 15. P. 277–278.
84. Guo S. Observation on treatment of fatty liver disease with polyene phosphatidylcholine // China Foreign Med J. 2007. Vol. 5. Issue 10.
85. Kuntz E., Kuntz H-D. Гепатология. Учебное пособие и атлас. 3 издание. Springer Press. Heidelberg. 2008. С. 896 [Kuntz E., Kuntz H-D. Gepatologija. Uchebnoe posobie i atlas. 3 izdanie. Springer Press. Heidelberg. 2008. S. 896 (in Russian)].
86. Sas E. et al. Beneficial influence of polyunsaturated phosphatidylcholine enhances functional liver condition and liver structure in patients with Nonalcoholic steatohepatitis accompanied by diabetes type 2 // J of Hepatology. 2013. Vol. 58. S549.
87. Mazzella N., Ricciardi L.M., Mazzotti A., Marchesini G. The role of medications for the management of patients with NAFLD // Clin Liver Dis. 2014. Vol. 18(1). P. 73–89. doi: 10.1016/j.cld.2013.09.005.
88. Hallsworth K., Avery L., Trenell M.I. Targeting Lifestyle Behavior Change in Adults with NAFLD During a 20-min Consultation: Summary of the Dietary and Exercise Literature // Curr Gastroenterol Rep. 2016. Vol. 18(3). P. 11. doi: 10.1007/s11894–016-0485-1.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru