Введение
Рак предстательной железы (РПЖ) в Российской Федерации занимает лидирующую позицию в структуре онкологических заболеваний среди мужского населения. По данным за 2023 г., зарегистрировано 57 373 случая заболевания. При этом на долю пациентов с I и II стадиями РПЖ приходится 18,0 и 47,2% случаев соответственно [1].
Низкодозная брахитерапия (БТ) в режиме монотерапии показана пациентам с локализованным РПЖ низкого и промежуточного риска [2], соответствующим следующим критериям: уровень простатспецифического антигена (ПСА) менее 10 нг/мл; сумма баллов по Глисону 6 (3 + 3) либо 7 (3 + 4) не более чем в 33% биоптатов; стадия T1c–T2aN0M0; объем предстательной железы (ПЖ) менее 50 см3(1). Согласно данным метаанализа 2020 г. [3], включающего 25 исследований с участием 61 752 пациентов, значимых различий в биохимической частоте рецидивов и смертности от РПЖ между БТ и радикальной простатэктомией (РПЭ) выявлено не было. Частота недержания мочи в группах РПЭ и БТ составила 21,8 и 9,7% соответственно (отношение шансов (OШ) 4,62, 95% доверительный интервал (ДИ) 2,33–9,16). Частота эректильной дисфункции в группах РПЭ и БТ составила 54,5 и 31,5% соответственно (OШ 2,06, 95% ДИ 1,15–3,70) [2]. Основываясь на многих объективных данных [4–9], можно сделать вывод, что БТ не только обеспечивает высокую эффективность по показателям выживаемости, но и способствует сохранению качества жизни пациентов. Данный аспект является важным и требует учета при выборе оптимальной тактики лечения на фоне высокой распространенности локализованных форм РПЖ.
Относительным противопоказанием к проведению низкодозной БТ является объем ПЖ более 50 см3 в сочетании с обструктивными нарушениями уродинамики, характеризующимися следующими изменениями: снижением максимальной скорости потока мочи (Qmax) менее 15 мл/с; наличием объема остаточной мочи (ООМ) более 50 мл; оценкой по шкале Международной системы суммарной оценки симптомов болезней предстательной железы (International Prostate Symptom Score, IPSS) более 15 баллов1. С 2017 г. в ФГБУ «РНЦРР» Минздрава России для подготовки пациентов к проведению низкодозной БТ и для коррекции обструктивных нарушений мочеиспускания используется трансуретральная резекция (ТУР) ПЖ. Несмотря на то, что в последние десятилетия с ТУР активно конкурируют такие технологии, как лазерная энуклеация и вапоризация ПЖ, ТУР вызывает интерес как метод подготовки пациентов к проведению низкодозной БТ, являясь малоинвазивной методикой с высокой эффективностью в отношении устранений нарушений мочеиспускания и низкой частотой осложнений [10–14]. К тому же ТУР позволяет модифицировать конфигурацию ПЖ для обеспечения оптимальных условий дальнейшего проведения БТ.
Цель исследования: изучить, как влияет ТУР ПЖ на показатели уродинамики и качество жизни пациентов с локализованным РПЖ до и после проведения низкодозной БТ.
Содержание статьи
Материал и методы
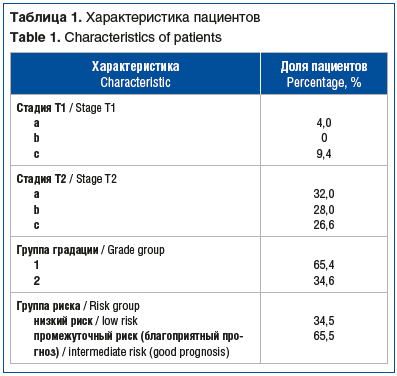
В исследование включено 168 пациентов, проходивших лечение в ФГБУ «РНЦРР» Минздрава России. В исследуемую и контрольную группы вошло по 84 пациента. Всем пациентам был поставлен морфологически подтвержденный диагноз: локализованный РПЖ (T1a–T2cN0M0) низкого и промежуточного риска (табл. 1).
Критериями включения в исследуемую группу являлись: выраженные симптомы обструктивного мочеиспускания (Qmax<15 мл/с; ООМ>50 мл; IPSS>15 баллов) в сочетании с доброкачественной гиперплазией ПЖ. Пациенты предъявляли жалобы на слабую струю мочи, прерывистое мочеиспускание, ощущение остаточной мочи после микции, частые позывы к мочеиспусканию, ноктурию до 3–4 раз. Критериями невключения являлись: объем ПЖ более 100 см3, наличие дивертикулов мочевого пузыря, а также наличие в анамнезе ТУР ПЖ, выполненной до установки диагноза РПЖ.
Средний возраст пациентов составил 68±6 лет. До начала лечения в исследуемой группе объем ПЖ >50 см3 имел место у 44 (52,4%) пациентов. Средний объем ПЖ составлял 52,6±22,4 см3. Снижение Qmax менее 15 мл/с наблюдалось у 76 (90,5%) пациентов. Среднее значение Qmax составило 8,71±3,8 мл/с. ООМ>50 мл имел место у 43 (51,2%) пациентов. До лечения средний ООМ составлял 74,1±59,7 мл, средняя скорость мочеиспускания — 4,4±2,0 мл/с. На этапе первичного обследования средний балл по IPSS составил 22,0±4,2, при этом у 67 (79,8%) пациентов оценка по шкале IPSS превышала 15 баллов При анализе сочетания факторов (объем ПЖ >50 см3; Qmax<15 мл/с; ООМ>50 мл; IPSS>15 баллов) у 74 (88,1%) пациентов присутствовало сочетание 3 и более компонентов обструктивного мочеиспускания.
На первом этапе всем пациентам проводилась неоадъювантная андрогендепривационная терапия (АДТ) аналогами гонадолиберина. Проведение АДТ в течение 3 мес. позволяет эффективно снизить объем ПЖ [15, 16]. Через 3–4 мес. после начала АДТ всем пациентам исследуемой группы выполнялась биполярная ТУР ПЖ под спинальной анестезией. Средняя длительность операции составила 32±14 мин, средний койко-день — 6±2. В качестве метода лечения РПЖ применялась низкодозная БТ с имплантацией микроисточников I125 суммарной очаговой дозой (СОД) 145 Гр. Средний интервал между ТУР ПЖ и БТ составил 6,71±2,32 мес. (от 3 до 14 мес.).
Контроль параметров уродинамики в исследуемой группе проводили: через 3 мес. после начала АДТ; через 3 мес. после ТУР ПЖ; через 3 и 12 мес. после проведения БТ. Выполняли урофлоуметрию для измерения объема мочеиспускания, максимальной и средней скорости потока мочи. ООМ оценивали в ходе ультразвукового исследования (УЗИ). Конфигурацию ТУР-дефекта (полости, сформированной после ТУР ПЖ) и объем удаленной ткани ПЖ оценивали с помощью магнитно-резонансной томографии (МРТ). Контроль уровня ПСА осуществляли ежемесячно на всех этапах лечения, включая период после БТ. Выраженность симптомов нарушений нижних мочевыводящих путей (СНМП) и качество мочеиспускания оценивали по опроснику IPSS. Для сравнительной оценки параметров использовали данные, полученные на предшествующем этапе лечения.
В контрольную группу вошли пациенты без обструктивных нарушений уродинамики нижних мочевыводящих путей. Средний возраст пациентов составил 66,5±6,2 года, средний объем ПЖ — 36,0±29,0 см3. У 15 (17,8%) пациентов объем ПЖ превышал 50 см3. Средний ООМ составил 14,5±20,8 мл. Всего у 6 (7,1%) пациентов ООМ превышал 50 см3. Средний показатель Qmax составил 18,0±9,0 мл/с. Всего у 15 (17,8%) пациентов Qmax составляла менее 15 мл/с. Средний балл IPSS составил 4,0±4,2. В контрольной группе не наблюдалось тяжелых СНМП по шкале IPSS (20–35 баллов). О легких СНМП (0–7 баллов) сообщили 64 (76,2%) пациента, об умеренных (8–19 баллов) — 20 (23,8%). Контрольной группе пациентов проводили низкодозную БТ микроисточниками I125 СОД 145 Гр без предшествующей ТУР.
Статистический анализ проводили с использованием программы StatTech v. 4.4.1 (ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова — Смирнова (при числе участников исследования более 50). Количественные данные при нормальном распределении описывали с помощью средней арифметической и стандартного отклонения (М±SD). Внутригрупповая динамика показателей приведена в процентных долях. Качественные показатели представлены в абсолютных и относительных (%) значениях. Между сравниваемыми параметрами внутри группы был проведен корреляционный анализ с расчетом коэффициента корреляции Пирсона. Статистическая значимость была рассчитана при помощи t-критерия Стьюдента. Межгрупповое сравнение проводили по выраженности СНМП по шкале IPSS и по оценке качества мочеиспускания, полученной с помощью опросника Quality of Life (QoL).Статистически значимыми считали различия при р<0,05. В результатах работы приведены только различия, имеющие статистическую значимость. Остальные значения приведены в описательном виде, без сравнения.
Исследование было одобрено этическим комитетом ФГБУ «РНЦРР» Минздрава России, все пациенты подписали информированное добровольное согласие на участие в исследовании.
Результаты исследования
В исследуемой группе через 3 мес. после начала АДТ объем ПЖ уменьшился на 15,8% относительно исходного уровня, среднее значение составило 44,3±15,2 см3 (p<0,05). Проведение ТУР ПЖ оказало наибольшее влияние на объем ПЖ: среднее значение в группе составило 28,8±9,8 см3, уменьшение относительно АДТ составило 35% (p<0,05). Через 3 мес. после проведения низкодозной БТ средний объем ПЖ относительно размеров после ТУР уменьшился на 6% (p<0,05) и составил 27,0±9,5 см3. Через 12 мес. после БТ объем ПЖ не показал статистически значимой динамики (p>0,05), составив 27,0±8,1 см3.
Через 3 мес. после начала АДТ среднее значение Qmax возросло на 13,7%, составив 9,9±4,2 мл/с (p<0,05). Наиболее значимое увеличение наблюдалось после ТУР ПЖ: прирост по группе составил 131,3% относительно этапа АДТ, среднее значение Qmax после ТУР — 22,9±8,1 мл/с (p<0,05). Через 3 мес. после низкодозной БТ показатель Qmax по группе снизился на 12,7% относительно ТУР ПЖ, среднее значение составило 20,0±6,5 мл/с (p<0,05). Через 12 мес. после БТ Qmax составила 21,9±6,6 мл/с, увеличение относительно предыдущего этапа составило 9,5% (p<0,05).
Через 3 мес. после АДТ средний ООМ снизился на 20,2% (p<0,05), до 59,1±61,4 мл. Проведение ТУР ПЖ позволило снизить ООМ на 81,3% относительно данных АДТ, среднее значение после ТУР составило 11,0±13,7 мл (p<0,05). Через 3 мес. после проведения низкодозной БТ снижение ООМ относительно ТУР не являлось статистически значимым и составило 0,64%, среднее значение ООМ — 11,0±14,1 мл. Через 12 мес. после БТ средний ООМ составил 11,0±12,3 мл, изменение относительно предшествующего этапа не являлось статистически значимым.
Через 3 мес. после проведения АДТ наблюдалось снижение баллов по IPSS на 11,4%, средний балл составил 19,5±5,0 (p<0,05). После ТУР ПЖ средний балл по IPSS снизился на 69,7% относительно АДТ и составил 5,9±3,8 (p<0,05). Через 3 мес. после БТ отмечен прирост баллов по IPSS на 11,9%, оценка составила в среднем 6,6±4,2 балла (p<0,05). Через 12 мес. после БТ средний балл по IPSS составил 4,1±4,5, снижение относительно данных через 3 мес. после БТ составило 38% (p<0,05).
Примечательно распределение пациентов по степени выраженности CНМП (рис. 1). До начала лечения в исследуемой группе не было пациентов с легкими СНМП (0–7 баллов по IPSS). Проведение АДТ не повлияло на данный показатель. После проведения ТУР ПЖ 60 (71,4%) пациентов сообщили о СНМП легкой степени. Через 12 мес. после БТ у 71 (84,5%) пациента присутствовали легкие СНМП.
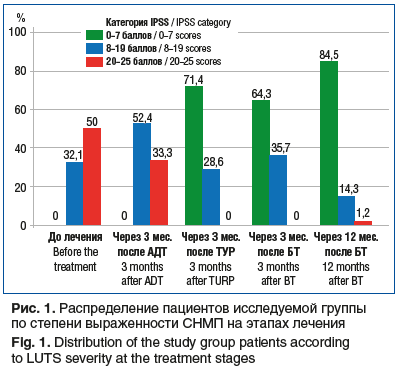
До начала лечения 27 (32,1%) пациентов сообщили о наличии СНМП средней степени выраженности (8–19 баллов). Через 3 мес. после АДТ 44 (52,4%) пациента сообщили о средней выраженности СНМП. Данный прирост обусловлен улучшением состояния пациентов, отмечавших тяжелые СНМП до проведения АДТ. После проведения ТУР ПЖ СНМП средней выраженности присутствовали у 24 (28,5%) пациентов. Через 12 мес. после БТ наличие СНМП средней степени констатировали 12 (14,3%) пациентов.
До лечения выраженные СНМП (20–35 баллов) отмечали 42 (50,0%) пациента, после АДТ — 28 (33,3%) пациентов. После проведения ТУР ПЖ выраженных СНМП в группе не наблюдалось. Через 12 мес. после БТ 1 (1,1%) пациент сообщил о наличии выраженных СНМП (см. рис. 1).
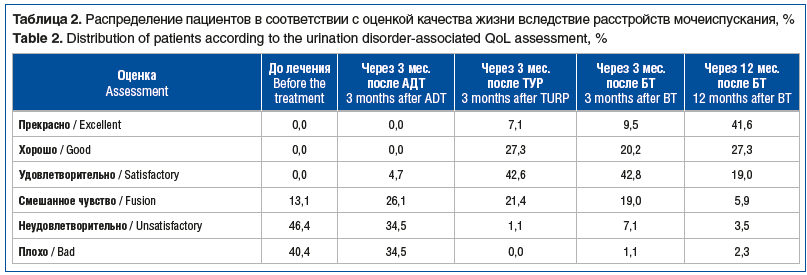
В исследовании оценивалась готовность пациентов жить с имеющимся качеством мочеиспускания без дальнейшего лечения. Оценка динамики баллов показала, что ТУР ПЖ значительно увеличила количество положительных оценок («прекрасно», «хорошо» и «удовлетворительно»). При этом общая положительная оценка пациентами качества мочеиспускания сохранялась через 3 и 12 мес. после проведения БТ. До лечения ни один из пациентов не указывал в анкете параметры «прекрасно», «хорошо», «удовлетворительно», после ТУР ПЖ 65 (77%) пациентов положительно оценили качество мочеиспускания. Через 12 мес. после проведения БТ 74 (88%) пациента положительно оценили качество мочеиспускания. Подробная динамика оценки пациентами качества мочеиспускания представлена в таблице 2.
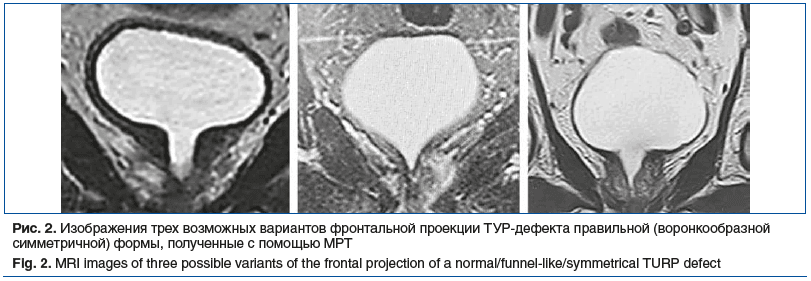
Трансуретральная резекция ПЖ выполнялась с соблюдением технологии, обеспечивающей оптимальные условия для дальнейшего проведения БТ. Одним из ключевых факторов, влияющих на параметры уродинамики, является форма ТУР-дефекта. В нашем исследовании правильной формы ТУР-дефекта с ровными краями, симметричной воронкообразной конфигурации удалось достичь у 43 (51,1%) пациентов (рис. 2). В 41 (48,8%) случае в структуре ТУР-дефекта присутствовали неровности, карманы, асимметрия.
Для расчета корреляции использовали данные, полученные через 3 мес. после проведения БТ. Установлена положительная связь между наличием ровного ТУР-дефекта и скоростью мочеиспускания (r=0,64).
Кроме того, у пациентов с ровным ТУР-дефектом показатель Qmax — 23,1±6,5 мл/с — был статистически значимо выше, чем у пациентов с неровным ТУР-дефектом, у которых этот показатель составил 16,7±4,7 мл/с (p<0,05).
Также выявлена умеренная отрицательная корреляция между наличием ровного ТУР-дефекта и баллами по IPSS (r=-0,49).
По данным литературы [11], объем резекции ПЖ более 25% от общего объема ПЖ связан с риском развития недержания мочи в постимплантационном периоде, однако у 48 (57%) пациентов исследуемой группы объем резекции ПЖ составил более 25% от общего объема, при этом случаев недержания мочи после проведения БТ не выявлено. Выявлена слабая положительная корреляция (r=0,2) между объемом резекции ПЖ и скоростью мочеиспускания. Для объема удаленной ткани ПЖ и значения IPSS через 3 мес. после БТ выявлена слабая отрицательная корреляция (r=-0,1). Не выявлено корреляции между объемом резекции ПЖ и ООМ, что демонстрирует отсутствие зависимости между этими показателями. Вне зависимости от объема удаленной ткани ПЖ, биохимического рецидива за 12 мес. после БТ в исследуемой группе не наблюдалось (r=0).
При сравнении данных исследуемой группы пациентов с контрольной группой по выраженности СНМП с использованием опросника IPSS через 12 мес. после БТ было показано, что средний балл в контрольной группе составил 5,3±5,1, в исследуемой группе — 4,1±4,5. Через 12 мес. после БТ в исследуемой группе не наблюдалось более выраженных СНМП в сравнении с контрольной группой, что позволяет предположить, что проведение ТУР не способствует увеличению риска развития СНМП после проведения БТ. Кроме того, средний балл по IPSS у пациентов с ровным ТУР-дефектом составил 4,1±3,5, с неровным ТУР-дефектом — 7,9±4,3 (p<0,05). Вероятно, ТУР-дефект симметричной воронкообразной формы и с ровными краями снижает риск проявления выраженных СНМП после проведения БТ.
Через 12 мес. после БТ 74 (88%) пациента исследуемой группы оценили качество мочеиспускания по шкале QoL в положительном ключе («прекрасно», «хорошо», «удовлетворительно»). В группе контроля 73 (86,9%) пациента положительно оценили качество мочеиспускания.
Общая 5-летняя выживаемость пациентов исследуемой группы составила 100%. Пятилетняя канцерспецифическая выживаемость составила 100%. Биохимический рецидив выявлен у 2 (2,3%) пациентов на 62-м и 64-м месяцах наблюдения. При обследовании у одного из пациентов подтвержден местный рецидив, тогда как у второго выявлены отдаленные метастазы.
Обсуждение
По данным литературы [17–20], ТУР ПЖ не оказывает влияния на течение РПЖ, что было подтверждено и в данной работе. Проведение ТУР ПЖ перед низкодозной БТ позволило значительно улучшить показатели уродинамики (Qmax, ООМ) и снизить выраженность СНМП (баллы по IPSS) в исследуемой группе. ТУР ПЖ позволила увеличить значение Qmax большинства пациентов. Через 12 мес. после БТ не наблюдалось клинически значимого снижения достигнутого эффекта в отношении скорости мочеиспускания, ООМ и баллов по IPSS, при этом показатели в исследуемой группе оставались не ниже аналогичных показателей в контрольной группе, в которой до начала лечения не было выраженных нарушений уродинамики.
Сравнение с группой контроля показало, что проведение ТУР не связано с увеличением частоты недержания мочи и наличием более выраженных СНМП через 12 мес. после проведения низкодозной БТ, следовательно, ТУР ПЖ может быть использована при подготовке пациентов с обструктивными нарушениями уродинамики к проведению низкодозной БТ I125.
Для выполнения ТУР как этапа подготовки к низкодозной БТ важен отбор пациентов — больные с неоднократными ранее выполненными ТУР имеют повышенный риск развития СНМП после БТ. У пациентов с двумя или более ТУР ПЖ в анамнезе необходим тщательный анализ МРТ-изображений актуального состояния ПЖ и ТУР-дефекта. При наличии послеоперационного дефекта избыточного объема, неудовлетворительной конфигурации, с отсутствующей периферической тканью ПЖ по краям резекции следует рассмотреть иные варианты лечения, помимо БТ.
Пациентов с увеличенным объемом ПЖ (более 70 см3) следует информировать о рисках отсутствия значимого эффекта от ТУР, так как механизм обструкции в данном случае связан с воздействием увеличенных долей ПЖ на простатическую часть уретры и частичная резекция может быть неэффективна для клинически значимого улучшения качества мочеиспускания. Подкапсульное удаление долей ПЖ нецелесообразно из-за невозможности имплантации микроисточников I125 в данные зоны при БТ. В нашей работе использовалось интраоперационное трансректальное УЗИ (ТРУЗИ) ПЖ как способ дополнительной визуализации конфигурации ТУР-дефекта. Используя ТРУЗИ-визуализацию, возможно точно контролировать объем резекции ПЖ, симметрию ТУР-дефекта и объем остаточной ткани по краям ТУР-дефекта.
С целью повышения комплаентности следует информировать пациентов об этапах и времени лечения, составляющих в среднем 3 мес. от проведения АДТ до ТУР ПЖ и 4–6 мес. от ТУР ПЖ до БТ.
Выводы
Проведение ТУР ПЖ позволяет эффективно устранить обструктивные нарушения мочеиспускания у пациентов с локализованным РПЖ, которым планируется проведение БТ.
Проведение ТУР ПЖ перед БТ не связано с увеличением выраженности СНМП в постимплантационном периоде.
Проведение ТУР ПЖ перед БТ требует соблюдения технологии операции для достижения лучших результатов в отношении уродинамических показателей и выраженности СНМП.
СВЕДЕНИЯ ОБ АВТОРАХ:
Павлов Андрей Юрьевич — д.м.н., профессор, хирург, онколог, уролог, главный врач ФГБУ ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-2905-7735
Дзидзария Александр Гудисович — д.м.н., уролог, онколог, андролог, заведующий онкоурологическим отделением ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0001-5789-375X
Цыбульский Алексей Дмитриевич — д.м.н., старший научный сотрудник отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-1647-6180
Халиль Илья Иссаевич — уролог, онколог, младший научный сотрудник онкоурологического отделения ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-8848-7815
Калиниченко Арина Анатольевна — клинический ординатор по специальности «урология» онкоурологического отделения ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0009-0002-0948-4964
Штефан Павел Дмитриевич — клинический ординатор по специальности «онкология» онкоурологического отделения ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0009-0007-6061-4652
Контактная информация: Халиль Илья Иссаевич, e-mail: geralt@nextmail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 24.01.2025.
Поступила после рецензирования 18.02.2025.
Принята в печать 13.03.2025.
ABOUT THE AUTHORS:
Andrey Yu. Pavlov — Dr. Sc. (Med.), Professor, Surgeon, Oncologist, Urologist, Chief Physician of Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya st., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2905-7735
Alexander G. Dzidzaria — Dr. Sc. (Med.), Urologist, Oncologist, Andrologist, Head of the Department of Oncourology, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-5789-375X
Alexey D. Tsibulskyii — C. Sc. (Med.), Urologist, Oncologist, Senior Scientific Officer, Department of Oncourology, Russian Scientific Center of Roentgenology and Radiology, Head of the Urology Clinic; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-1647-6180
Il’ya I. Khalil’ — Urologist, Oncologist, Junior Scientific Officer of the Department of Oncourology, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-8848-7815
Arina A. Kalinichenko — Urology Clinical Resident of the Department of Oncourology, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation;ORCID iD 0009-0002-0948-4964
Pavel D. Shtefan — Oncology Clinical Resident of the Department of Oncourology, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0009-0007-6061-4652
Contact information: Il’ya I. Khalil’, e-mail: geralt@nextmail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 24.01.2025.
Revised 18.02.2025.
Accepted 13.03.2025.
1Клинические рекомендации. Рак предстательной железы. 2021. (Электронный ресурс.) URL: https://disuria.ru/_ld/12/1277_kr21C61MZ.pdf (дата обращения: 27.02.2025).
Информация с rmj.ru
