Введение
Рак предстательной железы (РПЖ) является актуальной проблемой современной онкоурологии и обусловливает высокие показатели заболеваемости и смертности среди мужского населения в России и в мире. В структуре заболеваемости и смертности от злокачественных новообразований (ЗНО) мужского населения России РПЖ занимает 2-е (15,7%) и 3-е (8,4%) место соответственно, уступая ЗНО трахеи, бронхов, легкого и желудка. Темп среднегодового прироста заболеваемости РПЖ в Российской Федерации составляет 3,9% [1].
Ранняя диагностика является ключевым фактором, определяющим тактику ведения пациентов и влияющим на показатели выживаемости. Современный алгоритм диагностики РПЖ включает проведение пальцевого ректального исследования ПЖ, определение уровня простатического специфического антигена (ПСА) в крови и биопсию ПЖ с последующим морфологическим исследованием биоптата. Методика исследования уровней свободного и связанного ПСА в крови была разработана в конце 20-го столетия и широко вошла в клиническую практику. Однако верификация диагноза РПЖ возможна только по результатам морфологического исследования, биологический материал для которого в большинстве случаев получают с помощью трансректальной биопсии ПЖ. Информативность метода в среднем составляет 75% [2–4].
Пункционная биопсия ПЖ выполняется под визуальным контролем, основным и наиболее информативным на сегодняшний день является ультразвуковой метод [5–6]. Чувствительность метода в ранней диагностике РПЖ составляет 60–65%. Высокоэффективно также проведение биопсии под контролем МРТ [7–8], что повышает диагностическую значимость метода на 20%. Точность метода, по данным литературы, составляет 86%.
Цель исследования: анализ результатов трансректальных полифокальных биопсий ПЖ под контролем УЗИ, выполненных в период 2021–2022 гг. пациентам, проходившим обследование и лечение на базе ЧУЗ «КБ «РЖД-Медицина» г. Красноярск» (далее — КБ РЖД).
Содержание статьи
Материал и методы
Обследование, диагностика и наблюдение пациентов проводились на базе отделения урологии КБ РЖД. Осмотр и обследование пациентов включали: сбор анамнеза заболевания и оценку симптомов (затрудненное или учащенное мочеиспускание, чувство неполного опорожнения мочевого пузыря, дискомфорт или болезненность над лоном, ноктурия), определение уровня общего ПСА (ПСАобщ.) в сыворотке крови, УЗИ ПЖ и определение объема остаточной мочи.
Наличие у пациента характерных жалоб и отклонение от референсных значений хотя бы в одном из перечисленных выше результатов обследования являлись показаниями для выполнения диагностической биопсии ПЖ.
Пациентов информировали о предстоящей процедуре с последующим подписанием информированного добровольного согласия на медицинское вмешательство. Всем пациентам проводились стандартные общеклинические исследования: общий анализ крови, общий анализ мочи, коагулограмма, определение группы крови и резус-фактора, ЭКГ. Накануне выполнялась очистительная клизма, а также назначалась антибактериальная терапия с целью профилактики инфекционных осложнений [9–11].
Диагностическая процедура проводилась с применением местной анестезии, под контролем аппарата УЗИ и с помощью биопсийного пистолета марки Bard® Magnum® (U.S. Patent 5.546.957), использовалась пункционная игла с поперечным сечением 16G длиной 20 см. Сначала проводили контрольное трансректальное УЗИ. Затем в канал пункционного адаптера вводили пункционную иглу, заряженную в биопсийный пистолет. Иглу подводили непосредственно к ткани ПЖ или к зоне патологических изменений в структуре железы и проводили биопсию. Направление пункционного забора определяли в каждом случае индивидуально (общее количество биоптатов у одного пациента составляло 10–12). После выполнения биопсии биоптаты фиксировали в пробирке с раствором формалина и направляли на гистологическое исследование.
При гистологическом исследовании биоматериала, кроме установления наличия ЗНО в биоптате, анализировали следующие дополнительные показатели: 1) степень дифференцировки опухоли по шкале Глисона; 2) процент ткани со злокачественными изменениями в биоптате ПЖ; 3) наличие очагов простатической интраэпителиальной неоплазии (ПИН) и степень ее выраженности, хронического простатита; 4) определение прогностической группы в случае подтвержденного РПЖ.
Обработку данных, полученных в результате исследования, выполняли с помощью программы Statistica 6.1.
Результаты исследования
В общей сложности проанализированы результаты 220 трансректальных пункционных биопсий ПЖ под контролем УЗИ, выполненных с целью ранней диагностики РПЖ у пациентов, находившихся в урологическом отделении КБ РЖД.
Большинство пациентов были жителями города Красноярска — 166 (75,45%) человек и Красноярского края — 54 (24,55%) человека. Медиана возраста пациентов составила 64 (44–89) года.
По результатам гистологического исследования ДГПЖ диагностирована у 112 (51%) человек, РПЖ — у 108 (49%).
Уровень ПСАобщ. в группе пациентов с ДГПЖ варьировал в диапазоне 0,48–37,9 нг/мл, в группе пациентов с РПЖ — в диапазоне 4,48–100,0 нг/мл.
Медиана уровня ПСАобщ. в сыворотке крови составила 51 (0,48–100) нг/мл. Уровень ПСАобщ. менее 4,0 нг/мл наблюдался у 6 (5,4%) пациентов, которым по результатам гистологического исследования биоптата был поставлен диагноз ДГПЖ. Уровень ПСАобщ. 4,0–10,0 нг/мл наблюдался у 108 (49,09%) пациентов: у 47 человек диагностирована ацинарная аденокарцинома и у 61 человека — ДГПЖ. Уровень ПСАобщ. >10,0 нг/мл наблюдался у 106 (48,19%) больных, из которых у 61 человека диагностирована ацинарная аденокарцинома, у 45 человек — ДГПЖ.
У 73 (33,18%) человек по данным УЗИ выявлена остаточная моча. При сборе анамнеза 198 (90%) пациентов отмечали выраженные симптомы заболевания: затрудненное или учащенное мочеиспускание, чувство неполного опорожнения мочевого пузыря, дискомфорт или болезненность над лоном, ноктурию; только 22 (10%) пациента не имели клинических симптомов. Объем остаточной мочи по УЗИ простаты в группе РПЖ определялся у 36 (33,3%%) пациентов, медиана составила 307,51 (7,01–608,90) мл, в группе ДГПЖ — у 37 (33%) пациентов, медиана 152,01 (4,40–300,00) мл.
Медиана объема ПЖ по данным УЗИ составила 94,51 (10,26–185,50) см3. В таблице 1 представлено распределение пациентов в зависимости от объема ПЖ и окончательного диагноза (ДГПЖ или РПЖ). В группе больных РПЖ медиана объема ПЖ составила 74,61 (10,26–134,80) см3, а в группе ДГПЖ — 153,45 (116,22–185,50) см3.
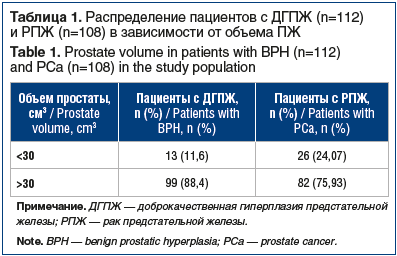
У некоторых пациентов старше 55 лет объем простаты по данным УЗИ оставался в пределах возрастной нормы, несмотря на выявленную по результатам биопсии доброкачественную и злокачественную гиперплазию. Так, медиана объема ПЖ у 25 пациентов с ДГПЖ составила 34,71 (30,14–39,90) см3 и у 24 пациентов с РПЖ — 35,61 (31,71–39,70) см3.
У всех пациентов с ДГПЖ по заключению гистологического либо иммуногистохимического (ИГХ) исследования были выявлены морфологические признаки железисто-стромальной узловой гиперплазии, хроническое воспаление с очагами простой, склеротической атрофии, гиперплазии базального эпителия. Однако 60 (53,6%) пациентам с ДГПЖ из 112 требовалось уточняющее ИГХ-исследование. По результатам ИГХ-исследования у 16 (14,28%) человек диагностирована ПИН высокой степени риска. У 13 (11,6%) человек диагностированы участки атипической аденоматозной гиперплазии (аденоза). При этом во всех случаях сохранялось подозрение в отношении ацинарной аденокарциномы, поэтому всем без исключения пациентам было рекомендовано динамическое наблюдение, контроль уровня ПСА и в случае стойкого повышения последнего — проведение повторной биопсии ПЖ.
Из 220 обследованных пациентов диагноз РПЖ подтвержден у 108 человек. При этом у 87 человек диагноз был подтвержден на первом этапе (гистологически) и 21 человеку потребовалась дополнительная диагностика (ИГХ).
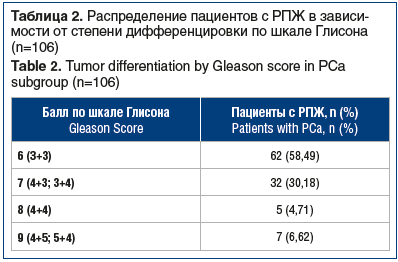
Степень дифференцировки по шкале Глисона удалось оценить у 106 пациентов с РПЖ (табл. 2). У одного пациента с ацинарной аденокарциномой не удалось оценить степень дифференцировки по Глисону вследствие малого объема субстрата. Еще у одного обследуемого иммуноморфологическая картина по результатам ИГХ-исследования соответствовала мелкоклеточной нейроэндокринной карциноме (NEC) ПЖ.
Как видно из таблицы 2, у пациентов с РПЖ преобладали умеренно дифференцированные (≤7 баллов по шкале Глисона) опухоли, что позволяет судить об удовлетворительной ранней выявляемости РПЖ. Объем поражения опухолью ткани ПЖ в биоптате составлял 5–70%. У 9 (8,3%) пациентов с РПЖ диагностирована ПИН микропапиллярного варианта высокой степени риска.
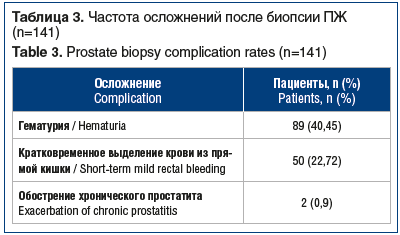
Осложнения после биопсий ПЖ наблюдались у 141 (64,09%) пациента (табл. 3). Все осложнения были купированы консервативно.
Таким образом, трансректальная полифокальнаябиопсия ПЖ под контролем УЗИ с последующим морфологическим исследованием является высокоэффективным и достаточно безопасным методом диагностики новообразований ПЖ. Данная методика позволяет быстро получить достоверный диагноз и уточнить степень злокачественности и локорегионарной распространенности опухолевого процесса, что существенно влияет на выбор тактики лечения у каждого конкретного пациента.
Обсуждение
Результаты нашего анализа показали, что объем ПЖ по данным УЗИ и уровень ПСАобщ. в сыворотке крови пациентов не всегда были ассоциированы с наличием ЗНО простаты. Так, РПЖ выявлен в том числе у пациентов с объемом ПЖ в пределах возрастной нормы, тогда как у ряда пациентов с ДГПЖ объем железы существенно превышал нормальные значения. Аналогичным образом и повышение уровня ПСАобщ. в сыворотке крови по сравнению с референсными значениями наблюдалось в обеих группах пациентов и не всегда было связано с наличием РПЖ. Эти находки согласуются с данными литературы и крупных многоцентровых исследований [12, 13], однако необходим детальный корреляционный анализ, чтобы подтвердить полученные результаты.
При первичной диагностике РПЖ перед диагностической биопсией рекомендовано выполнение МРТ-исследования ПЖ с оценкой результатов по шкале PI-RADS [8]. Однако в нашей работе этот метод не учитывался и акцент был сделан на анализ широкодоступных методов скрининга и ранней диагностики РПЖ. Мы также не рассматривали другие методы для выполнения биопсии ПЖ, кроме трансректальной пункционной биопсии под контролем УЗИ. А также не рассматривали другие лабораторные и клинические характеристики пациентов, которые потенциально могли оказать влияние на результаты исследования. Нельзя полностью исключить наличие и ряда других факторов, которые не учитывались при анализе данных и могли оказать влияние на полученные результаты.
Заключение
Даже при невысоких значениях ПСА может быть диагностирован РПЖ. В исследуемой популяции пациентов, проходивших обследование в КБ РЖД, преобладали умеренно дифференцированные (≤7 баллов по шкале Глисона) ЗНО, что позволяет судить об удовлетворительной ранней выявляемости РПЖ. При проведении диагностической биопсии ПЖ важен динамический контроль в раннем послеоперационном периоде для предотвращения возможных осложнений.
Сведения об авторах:
Бережной Александр Григорьевич — д.м.н., доцент кафедры урологии, андрологии и сексологии ИПО ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; заведующий отделением урологии ЧУЗ «КБ «РЖД-Медицина» г. Красноярск»; 660058, Россия, г. Красноярск, ул. Ломоносова, стр. 47; ORCID iD 0000-0002-7487-8671.
Дунаевская Светлана Сергеевна — д.м.н., профессор кафедры общей хирургии имени профессора М.И. Гульмана ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; руководитель научного кабинета ЧУЗ «КБ «РЖД-Медицина» г. Красноярск»; 660058, Россия, г. Красноярск, ул. Ломоносова, стр. 47; ORCID iD 0000-0003-2820-4737.
Аузина Софья Игоревна — врач-уролог отделения урологии ЧУЗ «КБ «РЖД-Медицина» г. Красноярск»; 660058, Россия, г. Красноярск, ул. Ломоносова, стр. 47; ORCID iD 0000-0002-5230-8395.
Контактная информация: Дунаевская Светлана Сергеевна, e-mail: vikto-potapenk@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 08.06.2022.
Поступила после рецензирования 02.07.2022.
Принята в печать 25.07.2022.
About the authors:
Alexander G. Berezhnoy — Dr. Sc. (Med.), Associate Professor of the Department of Urology, Andrology and Sexology, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; Head of the Department of Urology, Clinical Hospital «RZD-Meditsina» of the city of Krasnoyarsk; 47, Lomonosov str., Krasnoyarsk, 660058, Russian Federation; ORCID iD 0000-0002-7487-8671.
Svetlana S. Dunaevskaya — Dr. Sc. (Med.), Professor of the Department of General Surgery named after Prof. M.I. Gulman, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; Head of the Scientific Cabinet, Clinical Hospital «RZD-Meditsina» of the city of Krasnoyarsk; 47, Lomonosov str., Krasnoyarsk, 660058, Russian Federation; ORCID iD 0000-0003-2820-4737.
Sofya I. Auzina — urologist of the Department of Urology, Andrology and Sexology, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-5230-8395.
Contact information: Svetlana S. Dunaevskaya, e-mail: vikto-potapenk@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 08.06.2022.
Revised 02.07.2022.
Accepted 25.07.2022.
Информация с rmj.ru
