Введение
Колоректальный рак (КРР) остается значимой проблемой современной онкологии, которая, согласно данным мировой статистики за 2022 г., занимает 4-е место в структуре онкологической заболеваемости и 5-е место в структуре смертности от злокачественных новообразований. Так, в 2022 г. в мире было выявлено 5 767 000 новых случаев и более 900 000 человек погибли от КРР1. Однако следует отметить стойкую позитивную тенденцию в отношении как заболеваемости, так и смертности среди представителей обоих полов, особенно выраженную на протяжении последних 20 лет [1]. Это является отражением как усовершенствования методов диагностики, что позволяет установить диагноз на более ранних стадиях, выделения отдельных подтипов болезни, имеющих свои морфогенетические особенности и разную чувствительность к различным противоопухолевым агентам, так и, конечно, появления новых методов лечения, развитие и внедрение которых в клиническую практику основано на понимании разнообразия КРР.
В европейских странах показатель заболеваемости несколько выше общемировых данных, и по распространенности КРР занимает 2-е место среди мужчин (после рака предстательной железы) и 3-е место в онкологической заболеваемости женщин, уступая лишь раку молочной железы и раку шейки матки1. Следует отметить, что более половины случаев КРР приходится на пациентов старше 70 лет с показателем заболеваемости 135,6 на 100 000 населения в диапазоне 70–75 лет, который увеличивается до 234,7 на 100 000 в возрасте старше 85 лет. Это становится важным для повседневной практики с учетом существенного увеличения числа людей, доживающих до такого возраста [1].
Несмотря на все усилия, прилагаемые для выявления КРР на ранних стадиях, приходится констатировать, что в мире каждому пятому пациенту диагноз устанавливается на IV стадии с наличием отдаленных метастазов. В России в 2023 г. на момент постановки диагноза более 25% больных имели метастатическую стадию. Кроме того, следует помнить, что приблизительно у 50% больных с исходно локализованным процессом в течение 1 года реализуются отдаленные метастазы2 [2]. Изучив статистику за 10-летний период в РФ, можно отметить общемировую четкую динамику в увеличении заболеваемости, что более вероятно связано с усовершенствованием методов диагностики, при снижении уровня годичной летальности, которая в 2023 г. составила 18,2–20,6% для рака прямой и ободочной кишки соответственно [2].
Содержание статьи
Мутация в гене BRAF при КРР
Наличие мутации в гене BRAF (далее — мутации BRAF) при КРР определяет особый биологический тип опухоли с характерным для него более агрессивным течением, плохим ответом на традиционную терапию, нечувствительностью к анти-EGFR (epidermal growth factor receptor, рецептор эпидермального фактора роста) агентам, но при этом имеющий мишени для применения таргетных препаратов. Сигнальный путь митоген-активируемой протеинкиназы (mitogen-activated protein kinase, MAPK), в который вовлечены киназы RAF, представляет собой главный каскад передачи сигнала, регулирующий рост клеток. Этот путь часто имеет повышенную активность при различных злокачественных новообразованиях. И именно гомолог В киназы RAF, кодируемый геном BRAF, является ключевым белком, ответственным за канцерогенез у человека [3–5]. Мутации BRAF могут быть разнообразными, но наиболее часто наблюдается замена аминокислоты валина в позиции 600 гена BRAF (V600) на другую аминокислоту — глутаминовую кислоту (E). Другие замены встречаются крайне редко [6–8]. Точное указание варианта мутации в заключении морфолога является крайне важным, так как ряд нарушений не имеют клинического значения. Мутации V600 относятся к мутациям класса I, при которых и отмечена эффективность BRAF-ингибиторов [9]. При КРР мутации BRAF обнаруживаются приблизительно у 8–10% пациентов, более 95% среди них приходится именно на мутацию V600E. Еще один немаловажный аспект, на который следует обратить внимание, — это последовательность определения мутаций. Мутации RAS и BRAF являются взаимоисключающими. В связи с этим, с учетом того, что частота обнаружения мутаций RAS при КРР приближается к 50%, в случае последовательного поиска мутаций (например, методом ПЦР или секвенирования по Сэнгеру), сначала следует определить мутации в генах семейства RAS, и только при их отсутствии необходимо исследовать мутации в гене BRAF [10–16]. В 2021 г. большой группой отечественных исследователей был проведен анализ частоты встречаемости мутаций BRAF при КРР в российской популяции. В исследование вошли данные 8648 заключений лабораторий из 7 медицинских учреждений из разных регионов России, среди которых у 437 (5,17%) пациентов была выявлена мутация BRAF (что оказалось практически в 2 раза ниже, чем в Европе) [17].
Мутации BRAF могут сочетаться с такими молекулярными подтипами КРР, как опухоли с микросателлитно-нестабильным (microsatellite instable, MSI) фенотипом, что заставляет выстраивать для них особую последовательность применения лечебных опций [10, 11, 18–22]. Объединенный анализ пациентов из нескольких исследований позволил заключить, что на метастатической фазе КРР около 5% пациентов имеют опухоли с фенотипом MSI, среди которых почти у 35% может быть обнаружена мутация BRAF V600E [23]. Хорошо известно, что вероятность обнаружения мутаций BRAF определяется в том числе и стороной локализации первичного очага. Более часто BRAF-мутированные опухоли локализуются в правой половине толстой кишки. В упомянутом российском исследовании опухоли с мутациями BRAF также наиболее часто локализовались в восходящем отделе ободочной кишки и прямой кишке [24, 25]. Опухоли, несущие мутации BRAF, характеризуются более агрессивным течением и неблагоприятным прогнозом. Согласно данным, опубликованным в 2016 г., среди 1000 больных КРР с микросателлитно-стабильным (microsatellite stable, MSS) фенотипом при развитии отдаленных метастазов в случае дикого типа генов RAS и BRAF медиана общей выживаемости (мОВ) превысила 2,5 года, при наличии мутации KRAS — 2 года и была лишь около 1 года при обнаружении мутации BRAF. Но, возможно, сегодня абсолютные цифры выглядели бы несколько иначе с учетом того, что в те годы доступ к различным вариантам таргетной терапии был более ограничен, чем сейчас [26].
Прогностическое значение мутации BRAF
Как было отмечено выше, при КРР мутации BRAF наиболее часто представлены мутацией V600E, и именно ее наличие сопряжено с наиболее неблагоприятным прогнозом. Мутации BRAF не-V600E составляют немногим более 20%. Согласно данным, опубликованным в 2017 г., мОВ пациентов с момента постановки диагноза при наличии мутаций BRAF не-V600E в сравнении с BRAF V600E составили 60,7 мес. и всего лишь 11,4 мес. соответственно [12]. Мутации не-V600E чаще встречаются в более молодом возрасте, чаще у мужчин, реже в опухолях G3 и при правосторонней локализации первичного очага [12, 27, 28]. В научной литературе представлено несколько публикаций исследований реальной клинической практики, подтверждающих более агрессивное течение КРР при наличии в опухоли мутации BRAF V600E. В европейском многоцентровом ретроспективном наблюдательном исследовании CAPSTAN CRC, объединившем 255 больных, было показано, что 66,4% больных на момент постановки диагноза имели отдаленные метастазы (по мировым данным, для всей популяции КРР этот показатель составляет 20%); у 44% выявлялись перитонеальные метастазы, хуже отвечающие на стандартные режимы лекарственной терапии; у 58% были обнаружены метастазы в печени, и чуть более половины больных с мутацией BRAF V600E смогли получить 2-ю линию терапии [29]. Еще меньше пациентов смогли получить 2-ю линию лечения согласно результатам еще двух исследований: в клиническом исследовании III фазы COIN 2-ю линию получили 33% пациентов, а по данным когортного наблюдательного исследования реальной клинической практики, проведенного канадскими и американскими исследователями и опубликованного в 2020 г., таких оказалось еще меньше — только 26,2% [30]. По данным российского исследования, при мКРР с мутацией BRAF также чаще наблюдалось метастатическое поражение печени и брюшины в сравнении с другой локализацией отдаленных очагов [17].
Тестирование на мутацию BRAF
Для анализа на наличие мутации BRAF могут быть использованы образцы ткани опухоли и метастазов или жидкостной биопсии, где исследуют циркулирующую опухолевую ДНК. Мутации BRAF могут быть обнаружены с помощью широкого спектра молекулярно-генетических методов. Их можно выявить посредством тестирования одного гена (например, методами ПЦР или секвенирования по Сэнгеру). Срок тестирования для одного гена составляет от 1 до 7 дней. Более современные методы молекулярно-генетического тестирования, такие как NGS (секвенирование нового поколения), позволяют одномоментно обнаружить несколько мутаций в одном образце. Ограничение широкого распространения NGS — это высокая стоимость теста и увеличенное время оборота для тестирования в некоторых лабораториях, которое может достигать 20–30 дней. На сегодняшний день определение мутаций в гене BRAF типа V600 входит в Программу государственных гарантий бесплатного оказания медицинской помощи и тарифные соглашения ОМС большинства регионов РФ.
В связи с важностью информации о наличии мутации BRAF в клинических рекомендациях ESMO закреплена необходимость проведения молекулярно-генетического тестирования с определением статуса мутаций в генах RAS и BRAF на момент постановки диагноза КРР3. Такая же позиция отражена и в клинических рекомендациях Минздрава России, однако в отечественных рекомендациях существует уточнение о показаниях к проведению тестирования при наличии отдаленных метастазов [27].
Следует также отметить, что Рабочая группа ESMO по прецизионной медицине рекомендует, по возможности, всем пациентам с распространенной и метастатической стадиями КРР проводить молекулярно-генетическое тестирование методом NGS, который позволяет сразу определить набор мутаций, уникальных для каждого пациента [31].
Выбор терапии при мКРР с мутацией BRAF
При выборе 1-й линии терапии мКРР учитывается ряд параметров. В целом они очень схожи в рекомендациях различных профессиональных сообществ. На примере гайдлайна ESMO можно видеть, что к стандартным характеристикам, влияющим на выбор схемы 1-й линии, относятся статус мутаций RAS и BRAF, наличие/отсутствие признаков MSI и способность пациента перенести интенсивное лечение. Среди дополнительных факторов, оказывающих влияние на выбор режима, учитывают локализацию первичной опухоли (в левой или правой половине толстой кишки), в том числе для пациентов с мутацией BRAF (рис. 1).
![Рис. 1. Метастатический КРР: клинические практические рекомендации ESMO по диагностике, лечению и наблюдению [27]. ХТ — химиотерапия, wt — дикий тип, mut — мутантный, dMMR (deficient mismatch repair) — дефицит репарации несоответствий, ПЗ — прогрессирован Рис. 1. Метастатический КРР: клинические практические рекомендации ESMO по диагностике, лечению и наблюдению [27]. ХТ — химиотерапия, wt — дикий тип, mut — мутантный, dMMR (deficient mismatch repair) — дефицит репарации несоответствий, ПЗ — прогрессирован](https://medblog.su/wp-content/uploads/2025/09/Sovremennye-printsipy-i-perspektivy-lekarstvennoj-terapii-metastaticheskogo-kolorektalnogo-raka-s.png)
В клинической практике в нашей стране сформирована последовательность системной терапии мКРР при наличии мутации BRAF V600Е. Как уже ранее было отмечено, мутации KRAS и BRAF являются взаимоисключающими, а также то, что, согласно клиническим рекомендациям, для выбора 1-й линии при мКРР независимо от статуса мутаций следует учитывать наличие в опухоли MSI-фенотипа. В случае сочетания мутаций BRAF V600E с MSI-фенотипом лечение предпочтительно начинать с иммунотерапии (ИТ). При прогрессировании процесса вариант 2-й линии терапии будет включать в себя комбинацию энкорафениб + цетуксимаб (ЭЦ), эффективность которой будет рассмотрена ниже. При MSS-фенотипе мКРР с мутацией BRAF V600E в 1-й линии лечения необходимо использовать дуплет или триплет цитостатиков, предпочтительно с добавлением бевацизумаба. При прогрессировании заболевания 2-я линия как оптимальный вариант вновь включает комбинацию ЭЦ. Но если по каким-то причинам режим двойной таргетной блокады не был использован во 2-й линии, его следует рассматривать как наилучший вариант 3-й линии лечения3 [27, 32]. Однако в редких случаях комбинация ЭЦ при MSS-фенотипе КРР может являться предпочтительной опцией 1-й линии терапии. Это нечастая ситуация, но она возможна при наличии абсолютных противопоказаний к использованию цитостатиков (например, тяжелые нарушения функции печени и почек; тяжелые некорригируемые сопутствующие заболевания сердечно-сосудистой и дыхательной систем; недавно перенесенные оперативные вмешательства; кахексия, плохо корригируемые водно-электролитные нарушения, значимые гематологические нарушения; неприемлемая токсичность при адъювантной ХТ3.
Эффективность комбинации анти-EGFR с BRAF-ингибитором при мКРР с мутацией BRAF
Несмотря на то, что КРР с мутацией BRAF представляет отдельную группу опухолей, ему присущи и общие для всего КРР характеристики. В частности, в 60–80% опухолей наблюдается гиперэкспрессия EGFR. Активация рецепторов реализуется через путь RAS-RAF, который был рассмотрен ранее, но активация сигнального пути возможна и через звенья PI3K/mTOR, даже при ингибировании пути МАРК, чего при мутации BRAF можно добиться путем использования BRAF-ингибитора [33, 34]. Именно поэтому для реализации противоопухолевого действия следует использовать двойной механизм подавления сигнального пути, применяя как BRAF+/-МЕК-ингибиторы, в частности энкорафениб, так и анти-EGFR моноклональное антитело (МАТ) [35].
Сегодня в клинической практике мы можем использовать несколько препаратов, блокирующих BRAF: вемурафениб, дабрафениб и энкорафениб. Несмотря на то, что препараты относятся к одной группе, они обладают разными фармакокинетическими и фармакодинамическими характеристиками, что определяет различия в их эффективности и токсичности. В частности, для энкорафениба характерна наименьшая ингибирующая концентрация (0,35 нМ), что приводит к тому, что гибель половины опухолевых клеток наблюдается при меньшей концентрации лекарственного препарата в сравнении с дабрафенибом и вемурафенибом. Кроме того, именно для энкорафениба характерен наиболее длительный диссоциационный период полувыведения (время связывания с мишенью), который превышает 30 ч. В дополнение препарат обладает максимальным парадоксальным индексом, т. е. временем, в пределах которого происходит ингибирование сигнального пути MAPK в опухолевых клетках, без сопутствующей активации ERK в здоровых клетках4 [36]. Чем выше парадоксальный индекс, тем ниже вероятность развития плоскоклеточного рака кожи. С другой стороны, период полувыведения энкорафениба самый короткий (6,5 ч), что может способствовать более быстрому разрешению нежелательных явлений при снижении дозы или приостановке лечения4.
Следует отметить, что при наличии у пациентов с мКРР мутации BRAF V600E стандартные режимы лечения являются низкоэффективными. Согласно данным различных исследований прежних лет мОВ этой подгруппы пациентов, получающих 2-ю и последующие линии лечения, не превышала полугода, в том числе при попытке добавления к цитостатикам анти-EGFR агентов (табл. 1).

Также следует отметить, что применение только BRAF-ингибиторов (в отличие от BRAF-мутированной меланомы) при мКРР сопровождается крайне низкой непосредственной эффективностью. Так, согласно опубликованным данным, ЧОО при использовании монотерапии вемурафенибом при мКРР составила лишь 5% в сравнении с примерно 50% при метастатической меланоме кожи [46, 47] (рис. 2).
![Рис. 2. Частота объективного ответа (%) на терапию вемурафенибом при мКРР с мутацией BRAF V600E (адаптировано из S. Kopetz et al. [46]) Fig. 2. Objective response rate to vemurafenib therapy in mCRC with the BRAF V600E mutation (adapted from S. Kopetz et Рис. 2. Частота объективного ответа (%) на терапию вемурафенибом при мКРР с мутацией BRAF V600E (адаптировано из S. Kopetz et al. [46]) Fig. 2. Objective response rate to vemurafenib therapy in mCRC with the BRAF V600E mutation (adapted from S. Kopetz et](https://medblog.su/wp-content/uploads/2025/09/1757900910_271_Sovremennye-printsipy-i-perspektivy-lekarstvennoj-terapii-metastaticheskogo-kolorektalnogo-raka-s.png)
Как ранее упоминалось, это связано с тем, что, несмотря на блокирование BRAF, активация сигнального пути может быть реализована через звенья PI3K/mTOR, что и породило гипотезу о необходимости использования при КРР комбинации ингибиторов BRAF, МЕК и EGFR. Для подтверждения этой гипотезы было разработано и проведено самое крупное исследование III фазы, которое объединило более 600 больных мКРР с мутацией BRAF V600E [35]. В исследование были включены 665 участников, ранее получивших 1–2 линии терапии по поводу мКРР, которые были разделены на 3 группы, две из которых были экспериментальными. Первая группа получала тройную комбинацию энкорафениб + биниметиниб + цетуксимаб (ЭБЦ); вторая экспериментальная группа — двойную комбинацию ЭЦ, а контрольная группа — ХТ по схеме FOLFIRI или иринотекан в сочетании с цетуксимабом. Первичными конечными точками были выбраны ОВ и ЧОО в группе тройной комбинации в сравнении с группой контроля. Среди вторичных конечных точек были ОВ в группе двойной комбинации ЭЦ в сравнении с контролем, а также ВБП среди всех рандомизированных пациентов; длительность ответа и безопасность терапии. Группы были хорошо сбалансированы по характеристикам как пациентов, так и опухолевого процесса: 45–50% больных имели метастатическое поражение 3 и более органов; у 60–65% метастазы локализовались в печени, и исходное повышение опухолевых маркеров отмечалось у 70–80% участников. При оценке ОВ авторы отметили достоверное преимущество от использования таргетной терапии без добавления цитостатиков в сравнении с группой контроля: мОВ составила 9,3 мес. в обеих экспериментальных группах в сравнении с 5,9 мес. в группе контроля, что соответствовало относительному снижению риска смерти на 39% при применении экспериментальных режимов. Но самым удивительным было то, что добавление биниметиниба (МЕК-ингибитора) не увеличивало эффективность терапии [48]. Несмотря на то, что ЧОО оказалась несколько больше при применении тройной комбинации — 27%, использование только двух препаратов (энкорафениба и цетуксимаба) также обеспечило высокий уровень ответа — 19,5%, что было достоверно выше, чем при применении ХТ в сочетании с цетуксимабом (1,8%). Также сопоставимой оказалась и мВБП в двух экспериментальных группах (вторичная конечная точка) — 4,5 мес. и 4,3 мес. в сравнении с 1,5 мес. в группе контроля. Относительное снижение риска прогрессирования на таргетной терапии превысило 55%. В связи с отсутствием значимых различий по избранным конечным точкам в экспериментальных группах подгрупповой анализ сравнил эффективность двойной комбинации ЭЦ с группой контроля в отношении общей выживаемости. Обновленный анализ, представленный в 2021 г. [48], убедительно продемонстрировал преимущество режима ЭЦ практически во всех подгруппах. Кроме того, комбинация ЭЦ имела более благоприятный профиль безопасности по сравнению с контрольной группой. Диарея, тошнота и сыпь были наиболее частыми токсическими реакциями (ТР) в группе ЭЦ. Диарея ожидаемо была связана с применением иринотекана. Можно отметить, что в исследовательской группе чаще фиксировали возникновение меланоформного невуса и миалгий, однако реакции, отнесенные к значимым степеням, регистрировались в единичных случаях (0%, 1%). Частота отмены терапии в группах оказалась сопоставимой, составив для комбинации ЭЦ 9% и 11% для контрольной группы. При наличии показаний возможна двуступенчатая редукция дозы энкорафениба (с 300 до 150 мг). При непереносимости дозы 150 мг проводится окончательная отмена препарата.
В рамках протокола исследования участники заполняли опросники, отражающие качество жизни (КЖ). Согласно шкале EORTC QLQ-C30 таргетная терапия позволяла более длительное время сохранять хорошее КЖ: медиана времени до ухудшения общего состояния здоровья оказалась в 2 раза дольше, чем в группе контроля (рис. 3) [49].

Оценив эффективность и безопасность других современных схем лекарственной терапии, которые могут быть использованы во 2-й линии лечения пациентов с мКРР и наличием мутации BRAF V600E, несложно отметить, что именно комбинация ЭЦ обеспечивает наиболее приемлемое соотношение эффективности и токсичности (единственный режим, который не содержит цитостатиков) (табл. 2).
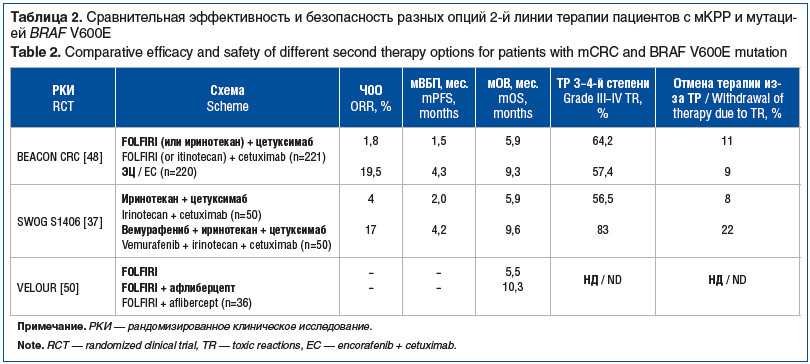
Таким образом, авторы исследования BEACON сделали обоснованные выводы о том, что комбинация ЭЦ±биниметиниб значительно превзошла эффективность ранее существовавшего стандарта лечения пациентов с мКРР с мутацией BRAF V600E, которые получили одну или две предшествующие линии системной терапии. Для комбинации ЭЦ отмечен благоприятный профиль токсичности с меньшей частотой отмены терапии в сравнении с режимами ХТ + цетуксимаб. Применение схемы ЭЦ ± биниметиниб способствует более длительному поддержанию КЖ. И именно комбинацию ЭЦ следует рассматривать в качестве нового стандарта лечения мКРР с мутацией BRAF V600E, начиная со 2-й линии терапии.
Следует отметить, что, наряду с зарубежными руководствами, отечественные клинические и практические рекомендации содержат схему энкорафениб + EGFR-ингибитор как важнейшую лечебную опцию при мКРР с мутацией BRAF, начиная со 2-й линии лечения. Причем эксперты предусмотрели возможность добавления к энкорафенибу как цетуксимаба (как было в исследовании BEACON CRC), так и панитумумаба (что может быть востребовано в случае сложностей с доступом к цетуксимабу) [51].
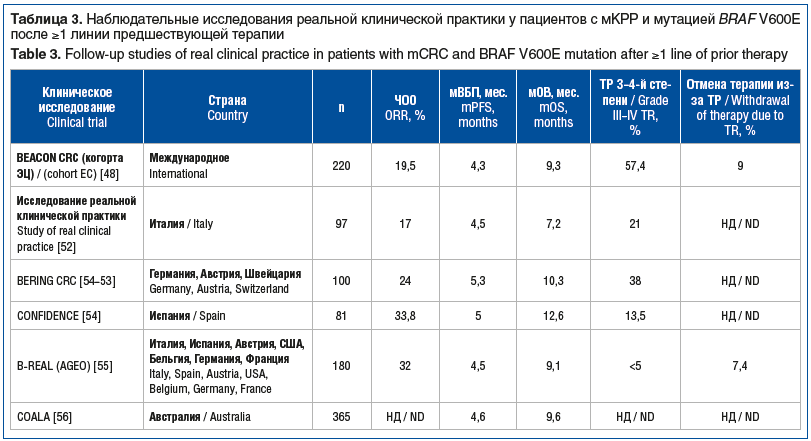
Помимо РКИ III фазы, позволившего зарегистрировать схему ЭЦ регуляторными органами, сегодня в мире накопился уже достаточно большой опыт применения данной комбинации в реальной клинической практике. Во всех этих протоколах авторами были получены воспроизводимые результаты в отношении эффективности (ЧОО, мВБП и мОВ), при еще меньшей, чем в РКИ, частоте ТР значимых степеней (табл. 3).
Метастатический КРР с dMMR/MSI-H и мутацией BRAF
Отдельного обсуждения требует вопрос лечения подгруппы пациентов, опухоли которых имеют как мутацию BRAF, так и MSI-фенотип. Какая последовательность лечебных режимов будет для них оптимальной? Конечно, число таких пациентов крайне невелико — около 1–2% [57]. При мКРР с признаками dMMR/MSI в настоящее время, как упоминалось ранее, стандартом 1-й линии является ИТ, независимо от статуса мутации BRAF. Вопрос состоит в том, могут ли BRAF/MEK-ингибиторы быть предпочтительной опцией терапии 2-й линии для этой популяции пациентов при прогрессировании на ИТ? Ответом на вопрос об эффективности таргетной терапии могут являться результаты многоцентрового международного ретроспективного исследования, в котором авторы сравнили эффективность комбинации ЭЦ ±биниметиниб у пациентов c мКРР с наличием мутации BRAF V600E при микросателлитно-стабильных и нестабильных опухолях, которые в качестве 1-й линии получали какую-либо системную терапию на основе цитостатиков (для MSS-опухолей) или ИТ (для опухолей с признаками MSI). Основная группа включала больных как с мутацией BRAF V600E, так и MSI-фенотипом [57]. У этой подгруппы больных при прогрессировании на ИТ ЧОО в случае использования во 2-й линии таргетных препаратов составила 18%, мВБП — 5,1 мес., а мОВ — 10,7 мес., что оказалось сопоставимым с результатами, полученными в исследовании BEACON CRC. Дополнительно можно отметить, что частота контроля заболевания достигла 60%.
Еще один анализ реальной клинической практики (из национального регистра Италии) дает информацию о целесообразности применения таргетной терапии при мутации BRAF V600E в более ранних линиях терапии [58]. Анализу подверглись 179 пациентов, которые получали комбинацию ЭЦ во 2-й или более поздних линиях лечения. Оказалось, что при использовании этого режима во 2-й линии последующую 3-ю линию смогли получить 53% пациентов, тогда как при применении ЭЦ в 3-й линии последующее лечение было назначено только 30% пациентов. Вариантов последующих линий также было использовано больше при более раннем назначении комбинации ЭЦ. Ожидаемо, что показатель выживаемости после прогрессирования оказался более высоким у пациентов, получающих комбинацию ЭЦ во 2-й линии, в сравнении с более поздним ее назначением. Несмотря на несущественную абсолютную разницу в медианах (3 мес. против 2 мес.), различия оказались статистически значимыми (отношение рисков 0,42; p<0,0001) [58].
В настоящее время продолжаются исследования по изучению режимов с включением ЭЦ, в том числе в сочетании с ИТ, на различных этапах лечения мКРР в отдельных когортах, а также в качестве периоперационной терапии.
Выводы
Молекулярно-генетическая диагностика является неотъемлемым элементом планирования терапии пациентов с мКРР; обязательным для исследования являются анализ генов KRAS, NRAS, BRAF, статус микросателлитной нестабильности и экспрессии/амплификации HER-2/neu.
Мутация в гене BRAF при мКРР встречается в 5–10% случаев при мКРР, ее наличие отражает агрессивное течение заболевания, опухоли с таким генетическим нарушением имеют неблагоприятный прогноз и низкую эффективность стандартных режимов лекарственной терапии.
Обнаружение мутации BRAF предполагает использование дополнительной лечебной опции на основе таргетных препаратов, а комбинация ЭЦ является единственной зарегистрированной комбинацией таргетных препаратов (без цитостатиков) и рекомендуется к назначению, начиная со 2-й линии лечения, в том числе и у пациентов мКРР с MSI-фенотипом опухоли при прогрессировании на ИТ.
Применение комбинации ЭЦ в реальной клинической практике позволяет достичь показателей, сопоставимых с результатами регистрационного исследования BEACON CRC при меньшей частоте ТР 3–4-й степеней.
Сведения об авторе:
Болотина Лариса Владимировна — д.м.н., профессор РАН, заведующая отделением химиотерапии МНИОИ им. П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России; 125284, Россия, г. Москва, 2-й Боткинский пр-д, д. 3; ORCID iD 0000-0003-4879-2687
Контактная информация: Болотина Лариса Владимировна, e-mail: lbolotina@yandex.ru
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.05.2025.
Поступила после рецензирования 30.05.2025.
Принята в печать 26.06.2025.
About the author:
Larisa V. Bolotina — Dr. Sc. (Med.), Professor of the Russian Academy of Sciences, Head of the Department of Chemotherapy, P.A. Hertsen Moscow Oncology Research Institute — Branch of the National Medical Research Radiological Centre; 3, 2nd Botkinsky Ave., Moscow, 125284, Russian Federation; ORCID iD 0000-0003-4879-2687
Contact information: Larisa V. Bolotina, e-mail: lbolotina@ yandex.ru
Financial Disclosure: the authors has no a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.05.2025.
Revised 30.05.2025.
Accepted 26.06.2025.
1Cancer Today (who.int). (Electronic resource.) URL: https://gco.iarc.who.int/today/en/dataviz/bars?mode=cancer&include_nmsc=1&population… (access date: 29.04.2025).
2American cancer society facts and figures. (Electronic resource.) URL: https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/colorectal-cancer… (access date: 29.04.2025).
3Клинические рекомендации. Злокачественное новообразование ободочной кишки. 2022.
4ОХЛП Брафтови ЛП-№(001349)-(РГ-RU).
Информация с rmj.ru
