Содержание статьи
- 1 Микробиота и пробиотики: основные понятия
- 2 Показания для назначения пробиотиков в гастроэнтерологической практике
- 3 Штаммоспецифичность как гарантия клинической эффективности пробиотика
- 4 S. boulardii CNCM I-745 для эрадикационной терапии H. pylori
- 5 S. boulardii CNCM I-745 в лечении заболеваний печени
- 6 Заключение
Микробиота и пробиотики: основные понятия
Современный подход к назначению пробиотиков определяется уточнением «классических» показаний к их применению (например, профилактика антибиотик-ассоциированной диареи (ААД)), существенным расширением нозологических форм (неалкогольная жировая болезнь печени, ожирение и сердечно-сосудистые заболевания и многие другие) и сфер медицины в целом (например, психобиотики для коррекции психического статуса) [1–4]. Основой переосмысления возможностей пробиотиков в клинической практике стало стремительное накопление данных о составе, функциях и изменениях микробиоты и микробиома человека. Микробиота представляет собой совокупность микробиоценозов отдельных органов и систем организма человека (кожа, легкие, слизистая оболочка полости рта, урогенитальный тракт, желудочно-кишечный тракт (ЖКТ)), генетического материала и взаимоотношений внутри экологической ниши в определенный период на определенной географической территории. Геном микробиоты обозначается термином «микробиом» и включает в себя бактериом (совокупный генофонд бактерий), микобиом (совокупный генофонд грибковой флоры) и виром (совокупный генофонд вирусов) [1]. Локальные и системные функции микробиоты разнообразны и охватывают, например, обеспечение колонизационной резистентности, энергообеспечение эпителия и поддержание целостности эпителиального барьера, метаболизм пищевых субстратов и утилизацию конечных метаболитов, продукцию субстратов, необходимых для макроорганизма, а также регуляцию местного и адаптивного иммунного ответа [1, 2, 5].
Несмотря на то, что механизмы действия пробиотиков окончательно не изучены, основная концепция их назначения подразумевает, что функции пробиотических штаммов во многом схожи. Однако крайне важна штаммоспецифичность штамма и доказанность его эффективности и безопасности в отношении конкретной нозологии [1, 2, 5, 6]. Пробиотики взаимодействуют с экосистемами ЖКТ, подавляя патогенные микроорганизмы благодаря, например, ускорению транзита по ЖКТ, снижению способности патогенов к колонизации слизистой оболочки и адгезии к эпителиоцитам. Показано прямое связывание пробиотическими штаммами некоторых грамотрицательных бактерий. Пробиотики увеличивают выработку биологически активных метаболитов, в первую очередь, таких как короткоцепочечные жирные кислоты (КЦЖК), что сопряжено со снижением люминального рН. Более кислая среда обеспечивает рост и выживание комменсальных микроорганизмов. КЦЖК адсорбируются колоноцитами и направляются на их энергообеспечение и поддержание нормального функционирования плотных клеточных контактов, а также выполняют функции сигнальных молекул для клеток иммунной системы. Механизмы действия пробиотиков включают синтез витаминов, бактериоцинов, метаболизм солей желчных кислот и нейтрализацию токсинов. Пробиотики усиливают всасывание электролитов в кишечнике. Пробиотики улучшают барьерную функцию и иммунитет слизистой оболочки ЖКТ, снижают выработку провоспалительных цитокинов и увеличивают уровень противовоспалительных цитокинов [1, 2, 6, 7]. Таким образом, пробиотики обладают плейотропным действием.
Показания для назначения пробиотиков в гастроэнтерологической практике
Накопление данных, отвечающих требованиям медицины, основанной на доказательствах (экспериментальные и клинические исследования, систематические обзоры и метаанализы), позволяет дать точные рекомендации по назначению пробиотиков. В соответствии с «Методическими рекомендациями Научного сообщества по содействию клиническому изучению микробиома человека (НСОИМ) и Российской гастроэнтерологической ассоциации (РГА) по применению пробиотиков, пребиотиков, синбиотиков, метабиотиков и обогащенных ими функциональных пищевых продуктов для лечения и профилактики заболеваний гастроэнтерологического профиля у взрослых и детей» сформулированы четкие и обоснованные показания [5]:
У взрослых:
-
профилактика ААД;
-
профилактика С. difficile-ассоциированной болезни;
-
улучшение исходов эрадикации инфекции Helicobacter pylori;
-
лечение синдрома раздраженного кишечника;
-
лечение функционального (хронического) запора;
-
профилактика инфекционной диареи и функциональных нарушений гастроэнтерологического профиля у здоровых взрослых (включая период после перенесенной инфекции COVID-19);
-
лечение заболеваний печени (цирроза печени и метаболически-ассоциированной жировой болезни печени);
-
улучшение исходов эрадикации синдрома избыточного бактериального роста (СИБР).
У детей:
-
лечение острой диареи (включая острый гастроэнтерит и острые кишечные инфекции (ОКИ));
-
профилактика ААД (включая инфекцию C. difficile);
-
улучшение исходов эрадикации инфекции H. pylori;
-
профилактика инфекционных заболеваний и функциональных нарушений гастроэнтерологического профиля у здоровых детей, а также у детей с пищевой аллергией и атопическим дерматитом.
Штаммоспецифичность как гарантия клинической эффективности пробиотика
Различным видам и штаммам пробиотиков действительно присущи общие механизмы действия. Вместе с тем некоторые виды пробиотических микроорганизмов обладают уникальными характеристиками, которые могут обеспечивать конкретные особенности медицинского назначения [1, 5, 8].
Общепринятая номенклатура пробиотиков включает название вида, подвида и буквенно-цифровое обозначение специфического штамма. Унифицированное обозначение штаммов важно для определения связи положительных эффектов пробиотиков с конкретным штаммом или комбинацией штаммов в соответствующей дозировке. Производители пробиотиков регистрируют свои штаммы в международных депозитариях микроорганизмов, которые присваивают им дополнительные обозначения: American Type Culture Collection (ATCC) (США), Centraal Bureau voor Schimmelcultures (CBS) (Нидерланды), Collection Nationale de Cultures de Microorganismes de l’Institut Pasteur (CNCM) (Франция), Deutsche Sammlung von Mikroorganismen (DSM) (Германия) [1]. В Российской Федерации пробиотики могут быть зарегистрированы в качестве биологически активных добавок (БАД) к пище и лекарственных средств в соответствии с российским законодательством [5].
Доказанные профилактические и лечебные свойства конкретного пробиотического штамма не распространяются на другие, неисследованные, штаммы этого же вида микроорганизмов или на мультиштаммовые пробиотические комбинации.
Вопрос о качестве пробиотического продукта, которое обеспечивается соответствием заявленному составу по штамму (штаммам), по количеству микроорганизмов, а также отсутствием контаминации, стоит очень остро. Так, при анализе 30 пробиотических продуктов из Европы (Бельгия, Италия, Польша), а также Индии и Пакистана только 17 (56,67%) продуктов содержали заявленные штаммы, 13 (43,33%) продуктов имели отклонение от заявленного состава, 6 — содержали больше штаммов, 5 — содержали другие штаммы, в трех — один и более из заявленных штаммов отсутствовали [9].
Таким образом, выбор пробиотика для назначения в гастроэнтерологической практике должен быть продиктован ответственным решением врача и опираться на опубликованные данные с доказательствами эффективности конкретного пробиотического штамма. Предпочтение следует отдавать пробиотикам, зарегистрированным как лекарственное средство, или штаммам в виде БАД, но доказавшим свою эффективность и безопасность при конкретных заболеваниях [5].
Одним из самых известных и изученных пробиотических штаммов в гастроэнтерологической практике на сегодняшний день является штамм Saccharomyces boulardii CNCM I-745, который в экспериментальных и клинических исследованиях показал ряд полезных свойств и немаловажных индивидуальных особенностей (см. таблицу). Рассмотрим более подробно значение
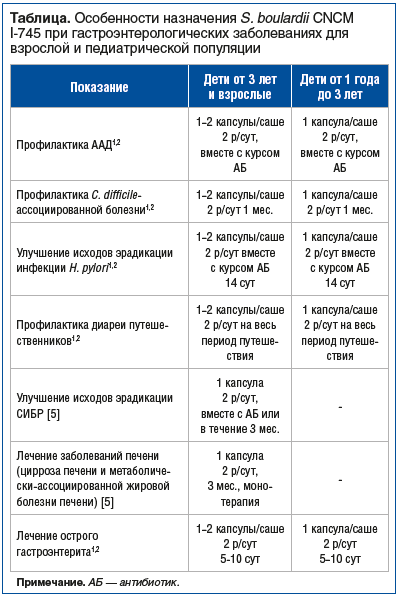
Saccharomyces boulardii CNCM I-745 (S. boulardii CNCM I-745) в ведении гастроэнтерологических пациентов.1,2
Saccharomyces boulardii CNCM I-745: особенности пробиотического штамма, зарегистрированного как лекарственное средство
S. boulardii CNCM I-745, входящий в состав лекарственного препарата Энтерол®, — принципиально другой пробиотик ввиду своей природы и ряда уникальных свойств: в отличие от большинства пробиотиков S. boulardii CNCM I-745 не является бактерией и представителем естественной кишечной микробиоты человека. Через 3 дня приема в качестве пробиотика S. boulardii CNCM I-745 достигает стабильного популяционного уровня и уже через 2–5 дней после прекращения приема больше не обнаруживается в кале [10, 11]. Благодаря небактериальной природе S. boulardii CNCM I-745 (препарат Энтерол®) обладает естественной устойчивостью ко всем антибиотикам и может приниматься одновременно с ними без временного интервала и риска снижения эффективности. В качестве механизмов действия S. boulardii CNCM I-745 установлены антагонистический эффект в отношении патогенных и условно-патогенных микроорганизмов (C. difficile, Candida albicans, Escherichia coli и др.), эффект в отношении бактериальных цито- и энтеротоксинов (токсины А и В C. difficile, холерный токсин), повышение ферментативной активности в кишечнике, уменьшение местного воспаления, стимуляция продукции КЦЖК бактериями семейств Lachnospiraceae и Ruminococcaceae, а также формирование комфортной среды для полезных представителей микробиоты [10–13].
В последнее время постулируется положение о необходимости назначения пробиотиков одновременно с началом антибиотикотерапии для действенной профилактики возможных осложнений антибактериальных препаратов [1–5]. К сожалению, для большого числа широко назначаемых бактериальных пробиотических штаммов нет опубликованных данных об их резистентности при применении конкретных антибиотиков, наиболее часто выбираемых при внебольничных инфекциях [14]. S. boulardii CNCM I-745, который относится к эукариотам, обладает естественной устойчивостью к антибиотикам [10]. В исследовании с оценкой минимальной подавляющей концентрации (МПК) 16 антибиотиков (в том числе фидаксомицина) были изучены 16 различных пробиотических штаммов. Оказалось, что, например, штамм Streptococcus thermophilus был чувствительным ко всем исследованным антибиотиками, кроме метронидазола. У S. boulardii CNCM I-745 была продемонстрирована естественная резистентность к бензилпенициллину, оксациллину, амоксициллину и амоксициллину с клавулановой кислотой, цефалоспоринам второго поколения — цефуроксиму и третьего поколения — цефподоксиму и цефиксиму, макролидам кларитромицину и азитромицину, клиндамицину, фторхинолонам ципрофлоксацину и левофлоксацину, доксициклину, ко-тримоксазолу, метронидазолy. Отдельный интерес представляет раздел исследования, посвященный фидаксомицину, антибиотику, назначаемому в тяжелых случаях C. difficile-ассоциированной болезни. Нормативный показатель МПК для фидаксомицина не разработан, но для S. boulardii CNCM I-745 он оказался максимальным из изученных в эксперименте [14].
Энтерол® (S. boulardii CNCM I-745) зарегистрирован в Российской Федерации как лекарственный препарат, код по Анатомо-терапевтически-химической (АТХ) системе классификации A07FA02, является небактериальным пробиотиком и противодиарейным средством. Согласно Методическим рекомендациям НСОИМ и РГА по применению пробиотиков, пребиотиков, синбиотиков, метабиотиков и обогащенных ими функциональных пищевых продуктов для лечения и профилактики заболеваний гастроэнтерологического профиля у взрослых и детей для препарата Энтерол® (S. boulardii CNCM I-745) показаниями в педиатрической практике названы лечение острого гастроэнтерита и ОКИ, профилактика ААД (включая инфекцию C. difficile), эрадикация инфекции H. pylori, а у взрослых — профилактика ААД, инфекционной диареи и C. difficile-ассоциированной болезни, эрадикация инфекции H. pylori [5].
Клинические исследования S. boulardii CNCM I-745, а также систематические обзоры и метаанализы этих исследований создали основу для включения этого лекарственного средства в клинические рекомендации по ключевым нозологическим формам в гастроэнтерологии.
S. boulardii CNCM I-745 для эрадикационной терапии H. pylori
В Российской Федерации частота инфекции H. рylori остается достаточно высокой, достигая в некоторых регионах 54,9% [15]. Тактика ведения H. рylori-ассоциированных заболеваний (хронический гастрит и язвенная болезнь) основана на эрадикации этой патогенной инфекции, что делает поиск оптимальных режимов антихеликобактерного лечения актуальной задачей. В рекомендациях РГА констатировано, что при положительном результате тестирования на инфекцию H. рylori и наличии показаний для проведения эрадикационной терапии рекомендуется назначение штаммоспецифичных пробиотиков, доказавших свою эффективность, для снижения частоты нежелательных явлений (НЯ), в том числе ААД [16].
К немногочисленным штаммоспецифичным пробиотикам, доказавшим свою эффективность в антихеликобактерном лечении, относится S. boulardii CNCM I-745. С учетом документированной естественной резистентности этого штамма к основным антибиотикам для эрадикации (амоксициллину, кларитромицину, метронидазолу и левофлоксацину) [14] его назначение очевидно с первого дня 14-дневной схемы антихеликобактерной терапии.
В рандомизированном контролируемом исследовании (РКИ) включение S. boulardii CNCM I-745 в эрадикационную терапию привело к увеличению эффективности терапии (процент эрадикации H. pylori 86,0% против 74,7% в группе без пробиотика; p=0,02), снижению общей частоты НЯ (17,0% против 55,7%; p<0,001), в том числе частоты ААД (2,0% против 46,4%; p=0,02). Удалось показать, что при добавлении данного пробиотического штамма комплаентность пациентов была лучше (95,0% против 91,2%; p<0,001), что имеет большое значение для успеха терапии [17].
При сравнении 14-дневных схем эрадикации H. pylori у пациентов, получавших S. boulardii CNCM I-745, по сравнению с группой без пробиотика по данным телефонных опросов на 3, 7, 13-й день лечения и в конце исследования (30-й день) зарегистрировано меньшее количество желудочно-кишечных симптомов. При оценке фекальной микробиоты после завершения эрадикационной терапии с добавлением S. boulardii CNCM I-745 с помощью 16S РНК выявлены более высокое бактериальное разнообразие, более высокая представленность энтеробактерий и более низкое содержание Bacteroides и Clostridia. Установлено, что S. boulardii CNCM I-745 способствует сохранению кишечной микробиоты при антибиотикотерапии [18]. Несколько метаанализов свидетельствуют в пользу добавления S. boulardii CNCM I-745 к эрадикационной терапии H. pylori [19–21]. H. Szajewska et al. [20] показали эффективность S. boulardii CNCM I-745 не только у взрослых, но и у детей: пробиотик привел к увеличению эффективности эрадикации (относительный риск (ОР) 1,11, 95% (доверительный интервал) ДИ 1,06–1,17), уменьшению всех НЯ (ОР 0,44, 95% ДИ 0,31–0,64) и диареи (ОР 0,51, 95% ДИ 0,42–0,62).
Одно из существенных опасений при назначении антибиотиков связано с понятием «резистом» — совокупность генов устойчивости к антибиотикам в микробной экосистеме. При оценке кишечного микробиома после курса антибиотиков наблюдается значительное увеличение общей нагрузки генов устойчивости к антибиотикам [22].
При исследовании фекального резистома секвенированием методом дробовика до, сразу после и через 1 мес. после тройной терапии было показано, что после лечения в группе с добавлением S. boulardii CNCM I-745 разнообразие генов устойчивости к антибиотикам, определявшим резистентность к линкозамидам, тетрациклину, макролидам + линкозамиду + стрептограмину В, β-лактамам, была достоверно ниже по сравнению с группой без пробиотика. Таким образом, добавление к эрадикационной терапии S. boulardii CNCM I-745 способствует достоверному уменьшению обилия генов антибиотикорезистентности, тогда как в группе без добавления пробиотика количество этих генов возрастало [23]. Эти данные также свидетельствуют в пользу одновременного назначения S. boulardii CNCM I-745 с антибиотиками. Оптимизация эрадикационной терапии H. рylori за счет включения S. boulardii CNCM I-745 для увеличения процента успешной эрадикации и снижения частоты НЯ представлена в клинических рекомендациях РГА по диагностике и лечению гастрита3 и язвенной болезни [24].
S. boulardii CNCM I-745 в лечении ААД и C. difficile-ассоцированной болезни
Антибиотик-ассоциированная диарея и C. difficile-ассоциированная болезнь служат характерными проявлениями нарушения кишечной микробиоты под влиянием антибиотиков. Эти нарушения складываются из снижения общего количества бактерий, а также ключевых бактерий (Bifidobacterium, Lactobacillus и Bacteroides), уменьшения числа видов бактерий (α-разнообразия), роста потенциально патогенных бактерий Enterobacterales, Enterococcus, Clostridium и Candida [25]. Антибиотики могут оказать негативное влияние на барьерную функцию слизистой оболочки, например, за счет нарушения белков плотных контактов, изменения гомеостаза эпителиоцитов при изменении функции толл-подобных рецепторов и иммунорегуляции, а также дезорганизации моторики ЖКТ [10].
Лечение препаратом Энтерол® может нивелировать изменения микробиоты, вызванные антибиотиками, или ослабить чрезмерную воспалительную иммунную реакцию [12–14, 26]. В метаанализе подтверждено профилактическое значение S. boulardii CNCM I-745 при антибиотикотерапии. В систематическом обзоре 21 РКИ (n=4780) назначение S. boulardii CNCM I-745 по сравнению с плацебо или отсутствием лечения снижает риск ААД с 18,7 до 8,5% (ОР 0,47, 95% ДИ 0,38–0,57, число больных, которых необходимо лечить, — 10 с 95% ДИ 9–13). Риск диареии у детей снизился с 20,9 до 8,8% (6 РКИ, n=1653, ОР 0,43, 95% ДИ 0,3–0,6), у взрослых — с 17,4 до 8,2% (15 РКИ, n=3114, ОР 0,49, 95% ДИ 0,38–0,63) [27].
Антагонистический эффект S. boulardii CNCM I-745 против C. difficile объясняется специфическими эффектами этого пробиотика. Доказаны гидролиз токсинов А и В сериновой протеазой, продуцируемой S. boulardii, стимуляция кишечного IgA, вырабатываемого против токсина A, модуляция воспалительного ответа на токсины C. difficile и профиля желчных солей в пользу вторичных желчных кислот, способных ингибировать вегетативные формы C. difficile, ингибирование формирования биопленки C. difficile [10, 11, 28].
Метаанализ подтверждает положительный эффект S. boulardii в профилактике первого эпизода C. difficile-ассоциированной болезни [29]. В когортном исследовании с участием 8763 госпитализированных пациентов риск развития клостридиальной инфекции был ниже при одновременном приеме S. boulardii и антибиотиков (отношение шансов 0,57, 95% ДИ 0,33–0,96, р=0,035), при этом эффективность была достоверно выше при раннем назначении этого пробиотика [30]. В «Практических рекомендациях НСОИМ, РГА и Российского общества по профилактике неинфекционных заболеваний по диагностике и лечению Clostridioides difficile (C. difficile)-ассоциированной болезни у взрослых» постулировано добавление пробиотического штамма S. boulardii CNCM I-745 пациентам, получающим антибактериальные препараты, для профилактики C. diffiicle-ассоциированной болезни [31].
S. boulardii CNCM I-745 в лечении заболеваний печени
Saccharomyces boulardii CNCM I-745 снижает риск воспаления, стеатоза и фиброза печени, за счет модуляции микробиоты способствует нормализации проницаемости эпителиального барьера ЖКТ, уменьшает вероятность бактериальной транслокации и эндотоксемии, что служит основанием для дальнейшего изучения штаммоспецифичного пробиотика при неалкогольной жировой болезни печени, циррозе печени и других заболеваниях [32].
В «Методических рекомендациях НСОИМ и РГА по применению пробиотиков, пребиотиков, синбиотиков, метабиотиков и обогащенных ими функциональных пищевых продуктов для лечения и профилактики заболеваний гастроэнтерологического профиля у взрослых и детей» S. boulardii CNCM I- 745 включен в перечень штаммов, доказавших свою эффективность для лечения заболеваний печени у взрослых [5].
Заключение
Безопасность и эффективность штаммоспецифичных пробиотиков, таких как S. boulardii CNCM I-745 (Энтерол®), доказаны при широко распространенных гастроэнтерологических заболеваниях (C. difficile-ассоциированная болезнь) и в случаях назначения антибиотиков (эрадикационная терапия H. pylori, профилактика и лечение ААД и дисбиоза), острой диарее любой этиологии и диарее путешественников. Использование пробиотика Энтерол® с антибиотиками одновременно, с первого дня терапии, без временного интервала полностью обосновано и приводит к снижению риска возникновения частоты НЯ, в том числе ААД, и повышению комплаентности со стороны пациента. Очевидно, что пробиотики обладают огромным потенциалом как для профилактики и лечения гастроэнтерологических заболеваний, так и для поддержания и восстановления здоровья человека, и этот потенциал еще предстоит раскрыть полностью.
1Общая характеристика лекарственного препарата Энтерол, 250 мг, порошок для приготовления суспензии для приема внутрь, ЛП=N(002853)-(РГ-RU) от 24.07.2023.
2Общая характеристика лекарственного препарата Энтерол, 250 мг, капсулы, ЛП=N(005895)-(РГ-RU) от 24.06.2024.
3Клинические рекомендации. Гастрит и дуоденит. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend/708_2 (дата обращения: 13.10.2024).
Информация с rmj.ru
