Содержание статьи
Введение
Рак молочной железы (РМЖ) продолжает сохранять свою лидирующую позицию среди всех онкологических заболеваний у женского населения [1]. Статистика последних лет свидетельствует о неуклонном росте заболеваемости и смертности от злокачественных новообразований молочной железы в разных странах [2].
В настоящее время лечение РМЖ является сложной и многофакторной задачей, требующей к себе мультидисциплинарного подхода [3, 4], тактика лечения РМЖ направлена на воздержание от агрессивного хирургического вмешательства [5–9]. У хирурга и пациентки значительно чаще возникает вопрос выбора между выполнением органосохранной операции и реконструктивно-пластической. Такая тенденция в значительной мере обусловлена пересмотром концепции развития опухолевого процесса, увеличением доли пациенток с установленными ранними стадиями заболевания, развитием лекарственной терапии, совершенствованием хирургического лечения, а также пересмотром протокола проведения лучевой терапии. Соответственно, в настоящее время растет число выполненных функционально-щадящих операций у больных РМЖ, в том числе при одномоментной реконструкции, без дополнительного применения синтетического материала для укрытия нижнего контура имплантата [10, 11].
В январе 2023 г. был опубликован метаанализ [12] 15 исследований (США, Южная Корея, Германия, Италия) с участием 3101 пациентки с РМЖ за период с января 2010 г. по декабрь 2021 г. (была проведена как препекторальная реконструкция (n=1459), так и субпекторальная (n=1642)). Общая частота осложнений при препекторальной реконструкции составила 25,08% (366 из 1459 пациенток), а при субпекторальной — 29,65% (487 из 1642), т. е. при итоговом анализе результатов через 12 мес. после выполненных реконструкций не было обнаружено существенной разницы между двумя их видами по частоте развития осложнений. Тип покрытия имплантата не учитывался. Авторы делают вывод, что препекторальная реконструкция молочной железы с использованием имплантатов является безопасным методом и дает аналогичные результаты по сравнению с субпекторальным размещением имплантата, при этом отличается значительно более низким уровнем развития капсулярной контрактуры и отторжения имплантата. В публикации подчеркивается, что менее выраженная капсулярная контрактура отмечается у пациенток с препекторальной установкой имплантата даже после лучевой терапии. Лучевая терапия в адъювантном режиме затрагивает не только покровные ткани, но и сформированную капсулу, мышечный карман, который в течение 3 лет после операции формирует выраженную капсулярную контрактуру у пациенток с субпекторальным вариантом реконструкции [12].
Группа европейских и американских исследователей в 2021 г. опубликовала описание работы, которая началась в 2020 г., по сравнению результатов лечения пациенток с РМЖ после подкожной и кожесохранной мастэктомии и препекторальной или субпекторальной установки эндопротеза [13]. С помощью опросника Breast-Q (модуль реконструкции) планируется определять оценку качества жизни в отношении долгосрочного (24 мес.) физического благополучия в зависимости от препекторального или субпекторального расположения эндопротеза. Исследование продолжается в настоящее время. Вскоре должны быть опубликованы ранние результаты — через 24 мес. Оценка безопасности будет в основном основываться на частоте потери экспандера или имплантата по любой причине в течение 24 мес. [13].
Ранее нами опубликована работа [14], где проведен анализ лечения пациенток с диагнозом РМЖ за 2019 и 2020 гг. В статье рассматривалась препекторальная установка преимущественно полиуретановых и текстурированных имплантатов с возможностью укрытия нижнего полюса имплантата синтетическими материалами (сетка и целлюлярный (бесклеточный) дермальный матрикс) или аутодермальным матриксом.
Последние достижения в пластической хирургии с совершенствованием хирургических техник, тщательный отбор пациенток, а также усовершенствование имплантатов и методик выполнения мастэктомии позволили хирургам применять препекторальную установку имплантатов более активно без увеличения частоты развития осложнений [15].
Таким образом, одномоментная реконструкция молочной железы путем препекторального размещения имплантата в настоящий момент применяется хирургами все чаще и показывает хорошие эстетические результаты в отсроченном периоде, а также высокий показатель уровня качества жизни пациенток, что делает актуальным наше продолжающееся исследование, итоги которого пока рано подводить. Мы бы хотели поделиться накопленным на данном этапе опытом и описать первые результаты реконструктивных операций у женщин, оперированных по поводу РМЖ путем препекторальной установки имплантатов.
Собственный опыт препекторальной установки имплантатов при одномоментной реконструкции молочной железы
В ФГБУ «РНЦРР» Минздрава России с 2019 по 2022 г. было выполнено 504 реконструктивно-пластические операции у больных РМЖ. В 50 случаях в реконструктивной операции использовался аутодермальный матрикс [16]. В данное исследование включено 308 пациенток, которым эндопротез был установлен препекторально. В статье приводятся результаты установки препекторально не только полиуретанового и текстурированного имплантатов, но и тканевого экспандера. Критериями отбора пациенток были: отсутствие противопоказаний для хирургического лечения, толщина покровной ткани молочной железы — пинч-тест (от англ. pinch test «щипковый метод») — не менее 1 см. Подкожное выделение ткани молочной железы выполняли щадящим образом, минимально используя электрокоагуляцию — острым путем с помощью ножниц, согласованно и синхронно с ассистентом, точечно коагулируя кровеносные сосуды и сохраняя жировые дольки, что позволяет сохранить нужную толщину подкожно-жирового слоя, необходимую для препекторальной установки имплантата и его полноценного кровоснабжения. При выполнении всех технических манипуляций нельзя забывать о том, что пациентки в анамнезе имеют онкологический диагноз, т. е. необходимо соблюдать онкологическую безопасность. При подкожных мастэктомиях с одномоментной препекторальной реконструкцией имплантатом с целью обеспечения онкологической безопасности и возможности сохранения сосково-ареолярного комплекса (САК) обязательно проводится срочное и плановое гистологическое исследование подсосковой области с целью принятия решения о сохранении или удалении САК.
Объем, ширина, высота и профиль установленных имплантатов подбирались в зависимости от конституциональных особенностей, результатов предварительных замеров и объема сайзеров, наиболее подходящих при интраоперационных замерах. Таким образом были использованы тканевые экспандеры от 275 до 750 мл, имплантаты объемом от 125 до 750 мл. Средний возраст пациенток составил 49,6 года. В зависимости от стадии заболевания пациентки распределились следующим образом: 0 стадия (pТisN0M0) — 40 (12,9%) пациенток, I стадия (pT1N0M0) — 115 (37,3%), IIA стадия (pT0–2N0–1M0) — 75 (24,3%), IIB стадия (сT2–3N0–1M0) — 55 (17,8%), IIIA стадия (сТ0–3N1–2M0) — 17 (5,5%), IIIB стадия (сT4N0–2M0) — 5 (1,9%), IIIC стадия (сT0–4N3M0) — 1 (0,3%).
В исследовании оценивалась частота развития осложнений у пациенток в послеоперационном периоде и достижение эстетического результата. Эстетический результат оценивается хирургом по форме молочной железы и ее соответствию контрлатеральной молочной железе (принятие решения о необходимости выполнения симметризирующей операции), по правильности соотношения верхнего и нижнего полюсов молочной железы, по высоте расположения субмаммарной складки и ее сохранению после интраоперационной фиксации, по уровню расположения ареол (или ее ориентировочное положение для будущей реконструкции САК), по соответствующему положению «пятна» молочной железы относительно конституциональных особенностей пациентки, по мобильности и мягкости сформированной молочной железы при пальпации.
Все пациентки, перенесшие реконструктивно-пластическую операцию в нашем центре, фиксируются на фото до хирургического лечения, после операции и в течение дальнейшего комплексного лечения на рубежных его этапах. Таким образом, пациентки постоянно находятся под наблюдением хирурга, что позволяет вовремя выявить ранние и поздние послеоперационные осложнения.
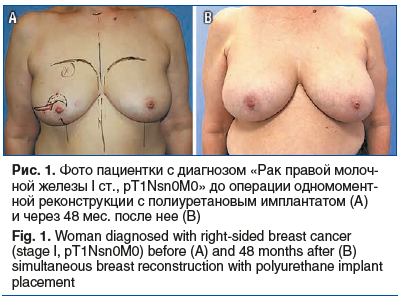
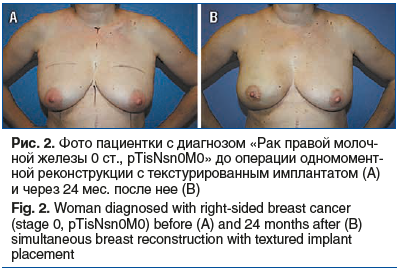
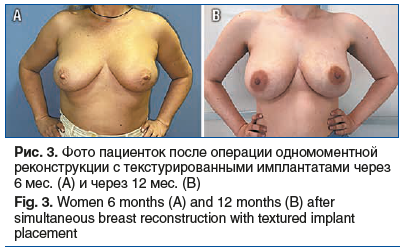
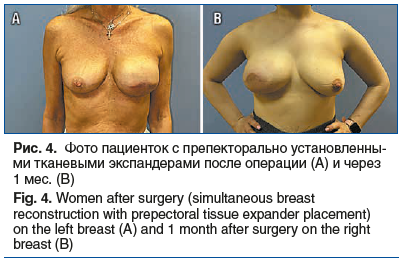
За 4 года наблюдений в отделении онкологии и реконструктивно-пластической хирургии молочной железы имплантаты с полиуретановым покрытием установлены 154 (50%) пациенткам (рис. 1), текстурированные имплантаты — 130 (42,2%) больным (рис. 2, 3). Применение тканевого экспандера при одномоментной реконструкции с препекторальной его установкой выполнено в 24 (7,8%) случаях с целью возможной балансировки воздействия на покровные ткани и получения в итоге хорошего эстетического результата без развития капсульной контрактуры (рис. 4).
В 108 случаях из 308 у пациенток со стадией опухолевого процесса pTis-2N0M0 вместе с препекторальной установкой имплантата выполнялась биопсия сторожевых лимфатических узлов. В 6 случаях выявлен микрометастаз, в 2 случаях были поражены по одному лимфатическому узлу. Суммарно частота выявления пораженных лимфатических узлов при данных стадиях составила 12,9% за 4 года.
В рамках комплексного лечения у 30 (9,7%) пациенток на первом этапе была выполнена неоадъювантная полихимиотерапия. Химиотерапевтическое лечение после операции получили 150 (48,7%) человек. Лучевая терапия была проведена в 40 (12,9%) случаях, из них 60% пациенткам с установленным полиуретановым имплантатом и 40% — с имплантатом с текстурированным покрытием. Радиотерапия была проведена 12 (3,8%) пациенткам при препекторально установленном тканевом экспандере.
При препекторальной установке эндопротезов были получены следующие осложнения: длительная серома наблюдалась у 16 (5,1%) человек, в группе пациенток с установленными текстурированными имплантатами этот показатель заметно выше (n=10), чем у пациенток с установленными имплантатами с полиуретановым покрытием (n=6). Эвакуация серомы проводилась под ультразвуковым контролем. Объем эвакуированной серозной жидкости варьировал от 20 до 140 мл за процедуру. Пункционное удаление жидкости прекращалось при достижении отделяемого в 20 мл либо при УЗ-картине без затеков жидкости по контуру стенок имплантата.
В 3 случаях при использовании полиуретановых имплантатов через 6–12 мес. отмечалось образование гематомы вследствие тесного сращения задней стенки имплантата с передней поверхностью большой грудной мышцы.
Синдром «красной молочной железы» — неинфекционная самоограничивающаяся эритема — расценивалась нами как осложнение и отмечалась только у 10 (3,2%) пациенток с установленными полиуретановыми имплантатами. Данная реакции возможна в раннем и позднем послеоперационном периоде и купируется консервативно назначением системных глюкокортикостероидов.
Возникновение риплинга, когда вживленный имплантат становится визуально заметным, отмечалось у 11 (3,5%) человек, преимущественно с имплантатами с полиуретановым покрытием. На наш взгляд, это еще раз наглядно иллюстрирует необходимость тщательного отбора пациенток для реконструкции с применением данного вида эндопротезирования. «Волнистость» появляется в позднем после-операционном периоде у пациенток с недостаточной толщиной подкожно-жировой клетчатки.
Диастаз краев раны произошел у 5 пациенток с текстурированным покрытием имплантата и у 2 пациенток с полиуретановым покрытием имплантата, причем в 4 случаях из описанных 7 — на фоне проводимой адъювантной химио-терапии и умеренной лимфореи. У пациенток с установленным тканевым экспандером данного вида осложнения не отмечалось.
У 5 пациенток с полиуретановыми имплантатами определялась протрузия эндопротеза с небольшим диастазом краев раны. В 2 случаях удалось наложить вторичные швы, так как присоединения инфекции отмечено не было, а у 3 пациенток эндопротезы были удалены (этим пациенткам была выполнена установка тканевых экспандеров с последующей заменой на текстурированные эндопротезы). В последующем 2 пациенткам из 5 после наложения вторичных швов было проведено полноценное комплексное лечение (химиотерапия и лучевая терапия), что не повлияло на эстетический результат реконструктивной операции.
Потеря имлантата на фоне трофических нарушений и последующей протрузии имплантата была отмечена у 8 пациенток. В 5 случаях был установлен текстурированный имплантат, в 3 случаях — имплантат с полиуретановым покрытием. Трем из 8 после завершения адъювантного лечения была выполнена повторная реконструктивная операция с применением текстурированного имплантата в сочетании с торако-дорсальным лоскутом. Трем пациенткам с имплантатом с полиуретановым покрытием, учитывая вышеописанную клиническую ситуацию, была предложена двухэтапная реконструкция с использованием тканевого экспандера с дальнейшей заменой его на текстурированный имплантат. Двум оставшимся пациенткам также были предложены повторные реконструктивные операции, но обе пациентки в настоящее время от них отказались — им было выполнено только удаление эндопротеза с косметическим ушиванием дефекта покровных тканей.
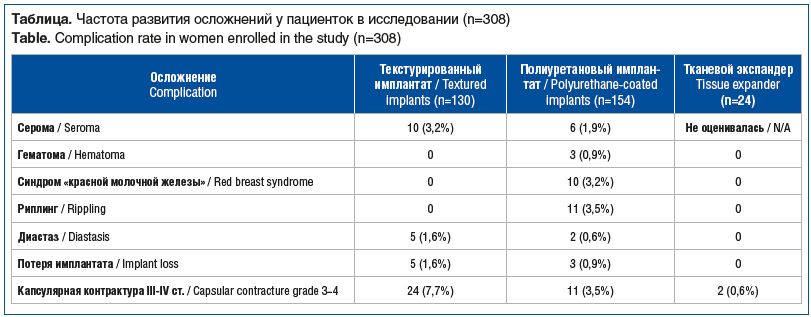
Капсулярная контрактура III–IV степени по J.L. Baker развилась у 35 пациенток. В 11 (3,5%) случаях были установлены имплантаты с полиуретановым покрытием (от общего количества 154 установленных полиуретановых имплантатов), в 24 (7,7%) — имплантаты с текстурированной поверхностью (от общего количества 130 установленных имплантатов данного вида). Частота капсулярных контрактур у пациенток на фоне установленного тканевого экспандера с последующей заменой на текстурированный имплантат составила 8,1% (из 220 случаев всех установленных тканевых экспандеров). Также за небольшой период наблюдения капсулярная контрактура после установки тканевого экспандера препекторально отмечена только в 2 (0,9%) случаях из всего количества установленных тканевых экспандеров именно препекторально (n=24). Вышеописанным пациенткам была проведена лучевая терапия после хирургического лечения в первые 6 мес. после операции. Наглядно частота развития осложнений у пациенток представлена в таблице.
Обсуждение
Принимая решение об установке эндопротеза препекторально, кроме обязательных соблюдений всех постулатов онкологической безопасности, хирург уже прогнозирует эстетический результат у той или иной пациентки в послеоперационном периоде с учетом планируемого комплексного лечения. При подготовке к операции хирург принимает решение, какой имплантат (текстурированный, полиуретановый или тканевой экспандер) он выберет, учитывая не только толщину подкожно-жировой клетчатки с помощью пинч-теста, но также качество и эластичность кожи, степень птоза, состояние контралатеральной молочной железы и ее степень птоза. Например, при достаточной толщине подкожно-жирового слоя и при ожидаемой лимфорее хирург скорее выберет полиуретановый имплантат, который в послеоперационном периоде сразу займет свое положение в жесткой фиксации с окружающими тканями и закроет пустое пространство от лимфореи. Если же ожидается выполнение биопсии сигнального лимфоузла и с учетом индивидуальных особенностей пациентки нужно не жесткое сцепление капсулы имплантата с подкожно-жировым слоем, а более подвижное его размещение в ложе, то, скорее всего, хирург остановится на установке текстурированного имплантата. Если хирург понимает, что толщина подкожно-жирового слоя достаточная, но на фоне адъювантного лечения и развития возможной лимфореи трофика покровных тканей может быть нарушена и необходимо будет снизить давление со стороны эндопротеза, то будет принято решение установить тканевой экспандер. Препекторальное его размещение дает при этом возможность уже на промежуточном этапе получить хороший эстетический результат и приблизиться к окончательному с заменой на постоянный эндопротез, но уже с пройденным комплексным лечением.
При сравнении наших данных с результатами других исследователей мы остановились на публикации 2022 г. Э.А. Байчорова и др. [17], в которой приведены результаты лечения 91 пациентки с РМЖ после реконструктивно-пластических операций. Данные работы не идентичны полностью, так как присутствует большая разница в количестве проанализированных пациенток и периодах наблюдения, но в целом они сопоставимы по группам и полученным результатам. Исследование по структуре ретроспективное, анализируются те операции, которые выполнялись часто в процессе реконструкции и хорошо отработаны. Препекторальная установка без дополнительного укрытия на тот момент выполнялась реже и преимущественно с имплантатами полиуретанового покрытия. В дальнейшем данная хирургическая методика — препекторальная установка имплантата без дополнительного укрытия синтетическими материалами и мышечного покрытия — стала выполняться гораздо чаще и у большего количества пациенток, что предполагает в ближайшее время много новых публикаций и сравнительных анализов эстетических результатов и осложнений.
Заключение
Новизна нашего исследования заключается в том, что мы практически ушли от субпекторальной установки постоянного силиконового эндопротеза и любого дополнительного укрытия нижнего склона синтетическими материалами (кроме применения аутодермального матрикса). Данный вид реконструктивно-пластической операции при одномоментной реконструкции имеет практическую значимость с точки зрения быстрой реабилитации пациенток уже в процессе комплексного лечения — сразу отмечается хороший эстетический результат (даже на этапе препекторальной установки тканевого экспандера). Мы рекомендуем на до-операционном этапе мультидисциплинарно подходить к лечению пациентки и еще до планового морфологического анализа, основываясь на интраоперационных особенностях, разработать примерный план лечения в адъювантном режиме. Но все же к применению данной методики нужно подходить с определенной осторожностью и тщательно отбирать пациенток, в первую очередь учитывая, что лучевая терапия и химиотерапия в процессе комплексного лечения могут способствовать возникновению некоторых видов осложнений.
Сведения об авторах:
Солодкий Владимир Алексеевич — академик РАН, профессор, директор ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-1641-6452.
Ходорович Ольга Сергеевна — д.м.н., руководитель клиники комплексных методов диагностики и лечения заболеваний молочной железы ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-6014-4597.
Калинина-Масри Алена Анатольевна — к.м.н., хирург клиники комплексных методов диагностики и лечения заболеваний молочной железы ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-8265-1848.
Тащян Агван Алексанович — к.м.н., врач-хирург отделения хирургических методов лечения и противоопухолевой лекарственной терапии опухолей молочной железы с койками хирургии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86.
Шерстнева Татьяна Викторовна — к.м.н., заведующая отделением комплексной диагностики заболеваний молочной железы ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-3261-0984.
Клешнева Виктория Олеговна — младший научный сотрудник лаборатории рентгенорадиологии научно-исследовательского отдела комплексной диагностики заболеваний и радиотерапии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-0802-2437.
Канахина Лия Бекетаевна — врач-рентгенолог лаборатории рентгенорадиологии научно-исследовательского отдела комплексной диагностики заболеваний и радиотерапии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0003-0260-1478.
Контактная информация: Калинина-Масри Алена Анатольевна, e-mail: kalinina-masri@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.05.2023.
Поступила после рецензирования 21.06.2023.
Принята в печать 14.07.2023.
About the authors:
Vladimir A. Solodkiy — Academician of the RAS, Professor, Director of the Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-1641-6452.
Olga S. Khodorovich — Dr. Sc. (Med.), Head of the Clinics of the Complex Diagnostic and Treatment Methods for Breast Disorders, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-6014-4597.
Alena A. Kalinina-Masri — C. Sc. (Med.), surgeon of the Clinics of the Complex Diagnostic and Treatment Methods for Breast Disorders, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-8265-1848.
Agvan A. Tashchyan — C. Sc. (Med.), surgeon of the Department of Surgical Treatment and Anticancer Drug Therapy for Breast Cancer with Surgical Beds, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation.
Tat’yana V. Sherstneva — C. Sc. (Med.), Head of the Department of the Complex Diagnostics for Breast Disorders, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-3261-0984.
Viktoriya O. Kleshneva — junior researcher of the Laboratory of X-ray Radiology of the Scientific Research Division of Complex Diagnostics and Radiotherapy, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-0802-2437.
Liya B. Kanakhina — radiologist of the Laboratory of X-ray Radiology of the Scientific Research Division of Complex Diagnostics and Radiotherapy, Russian Scientific Center for X-ray Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-0260-1478.
Contact information: Alena A. Kalinina-Masri, e-mail: kalinina-masri@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 26.05.2023.
Revised 21.06.2023.
Accepted 14.07.2023.
Информация с rmj.ru
