Введение
Общая заболеваемость злокачественными новообразованиями (ЗНО) головы и шеи у детей и подростков (0–19 лет) составляет 3,29 случая на 100 000 человеко-лет наблюдения [1], и большая часть этих случаев приходится на новообразования щитовидной железы. Внеорганные новообразования шеи у детей представляют собой редкую и клинически гетерогенную группу опухолей, включающую как доброкачественные, так и злокачественные формы, а также сосудистые мальформации [2, 3]. Многообразие морфологических вариантов, атипичная симптоматика и сложность визуализации затрудняют раннюю диагностику, особенно на догоспитальном этапе [4, 5]. В условиях ограниченного опыта учреждений первичного звена нередко возникают диагностические ошибки, влияющие на тактику лечения и прогноз. В то же время хирургическое лечение подобных новообразований сопряжено с относительно высоким риском развития интраоперационных неблагоприятных событий и послеоперационных осложнений [6]. В отечественной литературе отсутствуют обобщенные данные, отражающие опыт специализированных центров в диагностике и лечении внеорганных новообразований шеи у детей.
Цель исследования: оценить эффективность дифференциальной патоморфологической диагностики и проанализировать профиль послеоперационных осложнений у детей с внеорганными новообразованиями шеи в условиях специализированного референс-центра.
Содержание статьи
Материал и методы
Проведено ретроспективное одноцентровое исследование, включающее изучение клинико-демографических, диагностических и хирургических данных детей с внеорганными новообразованиями шеи, перенесших хирургическое лечение в отделении хирургии опухолей головы и шеи ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России (НМИЦ ДГОИ) в период с января 2012 г. по декабрь 2022 г. Пациентов включали в исследование согласно предварительно определенным критериям соответствия.
Критерии включения в исследование: возраст 0–17 лет, верифицированное внеорганное новообразование шеи, хирургическое лечение с последующим морфологическим подтверждением диагноза.
Критерии невключения: отсутствие хирургического удаления новообразования.
Критерии исключения: отсутствие в медицинской документации данных, необходимых для расчета комплексного индекса осложнений (Comprehensive Complication Index, СCI).
Проанализированы корректность и источник установления инициального патоморфологического диагноза (по месту жительства, в референс-центре, в сторонних учреждениях). В качестве референс-центров рассматриваются специализированные учреждения РФ, признанные в этом качестве согласно приказу Минздрава России № 1372 от 25.12.2020. В случаях пересмотра гистологических препаратов в НМИЦ ДГОИ регистрировали факт диагностической корректировки.
У всех пациентов оценивали тип хирургического вмешательства, его объем и интраоперационные критические инциденты. Послеоперационные осложнения классифицировали по шкале Clavien — Dindo (CDC) и рассчитывали CCI.
При анализе выживаемости рассчитывали бессобытийную выживаемость (БСВ) от момента операции до развития локального рецидива. Рецидивы классифицировали как локальные в случаях их расположения в области шеи, соответствующей зоне хирургического вмешательства. При этом, учитывая высокую гетерогенность нозологий, топографо-анатомические границы данной зоны уточняли индивидуально для каждого пациента. БСВ стратифицировали по степени тяжести послеоперационных осложнений.
Статистическую обработку полученных данных проводили с использованием программного обеспечения IBM SPSS Statistics, версия 26.0 (IBM, США). Перед описанием количественных показателей оценивали распределение данных с применением критерия Шапиро — Уилка, расчетом коэффициентов асимметрии и эксцесса, а также графическим анализом (гистограммы, Q–Q диаграммы). При отсутствии нормального распределения использовали медиану (Ме) с 1-м и 3-м квартилями, минимальными и максимальными значениями. Применяли критерии Манна — Уитни и Краскела — Уоллиса, χ2-критерий Пирсона с поправкой на правдоподобие. Выживаемость оценивали методом Каплана — Мейера с применением логрангового теста Breslow. Статистически значимыми считали различия при p<0,05, а также р<0,017 в случае попарного сравнения 3 и более групп.
Дизайн исследования был одобрен локальным этическим комитетом ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» (протокол № 5/2023 от 20.06.2023). Все пациенты (или их законные представители) подписали информированное согласие на использование медицинской информации в научно-исследовательских целях.
Результаты и обсуждение
В течение 10 лет (2012–2022 гг.) в профильном отделении НМИЦ ДГОИ было выполнено хирургическое вмешательство у 430 пациентов с различной патологией шеи: внеорганными солидными новообразованиями, сосудистыми мальформациями и поражением лимфатических узлов. В соответствии с заранее определенными критериями отбора в итоговый анализ были включены 153 пациента (35,6% от общего числа наблюдений). Остальным пациентам хирургическое лечение в объеме удаления новообразования не проводили: 60 (13,9%) пациентам потребовалась склеротерапия лимфатических мальформаций (ЛМ), у 217 (50,5%) диагностирована лимфаденопатия различной этиологии (преимущественно вторичное метастатическое поражение).
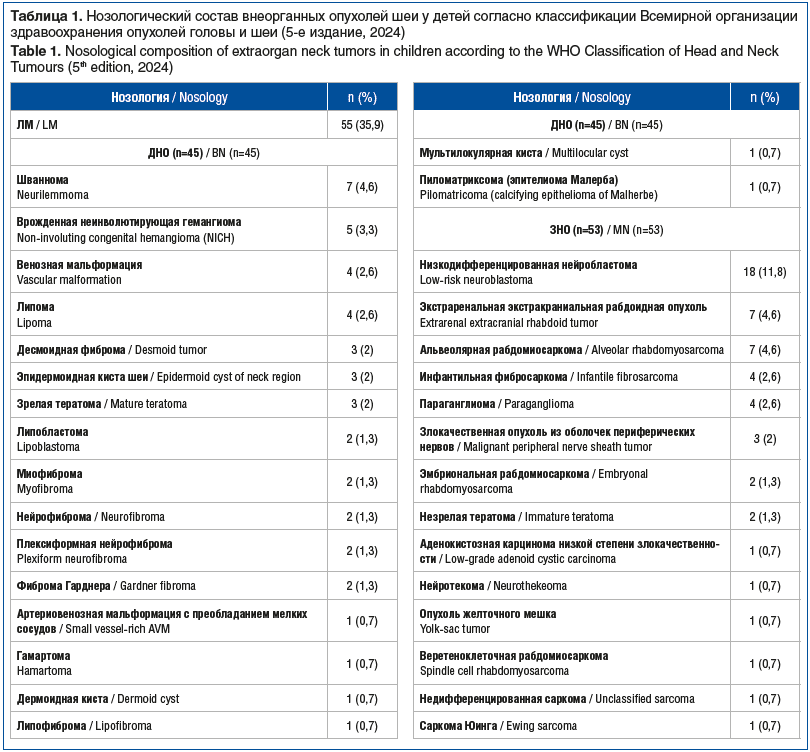
Финальная выборочная совокупность включала 78 девочек и 75 мальчиков, что отражает равномерное половое распределение. У всех пациентов была верифицирована одна из форм внеорганной патологии шеи: ЛМ или новообразование доброкачественного либо злокачественного характера. Распределение пациентов по диагностическим группам демонстрировало клинико-нозологическую гетерогенность: ЛМ были обнаружены у 55 (36,0%) пациентов, доброкачественные новообразования (ДНО) — у 45 (29,4%), ЗНО — у 53 (34,6%). Сопоставимая численность пациентов в каждой группе обеспечила возможность адекватного статистического сравнения клинических, диагностических и лечебных характеристик в рамках ретроспективного анализа. Нозологический состав внеорганных опухолей шеи у детей, данные которых были включены в исследование, представлен в таблице 1.
Клинические жалобы были проанализированы в разрезе 3 диагностических групп: ЛМ (группа ЛМ, n=55), ДНО (группа ДНО, n=45) и ЗНО (группа ЗНО, n=53). Оценивали частоту предъявления жалоб в дебюте заболевания и на момент поступления в стационар, что позволило выявить тенденции к эскалации симптомов по мере прогрессирования патологического процесса.
Объемное образование в области шеи
Опухолевое образование шеи — наиболее стабильный и универсальный симптом в исследуемой группе пациентов. В группе ЛМ частота этого симптома увеличилась с 92,7% в дебюте заболевания до 96,4% к моменту госпитализации, в группе ДНО данный симптом сохранялся у 100% пациентов на обоих этапах наблюдения, а в группе ЗНО при первичной диагностике жалобы на объемное образование шеи были у 64,2% пациентов, а к моменту госпитализации — у 73,6%.
Таким образом, наличие пальпируемого образования оставалось основным поводом для первичного обращения к врачу и сохраняло высокую клиническую значимость до момента госпитализации.
Дыхательные нарушения
Выраженная эскалация дыхательных нарушений отмечена преимущественно в группах ЛМ и ДНО: в группе ЛМ частота жалоб на дыхательные нарушения увеличилась с 1,8% при дебюте заболевания до 14,5% на момент госпитализации, в группе ДНО — с 11,3 до 24,5% соответственно. В группе ЗНО дыхательные нарушения отмечали 2,2% пациентов только на момент поступления в стационар.
Увеличение частоты респираторной симптоматики может свидетельствовать о компрессии дыхательных путей вследствие увеличения объема образования или вовлечения в процесс средостения и нижней трети шеи.
Неврологические нарушения
Наиболее значительная динамика неврологической симптоматики зафиксирована в группе ЗНО: в дебюте заболевания жалобы отсутствовали у всех пациентов, тогда как при госпитализации 37,7% пациентов предъявляли жалобы на неврологические нарушения, в группе ЛМ частота таких жалоб увеличилось с 0 до 10,9%, в группе ДНО — с 0 до 11,1%.
Такая динамика может указывать на распространение патологического процесса: вовлечение в ткань опухоли или сдавление тканями опухоли невральных структур.
Дисфагия
При первичной диагностике заболевания жалоба на затрудненное глотание регистрировалась исключительно в группе ЗНО у 1,9% пациентов. К моменту поступления в стационар дисфагия наблюдалась у 21,8% пациентов группы ЛМ и у 7,5% пациентов группы ЗНО. У пациентов группы ДНО симптом не наблюдался.
Увеличение частоты дисфагии в группе пациентов с ЛМ, вероятно, связано с преимущественной медиальной локализацией образований и их компримирующим воздействием на гортаноглоточные и пищеводно-глоточные структуры.
Увеличение и/или болезненность лимфатических узлов
Данный симптом не продемонстрировал существенной динамики. Частота встречаемости симптома при первичном обращении и на момент госпитализации в профильное отделение составляла 9,1 и 12,7% в группе ЛМ, 8,9 и 13,3% в группе ДНО, 11,3 и 13,2% в группе ЗНО соответственно, что свидетельствует об ограниченном диагностическом значении симптома для внеорганных образований, не связанных с метастатическим поражением лимфатических узлов.
Полученные данные указывают на существенное нарастание компрессионной симптоматики (дыхательной, глотательной, неврологической) по мере прогрессирования заболевания и задержки госпитализации. Особенно выраженная эскалация клинических проявлений отмечена в группе ЗНО, что подчеркивает необходимость раннего направления пациентов в специализированные учреждения при наличии даже изолированного объемного образования в области шеи.
Анализ клинико-демографических характеристик, представленный в таблице 2, выявил ряд статистически и клинически значимых различий между диагностическими группами. Пациенты с ЛМ отличались наиболее ранним возрастом дебюта заболевания, что коррелировало с более высокой долей пренатальной диагностики по сравнению с группами ДНО и ЗНО. Напротив, у пациентов с ДНО диагноз верифицировали значительно позже, при этом продолжительность диагностического периода была наибольшей, что может отражать относительно медленное течение и вариабельную клиническую картину у пациентов группы ДНО.
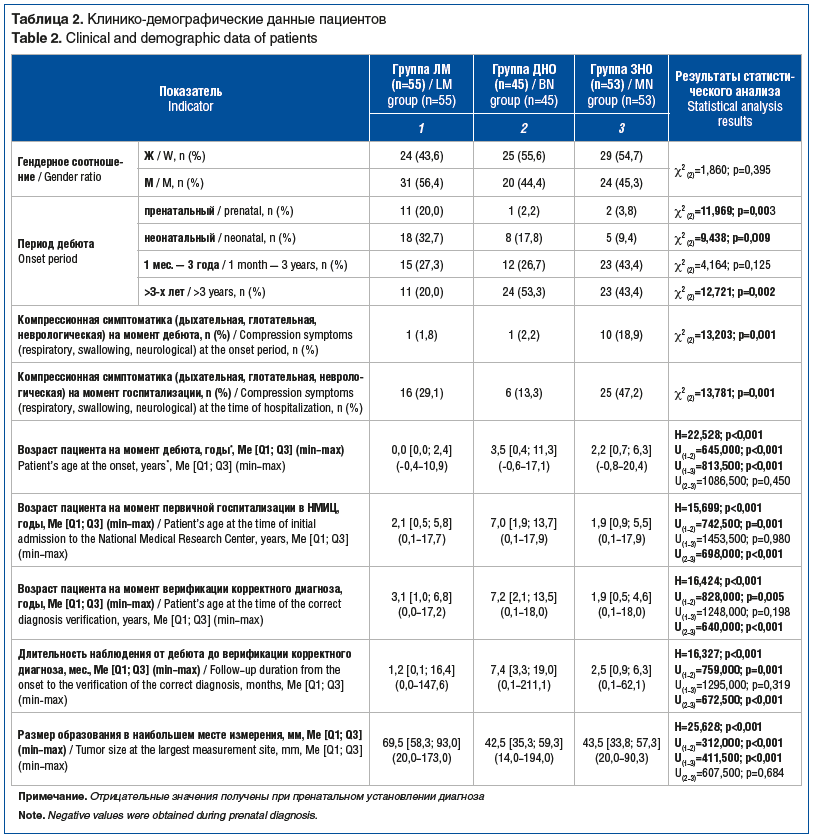
Клинически наиболее значимая компрессионная симптоматика наблюдалась у пациентов с ЗНО. Уже в дебюте заболевания она регистрировалась у 18,9% пациентов группы ЗНО, тогда как в группах ЛМ и ДНО — только у 1,8 и 2,2% соответственно. К моменту госпитализации этот показатель возрастал до 47,2% в группе ЗНО, до 29,1% — в группе ЛМ и до 13,3% — в группе ДНО, что подчеркивает динамическую прогрессию клинических проявлений у детей при внеорганных ЗНО шеи.
Максимальный размер образований был зарегистрирован у пациентов с ЛМ и статистически значимо превышал размеры опухолей в других группах.
Таким образом, продемонстрировано, что каждая нозологическая категория характеризуется специфическим возрастом манифестации, темпами клинико-диагностической эволюции и выраженностью симптомов, что необходимо учитывать при формировании маршрутов ранней дифференциальной диагностики и планировании хирургического вмешательства.
Сравнительный анализ инвазивных диагностических процедур, проведенных до поступления в стационар, выявил выраженные различия между диагностическими группами.
Так, тонкоигольную пункционную аспирационную биопсию применяли нерегулярно и вне зависимости от нозологической категории: у 6 (10,9%) пациентов в группе ЛМ, у 1 (2,2%) — в группе ДНО и у 9 (17,0%) — в группе ЗНО. Тем не менее различия оказались статистически значимыми (χ2(2)=6,726; p=0,035), что может указывать на отсутствие единой тактики оценки внеорганных шейных образований на догоспитальном этапе.
Инцизионную биопсию чаще применяли при ЗНО — у 35 (66,0%) пациентов, значительно реже при ДНО — у 9 (20,0%) и в единичных случаях при ЛМ — у 4 (7,3%) пациентов; (χ2(2)=48,718; p<0,001).
В части случаев (у 5 (14,3%) пациентов с ЗНО) инцизионную биопсию выполняли в других референс-центрах до поступления в НМИЦ ДГОИ.
Частота попыток удаления образования была сопоставима во всех группах: у 14 (25,5%) пациентов в группе ЛМ, у 16 (35,6) — в группе ДНО и у 11 (20,8) — в группе ЗНО. Статистически значимых различий не установлено (χ2(2)=2,751; p=0,253), что может свидетельствовать о недостаточной настороженности в отношении природы образований и попытках преждевременного хирургического вмешательства без морфологической верификации.
Инициальное патоморфологическое исследование было выполнено в одном из признанных референс-центров (включая НМИЦ ДГОИ) в 77 случаях:
-
в 37 (67,3%) случаях у пациентов с ЛМ;
-
в 24 (53,3%) — у пациентов с ДНО;
-
в 16 (30,2%) — при ЗНО (χ2(2)=15,448; p<0,001).
Важно отметить, что при ЛМ не рекомендуется проводить пункционную или инцизионную биопсию в качестве метода дифференциальной диагностики, что обусловливает такую высокую частоту инициальной патоморфологической диагностики в условиях референс-центра.
В 73 случаях биоптат или операционный материал направлялся для пересмотра в НМИЦ ДГОИ:
в 28 (38,4%) случаях с заключением патоморфологического исследования, выполненного по месту жительства: у 5 (9,1%) пациентов с ЛМ, у 5 (11,1%) — с ДНО и у 18 (34,0%) — с ЗНО, что демонстрирует статистически значимую (χ2(2)=30,204; p<0,001) тенденцию к более частой внешней морфологической верификации ЗНО;
при отсутствии заключения патоморфологической службы по месту жительства материал направлялся только в группе ЗНО (в 10 (18,9%) случаях), что может отражать как клиническую настороженность в случаях, когда первичная гистологическая диагностика отсутствовала либо вызывала сомнения, так и недостаточность региональных диагностических ресурсов;
в 5 (3,3%) из всех случаев, несмотря на отсутствие предварительного направления, пересмотр был выполнен непосредственно на этапе поступления пациента в НМИЦ ДГОИ: в 1 (2,2%) случае в группе ДНО и в 4 (7,5%) — в группе ЗНО.
Пересмотр в НМИЦ ДГОИ не проводили у 38 (24,8%) пациентов: у 18 (32,7%) с ЛМ, у 5 (33,3%) с ДНО и у 5 (9,4%) с ЗНО. Данные различия статистически значимы (χ2(2)=11,570; p=0,003), что указывает на более высокую частоту централизованного пересмотра при подозрении на злокачественный процесс.
Таким образом, пациенты с ЛМ и ДНО чаще поступают в НМИЦ ДГОИ без предварительной морфологической верификации, поэтому высока доля инициальных патоморфологических исследований, выполненных непосредственно в федеральном учреждении. Напротив, пациентов с подозрением на ЗНО чаще направляют в НМИЦ ДГОИ уже с заключением, выполненным по месту жительства, однако такие заключения нередко требуют повторной верификации. Результаты оценки эффективности дифференциальной патоморфологической диагностики внеорганных новообразований в области шеи представлены в таблице 3.
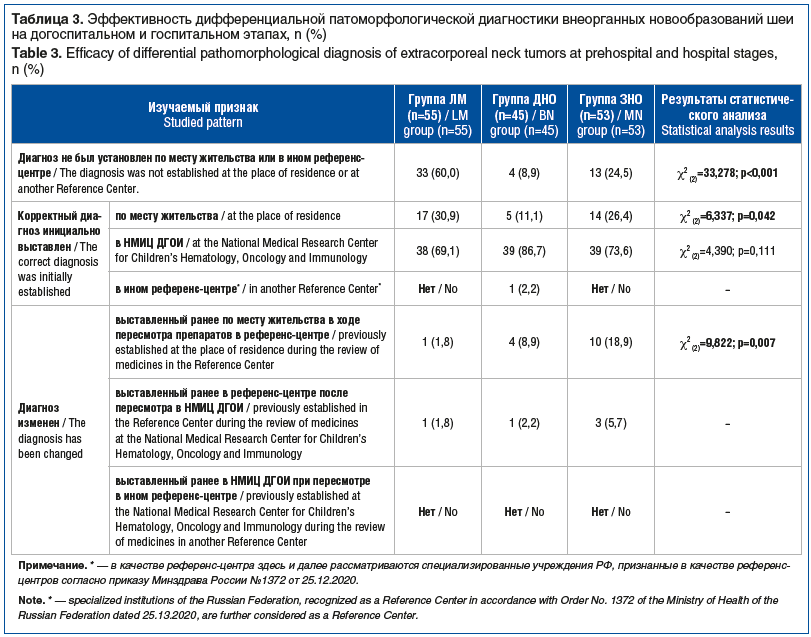
Согласно полученным данным инициально корректный диагноз в большинстве случаев устанавливали в условиях НМИЦ ДГОИ — у 116 (75,8%) пациентов (χ2(2)=204,41; p<0,001). Значительно реже верный диагноз был сформулирован по месту жительства — в 36 (23,5%) наблюдениях. В 1 (0,7%) случае диагноз был подтвержден при первичном морфологическом исследовании, проведенном в другом референс-центре. Учитывая крайне ограниченное количество наблюдений диагностики вне НМИЦ ДГОИ, обобщающие выводы в отношении других референсных учреждений требуют осторожности. В 20 (13,1%) случаев пересмотр гистологических препаратов, выполненный в НМИЦ ДГОИ, привел к корректировке ранее установленного диагноза: наиболее часто диагноз был изменен у пациентов с ЗНО — у 10 (18,9%) пациентов, реже — при ДНО — у 4 (8,9%) и при ЛМ — у 1 (1,8%). Эти различия достигли статистической значимости (χ2(2)=9,822; p=0,007), что подчеркивает более высокий риск диагностической ошибки при злокачественном процессе.
Кроме того, смена диагноза, установленного ранее в другом референс-центре, была зафиксирована в 5 случаях: в 3 (5,7%) при ЗНО, в 1 (2,2%) при ДНО и в 1 (1,8%) при ЛМ.
Полученные данные демонстрируют выраженную неоднородность в подходах к догоспитальной диагностике внеорганных новообразований шеи у детей. Отсутствие единой тактики ведет к нерегулярному применению инвазивных методов диагностики, недостаточной морфологической верификации на этапе первичного обращения и, как следствие, к диагностическим ошибкам. Наиболее часто необходимость в диагностическом пересмотре и смене диагноза возникает при ЗНО, что подчеркивает клиническую значимость централизованной патоморфологической экспертизы в условиях специализированного учреждения.
Трудности на этапе морфологической верификации напрямую связаны с определением тактики лечения и объема хирургического вмешательства. В этой связи особую актуальность приобретает анализ профиля интра- и послеоперационных осложнений, сопровождающих лечение пациентов с различными типами внеорганных новообразований шеи.
Интраоперационные критические инциденты были выявлены в 17 (11,1%) случаях. Интраоперационные неблагоприятные события зарегистрированы у 30 (19,6%) пациентов. Из них «малые» (
Анализ послеоперационного периода показал, что клинически значимые осложнения, соответствующие ≥IIIa степени по CDC, были выявлены у 20 (13,1%) пациентов. Распределение осложнений выглядело следующим образом: I степень — 23 (15,0%); II степень — 15 (9,8%); IIIa степень — 1 (0,7%); IIIb степень — 9 (5,9%); IVa степень — 10 (6,5%); IVb и V степени — не зарегистрировано. В 25 (43,1%) случаях было отмечено более одного осложнения у одного пациента: у 12 (20,7%) — 2, у 10 (17,2%) — 3 и у 3 (5,2%) — 4.
Расчет CCI продемонстрировал значение Ме 0 [0,0; 20,9] для всей когорты и 21,8 [8,7; 32,4] среди пациентов с осложнениями. Ни в одном случае не зафиксировано развития мультиорганной недостаточности или летального исхода.
Из 99 зарегистрированных осложнений (у 58 пациентов) наибольшую долю составили неврологические — 55 (55,6%). Среди них чаще всего встречались:
синдром Горнера у 12 (21,8%) пациентов, из них персистирующий у 3 (5,5%);
нейропатия маргинальной ветви лицевого нерва у 14 (25,5%) пациентов, в 2 (3,6%) случаях — стойкая;
верхний монопарез в 5 (9,1%) случаях;
парез трапециевидной грудино-ключично-сосцевидной мышцы у 3 (5,5%) пациентов;
плексопатия плечевого сплетения у 4 (7,3%) пациентов, стойкая — у 1 (1,8%).
Большинство неврологических нарушений носили транзиторный характер (49 (89,1%) случаев), медианное время восстановления функции составило 6,9 [3,1; 7,4] нед.
Среди всех осложнений раневые встретились в 15 (15,2%) случаях, инфекционные — в 12 (12,1%), дыхательные расстройства различного генеза — в 8 (8,1%), прочие — в 9 (9,1%). Структура осложнений соответствовала анатомическому распространению новообразований.
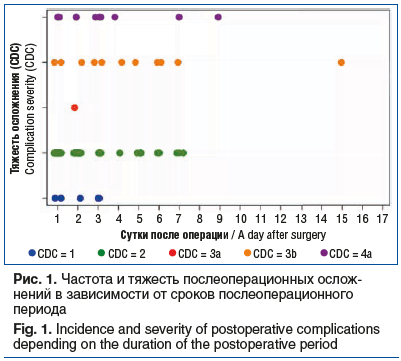
Частота и тяжесть послеоперационных осложнений в зависимости от сроков послеоперационного периода представлены на рисунке 1.
Согласно данным, представленным на рисунке 1, большинство послеоперационных осложнений развиваются в ранние сроки — в течение первых 5 сут. Легкие осложнения (CDC
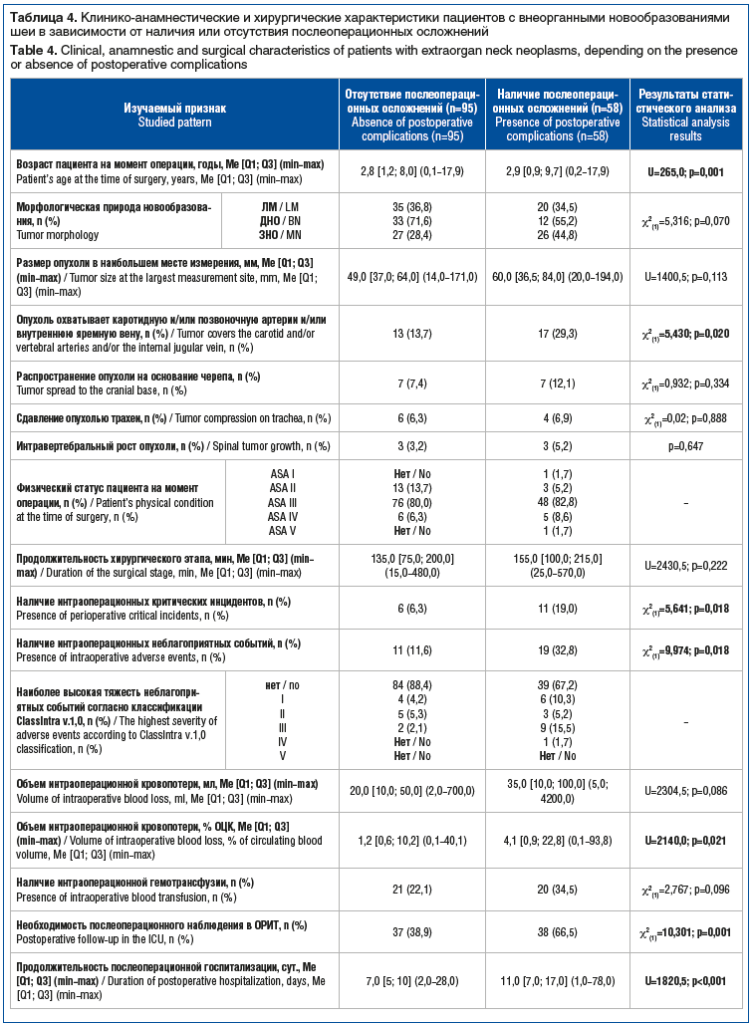
Подробнее клинические данные пациентов представлены в таблице 4.
Согласно данным, представленным в таблице 4, развитие послеоперационных осложнений у детей с внеорганными новообразованиями шеи статистически значимо ассоциировано со следующими факторами:
сосудистой инвазией;
более высокой частотой интраоперационных критических инцидентов;
интраоперационными неблагоприятными событиями;
увеличенным объемом кровопотери относительно объема циркулирующей крови (ОЦК) — в отсутствие клинически значимых различий;
необходимостью наблюдения в отделении реанимации и интенсивной терапии;
пролонгированной послеоперационной госпитализацией.
Результаты анализа этих данных подчеркивают значение индивидуализированной оценки риска при планировании хирургического вмешательства.
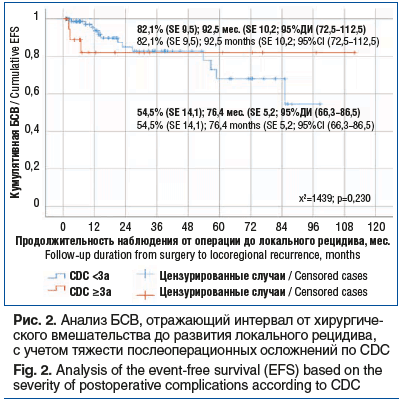
На рисунке 2 представлены кривые БСВ, отражающие интервал времени от хирургического вмешательства до локального рецидива, с учетом тяжести послеоперационных осложнений по CDC.
Согласно данным, представленным на рисунке 2, у пациентов с осложнениями низкой степени тяжести (CDC
Проведенный логранговый анализ не выявил статистически значимой разницы между кривыми выживаемости (χ2(1)=1,439; p=0,230), выявленная тенденция может указывать на косвенное влияние других факторов, включая особенности опухолей, объем вмешательства и индивидуальную стратегию ведения пациента.
Таким образом, внеорганные новообразования шеи у детей представляют собой редкую, но клинически значимую группу патологий, требующую высокой настороженности и мультидисциплинарного подхода. В условиях ограниченного объема накопленного опыта и отсутствия стандартизированных протоколов, ведущую роль играет наблюдение в специализированных центрах, обеспечивающих точную морфологическую верификацию и безопасное хирургическое лечение.
Результаты настоящего исследования свидетельствуют о высоком уровне диагностических расхождений на догоспитальном этапе, что согласуется с данными, представленными в исследованиях [7, 8], где также отмечена необходимость повторного морфологического анализа в условиях федерального центра при редких опухолях головы и шеи.
Профиль послеоперационных осложнений в настоящей работе сопоставим с международными данными [9–11], в том числе у взрослых пациентов [12], однако в литературе в качестве наиболее частого послеоперационного осложнения отмечены раневые инфекции [11] и осложнения, требующие повторной госпитализации пациента [10], в то время как для описанной нами когорты наиболее частыми осложнениями остаются транзиторные неврологические нарушения, не требующие хирургического вмешательства или повторной госпитализации.
Проведенный анализ не подтвердил наличие ассоциации между тяжестью послеоперационных осложнений и продолжительностью БСВ, о которой ранее сообщалось в литературе [13–15]: послеоперационные осложнения не влияли на риск локального рецидива.
Проведенное исследование продемонстрировало, что внеорганные новообразования шеи у детей представляют собой крайне гетерогенную группу заболеваний, отличающихся по возрасту манифестации, клиническим проявлениям, диагностическим маршрутам и рискам хирургического лечения. Эффективность дифференциальной патоморфологической диагностики значительно возрастала при обследовании в условиях специализированного референс-центра: корректный диагноз был установлен преимущественно в НМИЦ ДГОИ, а случаи его пересмотра чаще наблюдались при ЗНО.
Анализ послеоперационного периода показал, что частота и тяжесть осложнений были чаще ассоциированы с сосудистой инвазией, интраоперационными критическими инцидентами и необходимостью интенсивной терапии, что требует индивидуализированной предоперационной оценки риска. При этом большинство осложнений были транзиторными, а интраоперационная и госпитальная летальность отсутствовала.
Сведения об авторах:
Полев Георгий Александрович — к.м.н., старший научный сотрудник отдела хирургии головы и шеи и реконструктивно-пластической хирургии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России; 117997, Россия, г. Москва, ул. Саморы Машела, д. 1; руководитель Центра хирургии головы и шеи АО «Ильинская больница»; 143421, Россия, Московская обл., г. Красногорск, д. Глухово, ул. Рублевское Предместье, д. 2, корп. 2; ORCID iD 0000-0002-7175-6417
Грачев Николай Сергеевич — д.м.н., профессор, генеральный директор ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России; 117997, Россия, г. Москва, ул. Саморы Машела, д. 1; ORCID iD 0000-0002-4451-3233
Оганесян Раиса Суреновна — детский хирург отделения детской онкологии, хирургии головы и шеи и нейрохирургии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России; 117997, Россия, г. Москва, ул. Саморы Машела, д. 1; ORCID iD 0000-0002-1698-2956
Яременко Екатерина Юрьевна — лаборант группы хирургии головы и шеи с реконструктивно-пластической хирургией ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России; 117997, Россия, г. Москва, ул. Саморы Машела, д. 1; ORCID iD 0000-0003-1196-5070
Контактная информация: Полев Георгий Александрович, e-mail: dr.polev@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.06.2025.
Поступила после рецензирования 30.06.2025.
Принята в печать 23.07.2025.
About the authors:
Georgy A. Polev — C. Sc. (Med.), Senior Researcher at the Department of Head and Neck Surgery and Reconstructive Plastic Surgery, Dmitry Rogachev National Medical Research Center for Children’s Hematology, Oncology and
Immunology; 1, Samory Mashela str., Moscow, 117997, Russian Federation; Head of the Surgery Center of Head and Neck, Ilyinskaya Hospital JSC; 2 build. 2, Rublevskoe Predmestie str., Moscow, 143421, Russian Federation; ORCID iD 0000-0002-7175-6417
Nikolay S. Grachev — Dr. Sc. (Med.), Professor, General Director of the Dmitry Rogachev National Medical Research Center for Children’s Hematology, Oncology and Immunology; 1, Samory Mashela str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-4451-3233
Raisa S. Oganesyan — Pediatric Surgeon at the Department of Pediatric Oncology, Head and Neck Surgery and Neurosurgery, Dmitry Rogachev National Medical Research Center for Children’s Hematology, Oncology and Immunology; 1, Samory Mashela str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-1698-2956
Ekaterina Yu. Yaremenko — Laboratory Assistant at the Group of Head and Neck Surgery with Reconstructive Plastic Surgery, Dmitry Rogachev National Medical Research Center for Children’s Hematology, Oncology and Immunology; 1, Samory Mashela str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-1196-5070
Contact information: Georgy A. Polev, e-mail: dr.polev@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.06.2025.
Revised 30.06.2025.
Accepted 23.07.2025.
Заключение
Информация с rmj.ru
