Введение
Смертность от ишемической болезни сердца (ИБС) существенно снизилась за последние два десятилетия среди пациентов как молодого, так и пожилого возраста [1]. Эта тенденция объясняется несколькими факторами, среди которых наиболее важны снижение распространенности факторов риска, повышение доступности реваскуляризации и более эффективная вторичная профилактика с помощью фармакологической терапии [2].
Несмотря на улучшение неотложной терапии острого коронарного синдрома (ОКС), вторичная профилактика продолжает играть важную роль в кардиологической помощи, поскольку она эффективна как на индивидуальном, так и на популяционном уровне [3] и ассоциируется со значительным снижением смертности после ОКС [4].
Однако на современном этапе для проведения эффективной вторичной профилактики необходим индивидуальный (персонифицированный) подход [5], в том числе выявление у конкретного пациента факторов риска, актуальных для него, и терапевтическое воздействие именно на них. Индивидуально ориентированная помощь предложена в качестве центрального компонента эффективного, доступного и высококачественного подхода в здравоохранении [6].
Постоянно ведется поиск новых факторов риска развития и прогрессирования сердечно-сосудистых заболеваний (ССЗ). В частности, большое внимание уделяется изучению генетической предрасположенности, а именно оценке роли однонуклеотидных замен или полиморфизмов (single-nucleotide polymorphism, SNP) в генах, кодирующих белки, участвующие в патогенезе развития данной патологии [7]. Например, показано, что концентрация фибриногена в плазме крови — независимый фактор риска ИБС или инсульта [8, 9], а с повышенным содержанием фибриногена в плазме и ишемическим инсультом ассоциируется SNP гена, кодирующего фибриноген, — FGB-455 G/A [10].
В патогенезе заболеваний, связанных с нарушением регуляции системы фибринолиза, особое место занимает ингибитор активатора плазминогена 1-го типа (PAI-1), который обеспечивает равновесие между фибринолитическим действием плазмина и его дефицитом, а снижение его активности может привести к повышенному риску крово-течения. За синтез PAI-1 отвечает одноименный ген PAI 1 (SERPINE1, Serpin peptidase inhibitor, clade E), генетические мутации которого влияют на активность системы фибринолиза. Полиморфизмы в гене PAI-1 могут способствовать изменению биосинтеза его продукта, что приведет к ослаблению системы фибринолиза за счет ограничения превращения плазминогена в плазмин [11].
Эндотелин 1 (EDN-1), представляющий собой мощный сосудосуживающий пептид, продуцируемый эндотелиальными клетками, — важный фактор риска развития ССЗ. В исследованиях была показана независимая связь SNP Lys198Asn гена EDN1 и ряда заболеваний, таких как артериальная гипертензия [12], сердечная недостаточность [13], легочная гипертензия [14]. Именно поэтому SNP Lys198Asn считают фактором риска развития ССЗ и цереброваскулярных заболеваний.
Цель исследования: оценить прогноз у пациентов, перенесших ОКС с подъемом сегмента ST, в зависимости от полиморфизмов в генах, кодирующих β-фибриноген, эндотелин 1 и ингибитор активатора плазминогена 1-го типа.
Содержание статьи
Материал и методы
В одноцентровое открытое проспективное наблюдательное исследование, выполненное на базе ГБУ РО ОККД (Рязань), были включены 94 пациента с ОКС с подъемом сегмента ST, которые проходили стационарное лечение с 2016 по 2020 г. Продолжительность наблюдения составила 32,0±3,4 мес. Исследование было одобрено локальным этическим комитетом.
Критерии включения в исследование: подписанное информированное согласие; возраст от 25 до 70 лет; ОКС с подъемом сегмента ST; проведенные коронароангиография и эндопротезирование коронарных артерий; прием клопидогрела (оригинального или воспроизведенного).
Критерии исключения: тяжелая артериальная гипертензия (систолическое артериальное давление (САД) ≥180 мм рт. ст. и/или диастолическое артериальное давление (ДАД) ≥110 мм рт. ст.), не контролируемая приемом гипотензивных препаратов; серьезные сопутствующие заболевания, требующие активного медикаментозного лечения и/или с ожидаемой продолжительностью жизни <1 года; эрозивно-язвенные поражения желудочно-кишечного тракта в анамнезе; выраженные нарушения функций почек и печени; геморрагический синдром; авитаминоз К; прием >10 единиц алкоголя в неделю или анамнестические сведения об алкоголизме, наркомании, злоупотреблении лекарственными препаратами; участие в любых клинических испытаниях лекарственных препаратов за последние 30 дней; известная неэффективность/непереносимость клопидогрела.
Пациентам проводили стандартное обследование, включающее общий анализ крови, общий анализ мочи, биохимический анализ крови, коагулограмму, ультразвуковое исследование сердца, коронароангиографию, антропометрию (рост, масса тела с расчетом индекса массы тела (ИМТ)), измерение АД, частоты сердечных сокращений (ЧСС). Характеристика пациентов представлена в таблице 1.
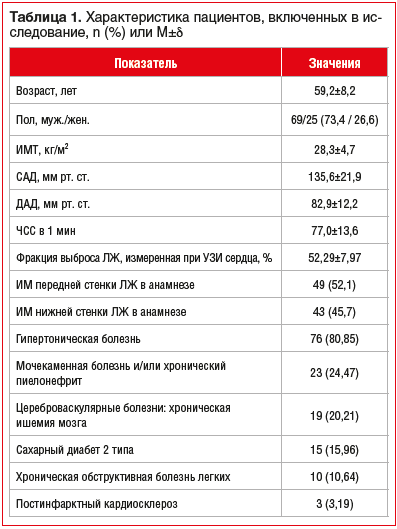
Пациенты получали терапию ОКС с подъемом сегмента ST согласно рекомендациям ЕОК (2017 г.) [15], включающую ацетилсалициловую кислоту, клопидогрел, ингибиторы ангиотензинпревращающего фермента (иАПФ), β-блокаторы, эноксапарин натрия, нитроглицерин, статины, диуретики, амиодарон (при пароксизме фибрилляции предсердий).
Дополнительно у всех пациентов утром натощак забирали образцы венозной периферической крови в вакуумные пробирки с антикоагулянтом К3-ЭДТА. Геномную ДНК выделяли методом фенол-хлороформной экстракции по стандартному протоколу (ООО «Научно-производственная фирма Литех», Россия). Генотипировали методом полимеразной цепной реакции (ПЦР) с электрофоретической детекцией.
Анализировали SNP генов, кодирующих β-фибриноген (FGB 455G-A), ингибитор активатора плазминогена 1-го типа (SERPINE (PAI) 1 675 5G/4G), эндотелин 1 (EDN1 Lys198Asn) в ЦНИЛ ФГБОУ ВО РязГМУ Минздрава России с помощью готовых наборов «SNP-ЭКСПРЕСС» (НПФ «Литех», Россия). У одного пациента SNP гена ингибитора активатора плазминогена 1-го типа определить не удалось, поэтому в анализ вошли показатели 93 пациентов.
Оценивали общую смертность от всех причин, сердечно-сосудистую (СС) смертность, частоту ОКС и повторного инфаркта миокарда (ИМ).
Полученные данные обрабатывали с помощью программ Statistica 8.0 (StatSoft, USA) и Excel (Microsoft, США). Количественные данные представлены в виде среднего арифметического и стандартного отклонения (M±δ, распределение данных было нормальным), качественные параметры представлены в виде частот (%). Частоты аллелей и генотипов полиморфизмов получали прямым подсчетом.
Статистическую значимость различий между частотами аллелей и генотипов анализировали с использованием критерия χ2. Статистически значимыми считали различия при р≤0,05.
Результаты исследования
Смертность от ССЗ составила 10,6% (n=10), от других причин — 4,3% (n=4); повторный ИМ развился у 18,1% (n=17) пациентов, повторный ОКС — у 20,2% (n=19).
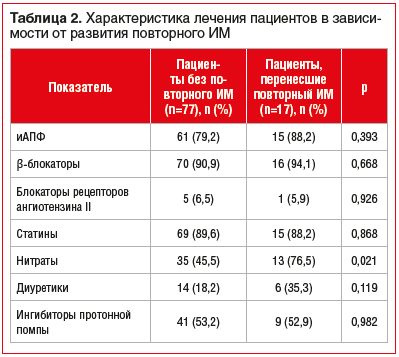
Исходы не зависели от схемы лечения пациентов, кроме случаев более частого назначения нитратов пациентам с развившимся повторным ИМ, по сравнению с пациентами без рецидива (табл. 2). Вероятнее всего, различия связаны с тем, что состояние пациентов с развившимся повторным ИМ было более тяжелым.
Полученные в ходе исследования данные о зависимости клинических исходов у пациентов с ОКС с подъемом сегмента ST от следующих SNP: FGB 455G-A, SERPINE (PAI) 1 675 5G/4G, EDN1 Lys198Asn представлены в таблицах 3–6.
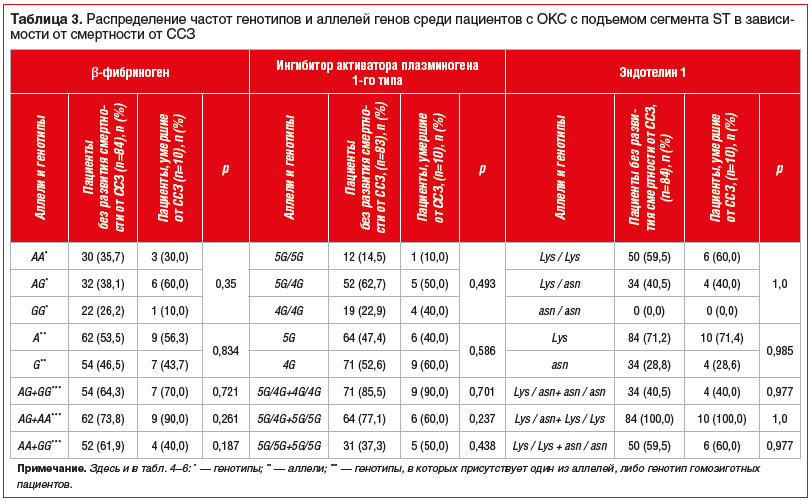
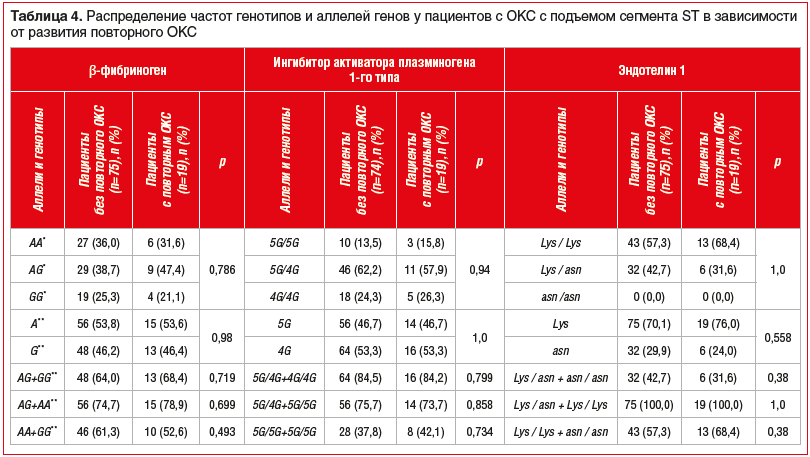
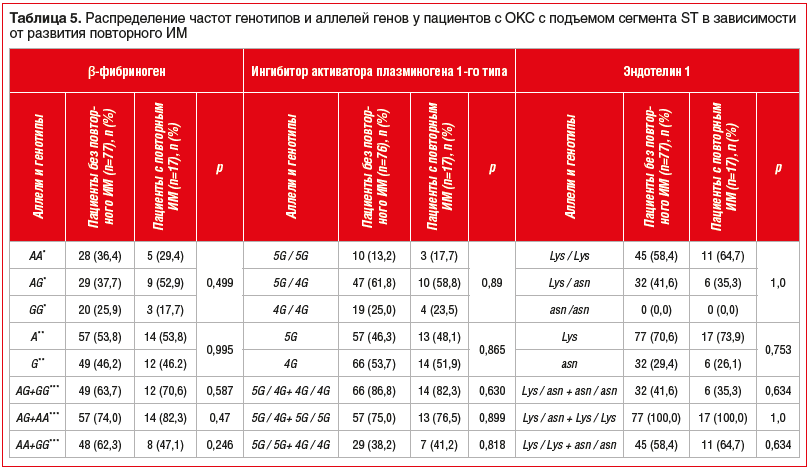
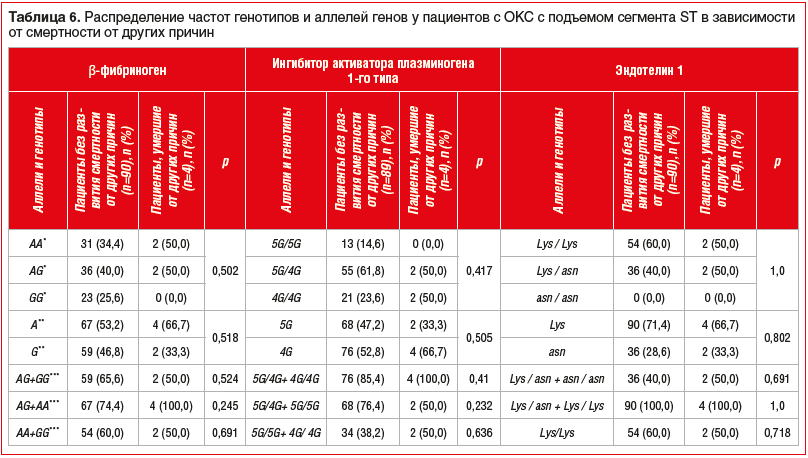
Равновесие определенных и ожидаемых частот встречаемости аллелей соответствовало закону распределения Харди — Вайнберга для FGB 455G-A, SERPINE (PAI) 1 675 5G/4G, в то время как для EDN1 Lys198Asn равновесие не было соблюдено.
Из представленных данных видно, что ни один из исследуемых генотипов и алеллей не ассоциировался с развитием смертности от ССЗ и других причин, развитием повторного ОКС и повторного ИМ.
Полученные результаты свидетельствуют о том, что изучаемые исходы у пациентов с ОКС с подъемом сегмента ST, вероятно, не зависят от SNP генов FGB 455G-A, SERPINE (PAI) 1 675 5G/4G, EDN1 Lys198Asn.
Обсуждение
Известно, что повышенный уровень фибриногена в плазме крови — независимый фактор риска инфаркта головного мозга, ИБС, венозного тромбоза и заболевания периферических артерий. При активации in vivo он превращается в фибрин с образованием тромбов с последующим гемостазом. Полимер фибриногена состоит из одиночных α-, β- и γ-цепей, кластеры генов для каждой из которых расположены на длинном плече 4 хромосомы (q28) [16]. Хотя мРНК для каждой из трех цепей синтезируется независимо, известно, что регуляция их транскрипции тесно связана. Было высказано предположение, что синтез β-фибриногена — лимитирующая стадия и наиболее важный фактор, влияющий на содержание фибриногена в плазме крови [17]. В метаанализе L. Iacoviello et al. [17] показали, что содержание фибриногена было выше у пациентов с аллелью А (в промоторе FGB) в большинстве случаев и ассоциировалось с развитием ССЗ.
Ген PAI1, кодирующий ингибитор активатора плазминогена 1-го типа, который считают основным регуляторным элементом тромболизиса, расположен на 7 хромосоме в области 7q21.3–q22 и содержит 8 интронов и 9 экзонов [18]. Среди вариантов гена PAI1 есть SNP с инсерцией/делецией гуанозина (4G/5G). Аллель 4G инсерционного/делеционного SNP 4G/5G, который присутствует в промоторной области, на 675 п.н. выше последовательности начала транскрипции гена PAI1, отвечает за высокие уровни PAI1 в плазме [19].
Ген эндотелина 1 человека (EDN1) содержит 5 экзонов и охватывает примерно 6,8 т.п.н. геномной дезоксирибонуклеиновой кислоты и расположен на хромосоме 6p23-p24. Транскрипция гена EDN1 человека дает мРНК размером 2,8 т.п.н., которая кодирует белок-предшественник из 212 аминокислот, пре-про-эндотелин 1 [20]. Фуриноподобные протеазы расщепляют пре-про-эндотелин 1 до белка из 38 аминокислот, называемого большой эндотелин 1. Заключительный этап расщепления опосредуется эндотелинпревращающими ферментами, которые расщепляют большой эндотелин 1 до активного эндотелина 1, состоящего из 21 аминокислоты [21]. SNP Lys198Asn вызывает изменения в пре-про-эндотелине 1, что приводит к повышению уровня эндотелина 1 [22].
В настоящем исследовании было показано, что изучаемые исходы (общая смертность, СС-смертность, повторный ИМ, повторный ОКС) у пациентов с ОКС с подъемом сегмента ST не зависят от SNP генов FGB 455G-A, SERPINE (PAI) 1 675 5G/4G, EDN1 Lys198Asn.
Видимо, данные SNP могут предрасполагать к развитию ССЗ, но у пациентов, уже перенесших ОКС, существенно не влияют на исход заболевания. С другой стороны, полученные данные могут рассматриваться как проявление эффективности проводимой терапии ССЗ, которая нивелирует предрасполагающие генетические факторы.
В ряде исследований были получены аналогичные результаты. Так, в работе S. Senol et al. [23] при оценке SNP Lys198Asn гена EDN1не было выявлено различий в частоте генотипов между пациентами, перенесшими операцию аортокоронарного шунтирования, без ИМ и пациентами после шунтирования и ИМ.
При анализе зависимости развития рестеноза стента у курящих и некурящих пациентов от SNP 5G/4G гена PAI1 было показано, что у некурящих пациентов с генотипом 4G/4G просвет стента сужался в большей степени по сравнению с некурящими пациентами с генотипом 4G/5G и 5G/5G. В то же время у курящих пациентов с генотипом 5G/5G просвет стента уменьшался значительнее как по сравнению с курящими пациентами с другими генотипами, так и по сравнению с некурящими пациентами с генотипом 5G/5G. Данные результаты свидетельствуют о том, что клиническое проявление SNP может зависеть от многих факторов [24].
Ограничениями данного исследования были: отсутствие пациентов с генотипом Asn/Asn (ген, кодирующий эндотелин 1), ограниченное число пациентов (n=94), отсутствие группы сравнения — пациентов без ОКС с подъемом сегмента ST.
Заключение
Таким образом, в ходе одноцентрового открытого проспективного наблюдательного исследования было установлено, что у пациентов, перенесших ОКС с подъемом сегмента ST, прогноз заболевания не зависит от SNP в генах, кодирующих β-фибриноген (FGB 455G-A), эндотелин 1 (EDN1 Lys198Asn) и ингибитор активатора плазминогена 1 (PAI1 675 5G/4G). Вероятно, данные SNP могут предрасполагать к развитию ССЗ, однако существенно не влияют на исход заболевания у пациентов, уже перенесших ОКС. Для дальнейшего изучения вклада SNP этих генов в развитие и прогрессирование ССЗ целесообразно увеличение количества наблюдений, оценка факторов, которые могут влиять на проявление данных SNP, а также изучение других SNP.
Информация с rmj.ru
