Введение
Кардиоренальный синдром (КРС) — комплексная полисистемная дисфункция, при которой нейрогуморальные механизмы, в частности избыточная активация ренин-ангиотензин-альдостероновой системы, экспрессия провоспалительных медиаторов и маркеров оксидантного стресса, приводящие по отдельности к сердечно-сосудистой недостаточности и нарушению почечной фильтрации, инициируют каскад последовательных взаимных негативных влияний, приводящих к формированию хронической сердечной недостаточности (ХСН) и хронической болезни почек (ХБП) [1]. Высокая — до 60% — распространенность КРС среди пациентов с ХСН обусловливает несомненную актуальность изучения патогенетических механизмов, способствующих его развитию и прогрессированию [2].
Фибрилляция предсердий (ФП) занимает особое место в формировании кардиоренального континуума, создавая сложный комплекс электрофизиологических и морфологических предпосылок для развития КРС [3]. Результаты регистра GARFIELD-AF, включавшего более 33 тыс. наблюдений, показали, что приблизительно у 30% пациентов с впервые выявленной ФП была диагностирована ХБП [4]. Тяжесть ХБП у больных, включенных в регистр, коррелировала с частотой и тяжестью сопутствующих сердечно-сосудистых заболеваний и, в наибольшей степени, ассоциировалась с ХСН. Несмотря на очевидную актуальность проблемы сочетания КРС с ФП, данных о взаимном влиянии ФП и сочетанного поражения сердца и почек в настоящее время не так много. В целом большинство исследователей сходится во мнении, что ФП негативно влияет на прогноз у пациентов с КРС, что заставляет искать механизмы этого воздействия и маркеры, способные их адекватно оценить.
Многокомпонентная коморбидность, в частности сочетание ХСН, ХБП и ФП, вносит существенные коррективы в применение общепринятых маркеров оценки тяжести каждого отдельного состояния, таких как скорость клубочковой фильтрации (СКФ), содержание N-терминального фрагмента мозгового натрийуретического пептида (NT-proBNP) и др. [5, 6]. В развитии аритмогенной готовности миокарда важна роль механизмов коллагенолиза, формирования фиброза и ремоделирования сердечно-сосудистого контура, поэтому можно предположить прогностическую ценность маркеров фиброза в отношении развития ФП на фоне существующего КРС [7].
Современные представления позволяют выделить два основных типа миокардиального фиброза — «реактивный» и «заместительный» [8]. Реактивный фиброз представляет собой изменение внеклеточного матрикса и периваскулярных пространств, приводящих к формированию коллагеновой «обертки» вокруг миокардиальных синцитиев. Эти изменения не приводят к существенному изменению их сократительной или релаксационной способности, но могут вызывать электрофизиологические изменения (например, ускорение проводимости), вызывающие или поддерживающие проаритмогенную активность. Заместительный, или восстановительный, фиброз представляет собой формирование фибротических очагов на месте погибших клеток миокарда. В этом случае проаритмогенная активность фиброза связана с массированным апоптозом миокардиоцитов, а также с возможным прерыванием путей проведения сформировавшимися фиброзными тяжами [8, 9]. Описанные механизмы позволяют, в числе прочего, объяснить развитие постоянной формы ФП и неудачные попытки восстановления синусового ритма в условиях выраженного фибротического ремоделирования.
Семейство металлопротеиназ и их ингибиторов представляется надежным инструментом оценки активности фиброза в миокарде, в том числе у больных с ФП [10]. Отмечается, что повышение активности металлопротеиназ способствует развитию аритмогенного фиброзирования и ремоделирования миокарда предсердий, создавая субстрат для развития ФП, а повышение концентрации тканевого ингибитора матриксных металлопротеиназ 1-го типа (TIMP-1) ассоциировано с повышением риска рецидива ФП после электрической кардиоверсии [10]. Перспективным маркером миокардиального фиброза, включая аритмогенное ремоделирование предсердий, также служит растворимый стимулирующий фактор роста, экспрессируемый геном 2 (soluble ST2, sST2) [11]. Являясь членом семейства интерлейкина 1, sST2 сверхэкспрессируется клетками эндотелия в ответ на миокардиальный стресс и перегрузку давлением [12] и рассматривается в настоящее время как многообещающий маркер наличия и тяжести ХСН [13]. В 2017 г. American College of Cardiology (ACC) впервые включила sST2 в рекомендации по лечению ХСН в качестве вспомогательного маркера, предложенного к использованию именно в тех случаях, когда существует избыточное стороннее влияние на концентрацию NT-proBNP [14].
Изложенные выше положения обусловили выбор TIMP-1 и sST2 в качестве кандидатов — предикторов развития постоянной формы ФП у больных КРС.
Цель исследования: изучить преимущества и недостатки маркеров фиброза TIMP-1 и sST2 как предикторов развития постоянной формы ФП у пациентов с КРС.
Содержание статьи
Материал и методы
В одномоментное когортное исследование были включены 198 пациентов с верифицированным КРС. Постоянная форма ФП диагностирована у 100 (50,5%) пациентов, у 98 (49,5%) зарегистрирован синусовый ритм. Диагноз КРС был установлен на основании верификации ХСН в соответствии с клиническими рекомендациям Российского кардиологического общества (РКО) [15]: клинические симптомы и/или признаки, повышение уровня NT-proBNP >365 пг/мл, систолическая дисфункция левого желудочка (ЛЖ) и/или наличие как минимум одного из дополнительных критериев — структурных изменений сердца или диастолической дисфункции ЛЖ; а также на основании верификации ХБП в соответствии с критериями KDIGO (Kidney Disease: Improving Global) Outcomes, 2012) [16]: СКФ <60 мл/мин/1,73 м2 продолжительностью >3 мес. ФП диагностирована в соответствии с клиническими рекомендациям РКО [17]: ФП при записи на стандартной 12-канальной электрокардиограмме (ЭКГ) или на протяжении всей записи одного отведения при длительном мониторировании ЭКГ.
Для оценки состояния коллагенового матрикса и выраженности процессов коллагенообразования в тканях определяли концентрацию ТIMP-1 в сыворотке крови методом иммуноферментного анализа (ИФА) с помощью реактива Aviscera Bioscience (США) и сравнивали с референсными значениями TIMP-1 (111–138 нг/мл). Также определяли концентрацию sST2 в сыворотке крови с использованием реактива Сritiсаl Diаgnоstiсs (США) методом ИФА и сравнивали с референсными значениями (1,75–34,3 нг/мл).
Для статистической обработки полученных данных использовали программы Statistica 11.0 (StatSoft, США) и MedCalc 11.5.0 (MedCalc Software, Бельгия). Для проверки закона нормальности распределения признаков в группах сравнения использовали критерии Шапиро — Уилка и Колмогорова — Смирнова. Для количественных признаков в сравниваемых группах рассчитывали медиану, 25-й и 75-й процентиль (1-й и 3-й квартиль) (Ме [Q1; Q3]). Для качественных номинальных признаков указывали абсолютную (количество обследованных) и относительную (%) частоту проявления признака. Оценку прогностической значимости кандидатов — предикторов развития ФП проводили с помощью логистического регрессионного анализа. Для оценки шансов развития клинического исхода в основной группе относительно шансов его развития в контрольной группе использовали методику определения отношения шансов (ОШ, 95% ДИ). Для оценки качества логистической регрессии применялся ROC (Receiver Operating Characteristic) — анализ с расчетом количественного показателя площади под кривой (AUC, Area Under Curve), который считали надежным показателем при значениях >0,5 при p<0,05. Для статистически значимых прогностических показателей был получен порог отсечения, оценивались его чувствительность и специфичность. За критическое значение уровня статистической значимости при проверке нулевых гипотез принят р<0,05.
Результаты исследования
В исследование было включено 87 (43,9%) мужчин и 111 (56,1%) женщин. Средний возраст пациентов, участвовавших в исследовании, составил 63,0 [56,0; 78,0] года. Средняя продолжительность ХСН составила 12,5 [5,5; 20,0] года, функциональный класс ХСН на момент включения в исследование был равен 3,0 [2,0; 3,0]. У 88 (44,4%) пациентов функциональный выброс ЛЖ (ФВ ЛЖ) был в диапазоне нормальных значений; умеренное снижение ФВ ЛЖ до 40–49% отмечено у 110 (55,6%) пациентов. Критерии диастолической дисфункции ЛЖ верифицированы у 146 (73,7%) пациентов. Средний уровень NT-proBNP составил 588,5 [220,5; 1210,0] пг/мл.
Пациентов распределили в группы. В 1-ю группу вошли 100 (50,5%) пациентов с КРС в сочетании с постоянной формой ФП, во 2-ю — 98 (49,5%) пациентов с КРС на фоне синусового ритма.
Полученные данные демонстрируют признаки более выраженного фиброза, оцененного как по уровню TIMP-1, который был выше у пациентов 1-й группы (107,5 [102,0; 111,0] нг/мл против 102,8 [98,0; 104,0] нг/мл, р=0,003), так и по уровню sST2, который также оказался выше в группе пациентов с постоянной формой ФП (78,0 [54,0; 135,0] нг/мл против 44,0 [36,0; 61,0] нг/мл, p=0,001). Установлено, что доли пациентов с повышенным уровнем sST2 (>34,3 нг/мл) статистически значимо не различались в группах с различным основным сердечным ритмом.
Оценка отношения шансов развития постоянной формы ФП для маркеров фиброза представлена в таблице.

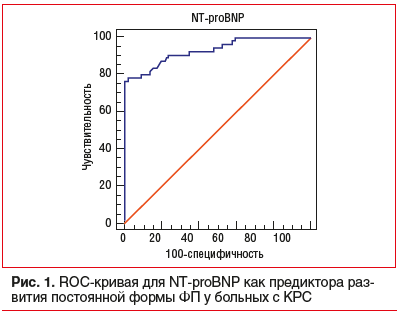
Концентрацию NT-proBNP исследовали рутинно у пациентов с ХСН. При построении ROC-кривой для всех значений NT-proBNP (рис. 1) была получена точка отсечения на уровне 581 нг/дл, при превышении которого можно прогнозировать развитие постоянной формы ФП с чувствительностью 76,4% и специфичностью 100%.
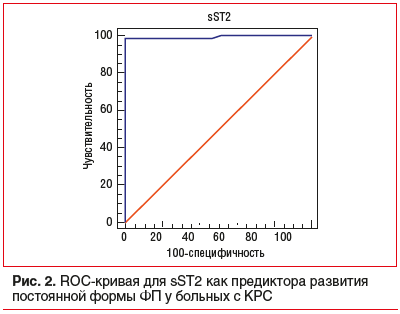
При построении ROC-кривой для всех значений sST2 (рис. 2) была получена точка отсечения 56 нг/мл (AUC=0,991, p<0,001). Таким образом, уровень sST2 >56 нг/мл может служить предиктором развития постоянной формы ФП у больных с КРС с чувствительностью 98,2% и специфичностью 100,0% (p<0,05).
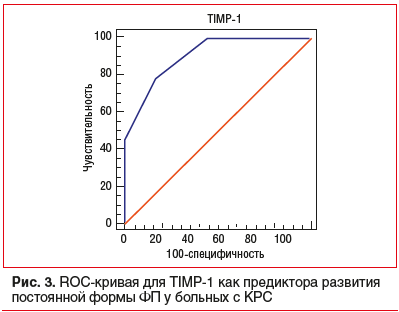
На рисунке 3 представлена ROC-кривая для всех значений TIMP-1 с точкой отсечения 105 нг/мл (AUC=0,907, p<0,001), позволяющей прогнозировать развитие у больных с КРС постоянной формы ФП с чувствительностью 78,2% и специфичностью 83,5% (p<0,05).
Таким образом, маркеры фиброза sST2 и TIMP-1 продемонстрировали ценность в качестве предикторов развития постоянной формы ФП у больных с КРС.
Обсуждение
Роль фиброза как одного из ключевых компонентов ремоделирования миокарда, способствующего развитию ФП, определена, однако представления о конкретных механизмах развития фиброза, путях реализации нейрогуморальной дисрегуляции, приводящих к существенной структурно-функциональной перестройке миокарда, в том числе предсердий, остаются неполными, основанными на эксперименте, требующими дальнейшего анализа в отношении возможности дальнейшей клинической имплементации [18]. Помимо маркеров, представленных в настоящей работе, различные авторы предлагают также галектин 3, тканевый фактор роста β1, фибронектин и ряд других, однако большинство исследований, оценивающих эти маркеры, носит экспериментальный характер, их применение в реальной клинической практике дискутабельно [11, 19, 20]. TIMP-1 и sST2 внедрены в клиническую практику и рекомендованы к использованию в определенных клинических ситуациях [14]. По данным W. Sun et al. [21], пароксизмальная форма ФП ассоциируется с повышением уровней sST2 и TIMP-1, но их прогностическая ценность в отношении ФП не так велика, как, например, размеры левого предсердия, возраст или концентрация NT-proBNP. G. Vergaro et al. [22] анализировали предикторную ценность sST2 в сравнении с NT-proBNP в отношении развития сердечно-сосудистых событий у больных с ХСН и продемонстрировали значительное увеличение частоты неблагоприятных исходов у пациентов с высокой концентрацией sST2 в сыворотке крови при нормальном содержании NT-proBNP. В нашем исследовании sST2 представлен как более сбалансированный и чувствительный предиктор постоянной формы ФП, чем NT-proBNP. В условиях КРС, когда нарушенная функция почек способствует нарушению метаболизма NT-proBNP, рассматриваемый маркер sST2 закономерно демонстрирует большую ценность в качестве предиктора ФП. Большая часть представленных данных о роли sST2 в развитии и течении ФП касается непостоянных форм. Показано, что повышенная концентрация sST2 является предвестником впервые развившейся ФП у больных ишемической болезнью сердца [23]. Также есть данные о роли sST2 в оценке риска рецидива ФП после электрической кардиоверсии [24]. Данных о клинической ценности sST2 в прогнозировании развития и течения постоянной формы ФП недостаточно, но результаты нашего исследования свидетельствуют о перспективности применения этого маркера. В настоящей работе ценность TIMP-1 как предиктора ФП оказалась ниже, чем у sST2. Однако убедительные данные о том, что TIMP-1 служит надежным маркером рецидива ФП после кардиоверсии, делает его применение более обоснованным у пациентов с пароксизмальной или персистирующей формой ФП [25]. В условиях КРС увеличение концентрации TIMP-1 ассоциировано в большей степени с явлениями застоя и снижением ренального клиренса, чем с частотно-зависимой перестройкой сердца и сосудов [26]. С учетом этих данных TIMP-1 представляется маркером фиброза, в большей степени ассоциированного с КРС, чем с ФП.
Ограничения проведенного исследования: в настоящей работе не были изучены особенности развития фиброза у пациентов с КРС в условиях персистирующей или пароксизмальной ФП; для оценки активности процессов фиброзирования миокарда у больных с КРС не были использованы такие маркеры, как галектин 3, тканевый фактор роста β1, матриксные металлопротеиназы 1-го и 9-го типа и т. д. Перечисленные исследования могут составить предмет дальнейшего изучения и обсуждения.
Заключение
Исследование маркеров фиброза у больных с КРС в сочетании с ФП имеет большое клиническое и прогностическое значение. Фиброз — важная часть патогенеза ФП, а полиморбидный фон в виде КРС создает дополнительные предпосылки для аритмогенного фиброзирования и ремоделирования миокарда. В качестве маркеров фиброза, обладающих предикторной ценностью в отношении постоянной формы ФП на фоне КРС, можно рекомендовать sST2, который при уровне >56 нг/мл позволяет прогнозировать развитие постоянной формы ФП с чувствительностью 98,2% и специфичностью 100,0% (p<0,05), являясь более надежным предиктором, чем NT-proBNP. TIMP-1 не может служить маркером выбора для определения риска постоянной ФП у больных с КРС, поскольку больше ассоциирован с развитием фиброза, обусловленного застойными явлениями, чем спровоцированного нарушением ритма. Результаты, полученные в настоящей работе, могут быть применены в клинической практике, обосновывая исследование уровня sST2 в обследовании пациентов с КРС для определения риска развития постоянной формы ФП.
Информация с rmj.ru






