Введение
Фибрилляция предсердий (ФП) является клинически значимой аритмией. В ближайшем десятилетии прогнозируется значительный рост (более чем в 2 раза) распространенности ФП во всем мире [1]. Несмотря на некоторый прогресс в лечении ФП, этот вид аритмии остается одной из ведущих причин развития мозгового инсульта, хронической сердечной недостаточности (ХСН) и внезапной сердечной смерти.
Наличие ФП ассоциировано с двукратным увеличением рисков смерти от всех причин и высокими медицинскими затратами [2, 3].
Широкий спектр сопутствующих заболеваний может способствовать ремоделированию предсердий, развитию интерстициального фиброза, вследствие которого развивается ФП. Так, артериальная гипертензия (АГ), пожилой возраст, сердечная недостаточность (СН) и пороки клапанов сердца (в особенности митрального клапана) являются установленными факторами риска, способствующими развитию ФП [4]. Исходя из данных последних исследований, у пациентов с ФП необходима более структурированная и непрерывная оценка всех возможных факторов риска развития и поддержания ФП [1].
Цель исследования: дать характеристику пациентам с впервые выявленной ФП с наличием и отсутствием хронических неинфекционных заболеваний (ХНИЗ) и оценить уровни маркеров фиброза миокарда и значимые клинические исходы.
Содержание статьи
Материал и методы
В исследование включено 128 пациентов: 78 пациентов с впервые выявленной ФП в возрасте от 18 лет и старше, с наличием в анамнезе ХНИЗ, госпитализированных в ГБУ РО РОККД в 2019–2020 гг. (экспериментальная группа), и 50 больных с впервые выявленной ФП и без тяжелых ХНИЗ, госпитализированных в ГБУ РО РОККД в 2020–2021 гг. (контрольная группа). Диагноз ФП установлен в соответствии с клиническими рекомендациями от 2020 г.[1] — при регистрации ФП на стандартной 12-канальной электрокардиограмме (ЭКГ) или наличии на протяжении всей записи одного отведения при длительном мониторировании ЭКГ. Характеристика пациентов без ХНИЗ: отсутствие заболеваний, предположительно сопровождающихся фиброзом (цирроз печени, инфаркт миокарда, хроническая болезнь почек), отсутствие ХСН, тяжелых негемодинамически значимых пороков сердца, тяжелых системных заболеваний с ожидаемой продолжительностью жизни менее 1 года.
Протокол исследования был рассмотрен и одобрен локальным этическим комитетом ФГБОУ РО РязГМУ Минздрава России.
Все пациенты прошли обследование, включавшее сбор жалоб, изучение анамнеза, физикальное обследование, антропометрические измерения, ЭКГ в 12 отведениях, эхокардиографию (ЭхоКГ), а также оценку назначенной терапии.
У пациентов определяли уровни галектина-3, трансформирующего фактора роста β (ТФР-β). У всех пациентов в течение 1 года после включения в исследование оценивались исходы, которыми считались следующие конечные точки: смерть, госпитализации в течение 1 года после первого эпизода нарушения ритма, сердечно-сосудистые события (инфаркт, ишемический инсульт), радиочастотная аблация (РЧА), коронарография (КАГ). Оценка клинических исходов осуществлялась методом системного ежемесячного обзвона пациентов. Дизайн исследования представлен на рисунке.
Статистическую обработку данных осуществляли при помощи программ Jamovi 2.3. Проверка закона нормальности распределения признаков в группах сравнения проводилась с использованием критерия Шапиро — Уилка. В случае если переменные соответствовали нормальному распределению, их представляли в формате среднего значения и стандартного отклонения (M±SD), если не соответствовали — использовали медиану, 1-й и 3-й квартили — Ме [Q1; Q3]. Для качественных номинальных признаков были рассчитаны абсолютная частота проявления признака (количество обследованных), частота проявления признака в процентах (%). Различия между группами для количественных признаков оценивались с помощью критерия Манна — Уитни, для качественных показателей — точного критерия Фишера. Различия считались статистически значимыми при значении р<0,05.
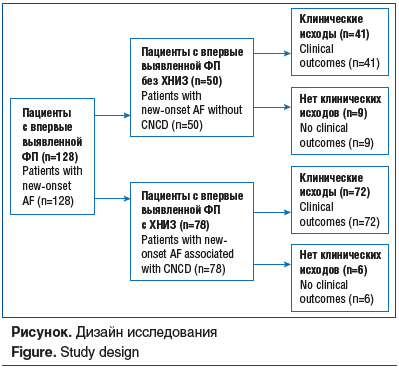
Результаты исследования
В исследование включено 128 пациентов, среди них 78 пациентов экспериментальной группы (36 мужчин и 42 женщины) в возрасте 18 лет и старше — 63,0±1,1 года. Контрольную группу составили 50 пациентов без тяжелых ХНИЗ (30 мужчин, 20 женщин), средний возраст которых составил 64,2±10 лет. Средний срок наблюдения пациентов составил 12,8 [8; 13,2] мес.
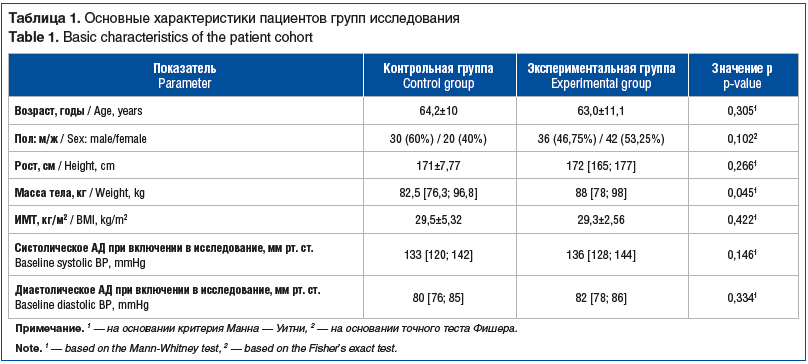
При включении в исследование у всех участников оценивали индекс массы тела (ИМТ), уровень артериального давления (АД) (табл. 1). При сравнении показателей ИМТ (рост и масса тела) и уровня АД у пациентов 2 групп были выявлены статистически значимо бльшая масса тела в экспериментальной группе: 88 [78; 98] кг в сравнении с контрольной группой, где данный показатель был 82,5 [76,3; 96,8] кг. При этом в обеих группах значения ИМТ статистически значимо не различались (р=0,422). Уровни систолического и диастолического АД также статистически значимо не различались (р=0,146).
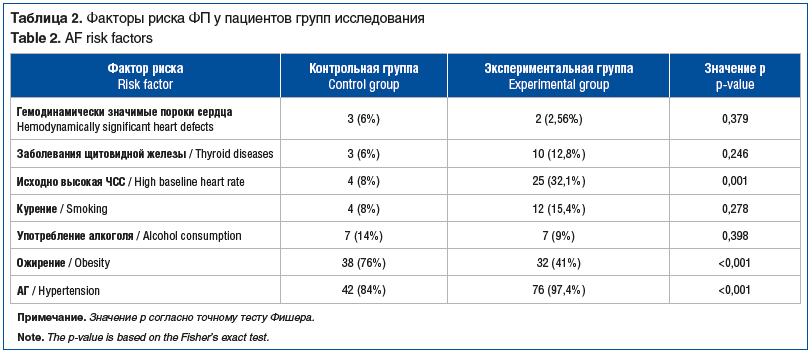
У пациентов экспериментальной группы достоверно чаще встречались факторы риска: высокая частота сердечных сокращений (ЧСС) (р=0,001), ожирение (р<0,001) и АГ (р<0,001) (табл. 2).
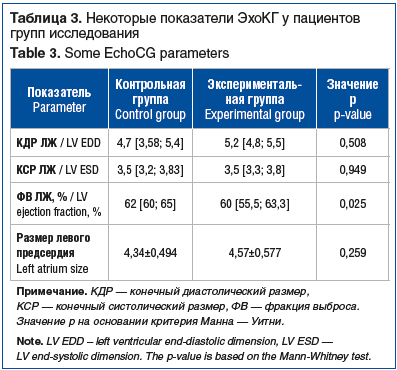
Характеристика систолической и диастолической функций левого желудочка (ЛЖ) по данным ЭхоКГ у пациентов контрольной и экспериментальной групп представлена в таблице 3. По результатам оценки данных, значения всех эхокардиографических показателей были сопоставимы у пациентов обеих групп. Исключение составил показатель ФВ ЛЖ, значение которого было сопоставимо выше у пациентов экспериментальной группы по сравнению с контрольной группой (р=0,025).
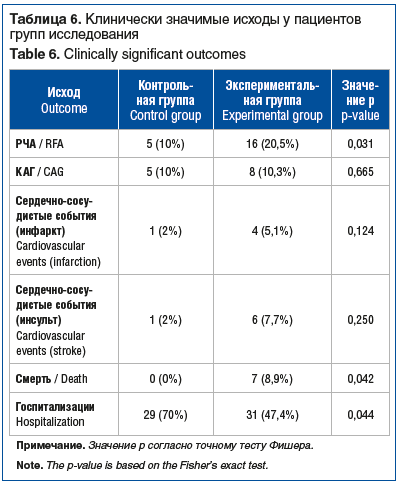
При оценке показателей биомаркеров фиброза миокарда выявлены значимые различия между уровнями ТФР-β и галектина-3 в контрольной и экспериментальной группах (р<0,001) (табл. 4).
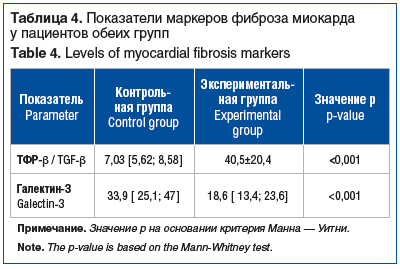
В экспериментальной группе пациенты наиболее часто принимали ингибиторы ангиотензинпревращающего фермента (иАПФ) — в 62 (82,7%) случаях, β-адреноблокаторы — в 54 (72%), антикоагулянты — в 43 (86%) (чаще всего ривароксабан — в 24 (46,2%)), за которыми следовали антиаритмические препараты — в 46 (61,3%) (чаще всего соталол — в 22 (47,8%)) (табл. 5). В контрольной группе большинство пациентов принимали иАПФ — в 42 (84%) случаях, в равной доле статины и антиаритмические препараты — в 31 (62%). Из антиаритмических препаратов чаще всего использовался соталол — в 17 (54,8%) случаях. Антикоагулянты использовались у 52 (69,3%) пациентов, чаще всего ривароксабан — в 24 (55,8%) случаях. В обеих группах большинство пациентов не принимали диуретики (см. табл. 5). Различия в принимаемой терапии между группами были статистически значимы для частоты приема β-адреноблокаторов (р=0,035), диуретиков (р=0,04) и антиагрегантов (р<0,001).
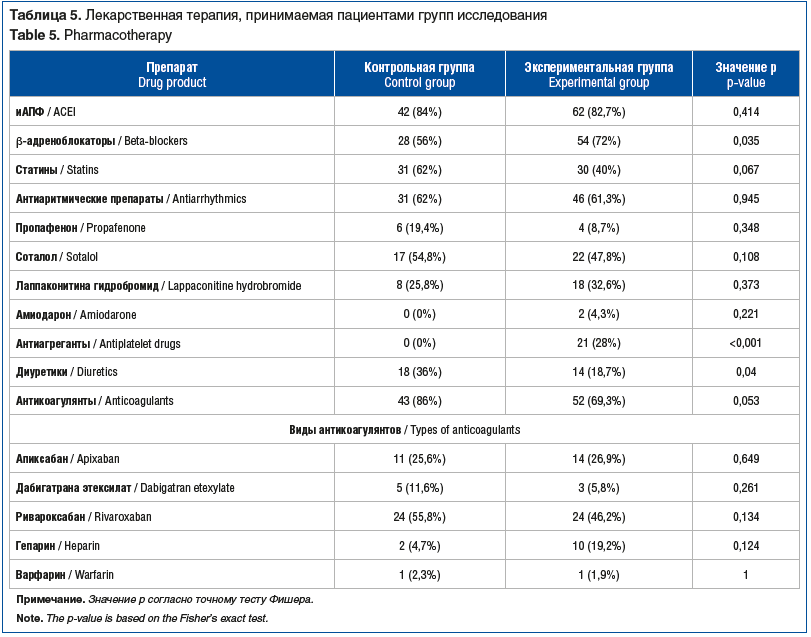
В исследовании оценивались неблагоприятные клинические исходы в виде конечных точек: сердечно-сосудистые события (инфаркт, инсульт), повторные госпитализации, смерть, процедуры РЧА, КАГ. Выявлены статистически значимые различия в группах. Так, количество повторных госпитализаций было выше в экспериментальной группе (р=0,044), так же как и количество смертельных исходов (р=0,042). Количество процедур РЧА было статистически значимо больше в экспериментальной группе (р=0,031) (табл. 6).
Обсуждение
По данным нашего исследования, пациенты с ХНИЗ достоверно чаще имели в качестве факторов риска исходно высокую ЧСС, АГ, а пациенты без ХНИЗ чаще страдали ожирением.
По данным литературы, ожирение может способствовать развитию ФП в результате воспалительных изменений, биологии эпикардиальной жировой ткани (ЭЖТ), структурного ремоделирования сердца и фиброза предсердий [5, 6].
Среди пациентов с ФП ожирение и более высокий ИМТ были связаны с более благоприятным прогнозом в реестре исследования событий ФП в странах Персидского залива (Gulf Survey of Atrial Fibrillation — SAFE) [7], однако в другом исследовании обнаружилось, что при увеличении объема перикардиального жира нарастает бремя аритмии. В исследовании M.O. Al Chekakie et al. [8] показано, что объем перикардиального жира у пациентов с персистирующей ФП больше, чем с пароксизмальной ФП, а у больных с пароксизмальной ФП — больше, чем у пациентов без нее.
Длительное течение АГ приводит к увеличению размеров предсердий и развитию фиброза [9], изменению электрофизиологических свойств миокарда, нарушению обмена ионов кальция [10]. Эти изменения приводят к нарушениям проводимости и связаны с более частыми и длительными эпизодами ФП [10]. В исследовании связи АГ с развитием ФП было показано, что АГ встречалась у 90% пациентов с увеличенным объемом левого предсердия, в результате чего было доказано, что АГ — сопутствующий фактор ухудшения течения ФП [11].
По данным нашего исследования, уровень ТФР-β был достоверно повышен у пациентов с ХНИЗ, что связано с наличием у этих пациентов заболеваний, сопровождающихся фиброзом миокарда. Жировая ткань является источником профибротических факторов. В работе Г. Чумаковой и соавт. [12] была продемонстрирована связь между толщиной ЭЖТ и уровнями маркеров фиброза миокарда: ТФР-β, матриксной металлопротеиназы 3 и коллагена.
Сопутствующая патология при ФП способствует развитию неблагоприятных клинических исходов [3]. По данным нашего исследования, в группе ХНИЗ чаще встречались повторные госпитализации, смерть и процедуры РЧА. По данным литературы, здоровый образ жизни и отсутствие факторов риска в целом были ассоциированы со значительно более низким риском сердечно-сосудистых осложнений, включая ишемический инсульт, инфаркт миокарда, госпитализацию из-за СН и смерть ото всех причин; наблюдалась обратная зависимость между количеством факторов здорового образа жизни и риском сердечно-сосудистых осложнений [13].
Заключение
У пациентов экспериментальной группы достоверно чаще встречались такие факторы риска, как высокая ЧСС, ожирение и АГ. По данным ЭхоЭКГ значение ФВ ЛЖ было выше у пациентов экспериментальной группы, чем у пациентов контрольной группы. Исследование биомаркеров фиброза миокарда показало значимые различия между уровнями ТФР-β и галектина-3 в обеих группах. Различия в принимаемой терапии между группами были статистически значимы для частоты приема β-адреноблокаторов, диуретиков и антиагрегантов. По данным исследования, количество повторных госпитализаций было выше в экспериментальной группе, так же как и количество смертельных исходов. Процедуры РЧА статистически значимо чаще проводились в экспериментальной группе.
Таким образом, пациенты с впервые выявленной ФП и ХНИЗ чаще имели более высокие показатели маркеров фиброза миокарда, бльшие размеры ЛЖ и у них чаще встречались неблагоприятные клинические исходы.
Сведения об авторах:
Никифоров Александр Алексеевич— к.м.н., доцент кафедры фармакологии ФГБОУ ВО РязГМУ Минздрава России; 390026, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0000-0002-7364-7687
Синяева Анна Сергеевна — ассистент кафедры поликлинической терапии, профилактической медицины и общей врачебной практики ФГБОУ ВО РязГМУ Минздрава России; 390026, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0000-0002-7205-5321
Тихонова Оксана Валентиновна — к.ф-м.н., доцент кафедры математики, физики и медицинской информатики ФГБОУ ВО РязГМУ Минздрава России; 390026, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORСID iD 0000-0002-9894-045Х
Филиппов Евгений Владимирович — д.м.н., профессор, заведующий кафедрой поликлинической терапии, профилактической медицины и общей врачебной практики ФГБОУ
[1] Клинические рекомендации «Фибрилляция и трепетание предсердий у взрослых» 2020 – 2021 – 2022 (10.06.2021). Утверждены Минздравом России. (Электронный ресурс.) URL: https://disuria.ru/_ld/11/1114_kr20I48MZ.pdf (дата обращения: 04.03.2025).
Информация с rmj.ru



