Введение
Инфекции у больных ревматоидным артритом (РА) развиваются в 1,5–2 раза чаще, чем в общей популяции, и занимают 2–3-е место в структуре причин смерти таких пациентов [1, 2]. Риск инфекционных событий еще выше у пациентов, получающих генно-инженерные биологические препараты (ГИБП) или таргетные синтетические базисные противовоспалительные препараты (тсБПВП). В исследованиях, проведенных в условиях реальной клинической практики, риск серьезных инфекций при применении ГИБП возрастал в 1,5–3 раза [3, 4]. Пневмонии — наиболее частые серьезные инфекционные проявления у пациентов с РА. По результатам исследования, проведенного с использованием баз данных Администрации здравоохранения ветеранов США, пневмонии обусловливали 37% всех госпитализаций из-за инфекционных событий [5].
С учетом высоких рисков развития инфекции, в том числе пневмоний, Европейская противоревматическая лига (EULAR) настоятельно рекомендует пневмококковую вакцинацию большинства пациентов с аутоиммунными воспалительными ревматическими заболеваниями, включая лиц с РА. Для этой цели предлагается использовать 23-валентные пневмококковые полисахаридные вакцины (ППВ23) и 13-валентную пневмококковую конъюгированную вакцину (ПКВ13) [6]. Однако, несмотря на уверенность экспертов о необходимости пневмококковой вакцинации, для подтверждения ее эффективности у пациентов с ревматическими заболеваниями в настоящее время имеющихся данных недостаточно.
Цель исследования: оценить влияние вакцинации пневмококковыми вакцинами (ППВ23 и ПКВ13) пациентов с РА, получающих ГИБП и тсБПВП, на риск развития инфекционных нежелательных явлений различных категорий в условиях реальной клинической практики.
Материал и методы
Проанализированы данные Московского Единого Регистра Артритов за 2018–2020 гг. В регистр включаются пациенты старше 18 лет, получающие таргетные противовоспалительные препараты. В настоящий анализ включались пациенты с РА, соответствующие критериям ACR/EULAR (2010) и получающие ГИБП или синтетический таргетный иммуносупрессор тофацитиниб. Обязательным условием включения в регистр являлось подписание информированного согласия на участие.. Все пациенты наблюдаются в регистре амбулаторно.
Сбор информации о нежелательных явлениях осуществляли методом открытых вопросов. Регистрировали информацию обо всех принимаемых препаратах в любой момент времени в период наблюдения. Анализировали риски следующих событий: любая инфекция, респираторная инфекция, в том числе пневмония, серьезная инфекция. К серьезным относили события, имеющие хотя бы один из следующих признаков: повлекшие смерть или представлявшие угрозу жизни, вызвавшие уродства плода, потребовавшие госпитализации или продления госпитализации, приведшие к стойким функциональным нарушениям [7]. В анализ включали эпизоды наблюдения с момента вакцинации пневмококковой вакциной до момента развития анализируемого события (любая инфекция, респираторная инфекция или серьезная инфекция) или до окончания наблюдения. Для невакцинированных пациентов эпизоды наблюдения начинались со средней даты вакцинации пациентов групп сравнения (20 октября 2018 г.). Сравнивали группы пациентов, получивших ППВ23, ПКВ13, и невакцинированных.
Сравнение рисков развития инфекционных событий осуществлялось с помощью метода Каплана — Майера (log-rank test) и регрессии пропорционального риска по Коксу. При сравнении пропорционального риска вносили поправки на конфаундеры риска инфекционных событий, выявленные в ранее проведенном исследовании: возраст и курение [8].
Результаты исследования
В анализ включено 832 пациента, из которых 40 было вакцинировано ПКВ13, 35 — двумя видами ППВ23. Лица, получившие ППВ23, при анализе были объединены в одну группу. Мужчин было 144 (17,3%). Средний возраст — 55,4±12,1 года. Длительность наблюдения составила 319±198 дней. Подробная характеристика пациентов приведена в таблице 1.
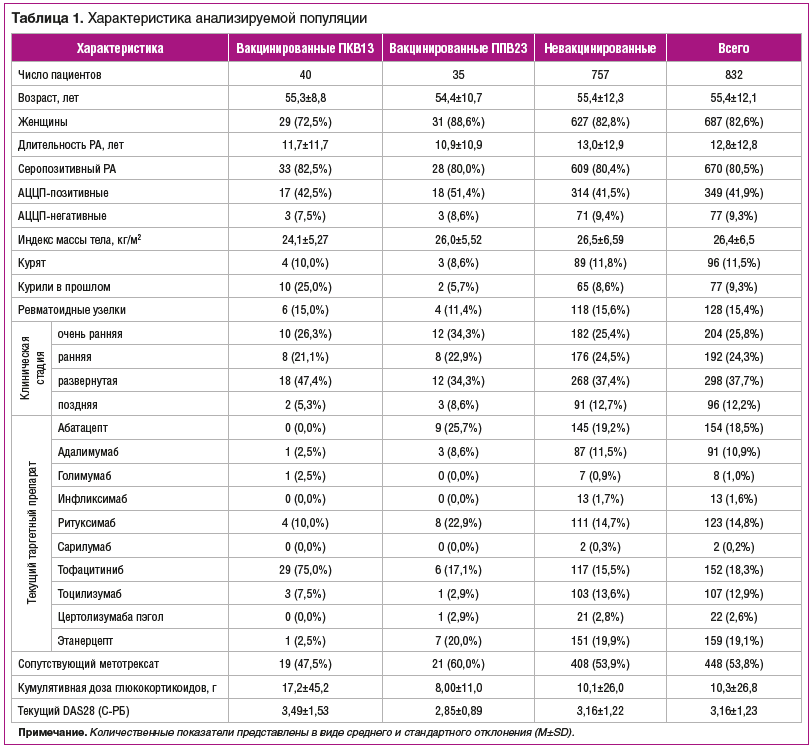
Всего было зарегистрировано 237 инфекционных событий, из которых 201 было респираторным и 21 — серьезным (табл.. 2).
Сравнение срока, прошедшего от вакцинации до возникновения первого инфекционного события, продемонстрировало, что как инфекции в целом, так и респираторные инфекции достоверно позже возникали в группе пациентов, вакцинированных ПКВ13, в сравнении с невакцинированными (p=0,012 и p=0,009 соответственно, log-rank test). Отличие между группами пациентов, вакцинированных ППВ23, и невакцинированных было статистически незначимым. При сравнении сроков наступления первого серьезного события значимых различий между группами выявлено не было.
При сравнении рисков развития инфекционных событий методом Кокса также отмечен достоверно меньший риск развития любой инфекции (относительный риск (ОР) 0,39, 95% доверительный интервал (95% ДИ) 0,18–0,84, p=0,015) и риск респираторной инфекции (ОР 0,32, 95% ДИ от 0,13 до -0,79, p=0,014) в группе пациентов, вакцинированных ПКВ13, в сравнении с невакцинированными.. Различия оставались статистически значимыми и после внесения поправок на наиболее значимые конфаундеры, выявленные в данной популяции в ходе предыдущих исследований (возраст и курение). Кривые выживания, рассчитанные с поправкой на указанные факторы в рамках множественной линейной регрессии пропорционального риска по Коксу, приведены на рисунке 1.
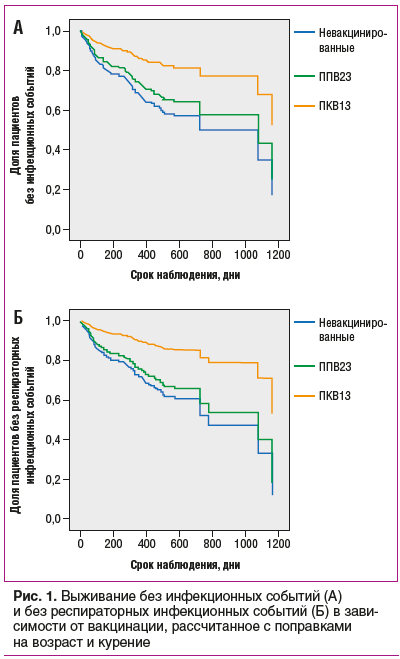
Значимых различий в риске развития серьезных инфекций между тремя группами выявлено не было ввиду небольшого числа событий такого рода. Однако следует отметить, что среди пациентов, вакцинированных ПКВ13, серьезных инфекций зарегистрировано не было.
Обсуждение
Целесообразность вакцинации пациентов с иммуновоспалительными заболеваниями в целом и с РА в частности пневмококковыми вакцинами в настоящее время обусловлена высокой частотой и клинической значимостью пневмоний у таких пациентов, особенно в условиях иммуносупрессивной терапии и с учетом данных об эффективности вакцинации различных контингентов условно здоровых лиц.. Так, клиническая эффективность ПКВ13 в отношении предупреждения пневмококковой пневмонии у лиц в возрасте 65 лет и старше была продемонстрирована в обширном рандомизированном клиническом исследовании CAPITA [9]. Наиболее крупные исследования, проведенные в условиях реальной клинической практики, также продемонстрировали эффективность ПКВ13 в предупреждении как всех пневмоний, так и пневмоний, вызываемых представленными в вакцине серотипами пневмококка [10].
Несомненно, пациенты с РА могут существенно отличаться от общей популяции как по риску развития респираторных инфекций, так и по эффективности вакцинации. Было показано, что иммунизация против пневмококковой инфекции у пациентов как с ревматоидным артритом, так и с ювенильным идиопатическим артритом высокоэффективна, хорошо переносится и не отражается негативно на течении ревматического заболевания [11, 12]. Единственное рандомизированное исследование [13] не смогло подтвердить способность ППВ23 снижать риск развития пневмонии у пациентов с РА. В одном ретроспективном исследовании отмечено достоверное повышение риска развития пневмонии у невакцинированных пациентов с РА, находящихся на лечении метотрексатом, по сравнению с иммунизированными ППВ23 (ОР 9,7, 95% ДИ 3,1–38,7) [14].
Таким образом, настоящее исследование является первым подтверждением клинической эффективности ПКВ13 у пациентов с РА, получающих таргетные противовоспалительные препараты. Исследование проведено в условиях реальной клинической практики на репрезентативной выборке в одно время.. Анализ выполнен с поправками на наиболее значимые конфаундеры, актуальные именно для данной популяции больных. Эти особенности исследования дают основание считать полученные данные вполне достоверными..
Вместе с тем настоящее исследование имеет и ряд существенных ограничений. Проведенный анализ продемонстрировал значительное снижение риска всех инфекционных событий и респираторных инфекционных событий.. С учетом структуры наблюдавшихся инфекций можно утверждать, что снижение их риска происходило преимущественно за счет снижения риска острых инфекций верхних дыхательных путей.. Оценить влияние вакцинации на риск пневмоний и серьезных инфекций не представляется возможным ввиду их небольшого числа.
Тем не менее и снижение риска острых респираторных инфекций ввиду их существенной экономической значимости представляется важным клиническим результатом вакцинации. Кроме того, частые респираторные инфекции нередко становятся поводом к отмене как обычных синтетических, так и таргетных базисных противовоспалительных препаратов.
Заключение
Применение ПКВ13 у пациентов с РА, получающих таргетную противовоспалительную терапию, способно существенно снизить риск инфекционных осложнений, преимущественно за счет острых респираторных инфекций. Полученные данные обосновывают широкое применение указанной вакцины у пациентов с РА. Значимого влияния ППВ23 на риск инфекционных и респираторных событий выявить не удалось. Требуются более масштабные исследования для оценки влияния пневмококковых вакцин на риск серьезных инфекций, включая пневмонии.
.
Информация с rmj.ru





