Содержание статьи
- 1 Введение
- 2 Патогенетические аспекты ОА
- 3 Современные подходы к лечению ОА
- 4 Место внутрисуставных инъекций протезов синовиальной жидкости в терапии ОА
- 5 Полинуклеотидные препараты как средство, влияющее на несколько звеньев патогенеза ОА
- 6 Эффективность комбинации ГК с полинуклеотидами в лечении ОА коленных суставов
- 7 Заключение
Введение
Остеоартрит (ОА) — самое распространенное заболевание суставов, на долю которого приходится до 60–70% всех ревматических болезней. Эпидемиологические исследования показывают, что OA страдает около 10–14% обследованного населения всех возрастов [1–3]. Около 10% пациентов старше 55 лет имеют признаки ОА на рентгенограммах коленного сустава. С возрастом распространенность ОА увеличивается [4], достигая среди лиц старше 60 лет 27%, а старше 70 лет — 97%.
Остеоартрит характеризуется дегенерацией всех тканей сустава и локальным воспалительным процессом, затрагивающим в том числе и околосуставные мягкие ткани. Клинически это проявляется болью в суставах, скованностью и снижением объема движений. ОА остается одной из основных причин снижения качества жизни и инвалидизации у пожилых людей [5, 6].
Патогенетические аспекты ОА
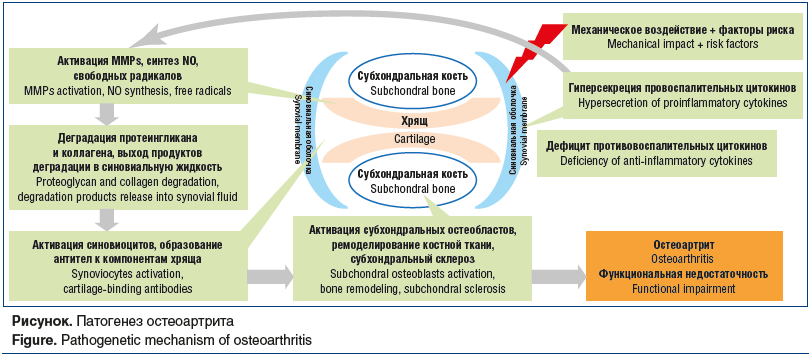
В патогенезе OA ведущее место занимают нарушения нормальных процессов деградации и синтеза в хондроцитах, внеклеточном матриксе и субхондральной кости. На рисунке схематически представлен патогенез ОА. Ключевую роль в развитии ОА играют провоспалительные цитокины, определяющее значение среди которых имеют интерлейкин (ИЛ) 1, и фактор некроза опухолей α, которые активируют матриксные металлопротеиназы (matrix metalloproteinases, MMPs) и снижают продукцию протео-гликанов, тканевого ингибитора металлопротеиназ, а также стимулируют выработку кислородных радикалов, оксида азота, что способствует прогрессированию катаболических процессов в хряще [7, 8].
Одним из ведущих звеньев в этом процессе является активация синовиальных клеток, остеокластов и хондроцитов, что в конечном счете приводит к воспалению, деградации субхондральной кости и ее репаративным изменениям. Определенную роль в патогенетическом каскаде ОА играют также уменьшение синтеза синовио-цитами гиалуроновой кислоты (ГК) и гиперпродукция простагландина Е2, что способствует воспалению в тканях сустава и индуцированию фибропластической дегенерации хряща.
Также показано, что в патофизиологии ОА участвуют и другие регуляторные (ИЛ-6, ИЛ-8) и ингибирующие (ИЛ-4, ИЛ-10, интерферон-γ) цитокины, в том числе и адипокины (лептин, адипонектин, резистин).
С другой стороны, при ОА имеет место дефицит противовоспалительных цитокинов, например трансформирующего фактора роста β и ингибитора плазминогена 1, которые ингибируют анаболические процессы в пораженном хряще.
Современные подходы к лечению ОА
В клинической практике врачи в настоящее время руководствуются различными рекомендациями, разработанными профессиональными организациями, включая рекомендации Ассоциации ревматологов России (АРР, 2017), Российского научного медицинского общества терапевтов (РНМОТ, 2016), Европейской антиревматической лиги (EULAR, 2018), Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO, 2019), Международного общества по изучению остеоартрита (OARSI) [9], Американского колледжа ревматологии (ACR) [10]. Все они подчеркивают, что современные терапевтические стратегии направлены на изменение образа жизни, немедикаментозное воздействие, прием длительно действующих болезньмодифицирующих препаратов, анальгетиков, НПВП, опиоидов, а также применение интраартикулярных введений глюкокортикоидов и протезов синовиальной жидкости [11].
Цели лечения ОА заключаются в минимизации боли, оптимизации функции и замедлении процесса структурного повреждения суставов. Из-за недостаточного эффекта отдельных вариантов лечения на практике обычно используется комбинация различных терапевтических подходов. Тем не менее важно отметить, что во многих странах общее качество лечения ОА было признано неоптимальным, с менее чем 50% соответствием показателям надлежащего лечения, что уступает другим хроническим заболеваниям, таким как сахарный диабет и остеопороз.
Пациентам с тяжелыми проявлениями ОА на поздних рентгенологических стадиях при отсутствии эффекта от вышеупомянутых методов лечения обычно проводится тотальное эндопротезирование суставов [12].
Поскольку хирургическое вмешательство имеет ряд ограничений, особенно у пожилых пациентов из-за наличия сопутствующих заболеваний и ряда других причин, целью современных фармакологических методов лечения ОА является не только уменьшение боли и улучшение функции суставов, но и возможность проведения оперативного вмешательства на более поздних сроках [13].
Несмотря на успехи современной медицинской науки, поиск терапевтических средств, воздействующих на все звенья патогенеза ОА, продолжается.
Место внутрисуставных инъекций протезов синовиальной жидкости в терапии ОА
Одним из способов повышения эффективности терапии и отсрочки оперативного вмешательства видятся внутрисуставные введения протезов синовиальной жидкости. Из них инъекции ГК используются наиболее часто. ГК является естественным компонентом соединительной ткани, обладает способностью восстанавливать вязкоупругие свойства синовиальной жидкости. Кроме того, она также обладает антиапоптотическими, противовоспалительными, антиангиогенными и антифибротическими свойствами [14]. Хотя доклинические и клинические исследования продемонстрировали положительные результаты введения ГК при лечении ОА [15], ее эффективность все еще остается предметом постоянных дискуссий в клинической практике [16].
В ряде исследований было показано, что введение аутоплазмы, обогащенной тромбоцитами (platelet rich plasma, PRP), в полость коленного сустава является достаточно эффективным способом уменьшения боли и улучшения функции сустава [17]. Превосходство PRP по сравнению с физиологическим раствором, ГК или кортикостероидами при ОА коленного сустава было продемонстрировано в некоторых рандомизированных клинических исследованиях [18].
Полинуклеотидные препараты как средство, влияющее на несколько звеньев патогенеза ОА
Полученные результаты в последнее время усилили интерес к разработке биоактивных веществ с регенеративной функцией, которые воздействовали бы на всю измененную внутрисуставную микросреду и могли бы восстановить физиологические свойства хряща. Таким веществом являются полинуклеотиды — макромолекулы, полученные из ДНК природного происхождения и обладающие трофической активностью, они способствовали росту клеток и выработке коллагена в доклинических и клинических исследованиях, касающихся регенерации хряща.
Полинуклеотиды представляют собой смесь пуринов, пиримидинов, дезоксирибонуклеотидов и дезоксирибонуклеозидов с трофической активностью. Они не производятся синтетическим путем и имеют естественное происхождение, будучи полученными чаще всего из гонад форели или человеческой плаценты. Высокоочищенные полинуклеотиды из гонад форели обеспечивают постоянную поддержку вязкости, а также обеспечивают азотистыми основаниями предшественников нуклеозидов и нуклеотидов хондроциты и мезенхимальные клетки, и уменьшают боль более эффективно, чем ГК [19–21].
Высокоочищенные полинуклеотиды природного происхождения при введении в полость сустава подвергаются ферментативному расщеплению с высвобождением нуклеозидов, нуклеотидов и азотистых оснований, обеспечивая тем самым долговременные увлажняющие и вязко-упругие свойства синовиальной жидкости [19–21].
Кроме того, полинуклеотиды могут индуцировать рост хондроцитов, выработку коллагена, миграцию некоторых типов клеток, в том числе мезенхимальных и стволовых, и тем самым способствуют уменьшению воспаления, что подтверждено исследованием уровня провоспалительных цитокинов в синовиальной жидкости на фоне лечения полинуклеотидными препаратами [22–24].
В доклинических и клинических исследованиях полинуклеотиды показали положительные результаты в регенерации костно-мышечной ткани [25], снижении деградации протеогликанов и активности MMPs в хрящевой ткани. На модели артрита отмечено уменьшение признаков воспаления и продукции провоспалительных цитокинов [22, 26].
По данным ряда исследований, полинуклеотиды приводят к уменьшению симптомов ОА коленного сустава с эффектом, равным эффекту от ГК, однако с более ранним ответом [19–21]. В клинических исследованиях инъекции полинуклеотидов показали хорошую переносимость и эффективность в уменьшении боли в суставах при лечении ОА коленного сустава [27–29].
Два исследования с 3 или 5 инъекциями полинуклеотидов или ГК показали равное уменьшение боли и улучшение функции коленного сустава через 4 и 6 мес. [19–21] с более ранним влиянием на физические параметры при применении полинуклеотидов [20, 21]. В работе [20] наблюдалось улучшение функции и уменьшение боли у пациентов, страдающих ОА, сохраняющееся в течение 2 мес. после инъекции полинуклеотидов.
Эффективность комбинации ГК с полинуклеотидами в лечении ОА коленных суставов
Полученные результаты закономерно привели к идее комбинировать ГК с полинуклеотидами. Результаты рандомизированного контролируемого двойного слепого клинического исследования по изучению эффективности внутрисуставных инъекций полинуклеотидов в сочетании с ГК [30] продемонстрировали уменьшение интенсивности болевого синдрома у пациентов, страдающих ОА коленного сустава. Этот эффект достоверно сохранялся в течение 12 мес. после первой инъекции комбинированного препарата ГК с полинуклеотидами. Это исследование продемонстрировало превосходство комбинированного лечения полинуклеотидами и ГК по сравнению с применением только ГК, наиболее широко используемой в лечении ОА коленного сустава с целью уменьшения боли и улучшения общей функции сустава.
Результаты дальнейшего двухлетнего исследования [31] подтвердили, что короткий цикл внутрисуставного лечения (3 еженедельные инъекции) полинуклеотидами в комбинации со среднемолекулярной 1,0–1,6 мДа ГК наиболее эффективен в улучшении функции коленного сустава и уменьшении боли у пациентов с ОА коленного сустава. Также было доказано влияние полинуклеотидов и ГК на трофику хондроцитов и контроль боли [32]. Ни одно внутрисуставное введение не было связано с какими-либо клинически значимыми краткосрочными осложнениями или долгосрочными побочными эффектами.
В клинике факультетской терапии нами неоднократно проводилось внутрисуставное введение как ГК, так и ГК в сочетании с полинуклеотидами, в частности Ферматрона 1%, Флексотрона Смарт 1,6% с Хронотроном пациентам с ОА коленных суставов. Эти процедуры выполнялись одновременно с назначением препаратов SYSADOA. В результате лечения большинство пациентов, получавших комбинированную терапию, включающую внутрисуставное введение полинуклеотидов и ГК с хондропротекторами, отметили быстрое и стойкое купирование болевого синдрома, оцениваемого по визуальной аналоговой шкале, и улучшение функций сустава (увеличение объема движений).
Заключение
Таким образом, полинуклеотиды сочетают свои первичные вязкоупругие и механические свойства с некоторой защитной и, возможно, трофической активностью в отношении хондроцитов, фибробластов и хряща. Применение полинуклеотидов также, по-видимому, может ассоци-ироваться с более существенным влиянием на интенсивность болевого синдрома, чем ГК, у пациентов с ОА коленного сустава. Результаты двухлетнего двойного слепого исследования подтвердили, что высокоочищенные полинуклеотиды являются агентами с длительным действием и стойкой защитной активностью в отношении компонентов хряща. Собственный опыт применения препаратов ГК, таких как Ферматрон 1% либо Флексотрон Смарт 1,6%, в сочетании с полинуклеотидным препаратом Хронотрон показывает, что полинуклеотиды природного происхождения являются ценным дополнением к ГК для облегчения боли и купирования функциональных симптомов при ОА коленного сустава. Эффективность комбинированного применения препаратов ГК с полинуклеотидами выше, чем монотерапия препаратами ГК. Комбинированная терапия полинуклеотидами и ГК в сравнении с монотерапией ГК приводит к более стойкому лечебному эффекту, сохраняющемуся в течение 2 лет после проведенного курса лечения.
Сведения об авторах:
Свинцицкая Ирина Сергеевна — к.м.н., старший преподаватель кафедры факультетской терапии Военно-медицинской академии им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6Ж; ORCID iD 0000-0002-1317-8276.
Волков Константин Юрьевич — старший оридинатор отделения клиники кафедры факультетской терапии; Военно-медицинская академия им. С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6Ж; ORCID iD 0000-0001-8310-5323.
Контактная информация: Свинцицкая Ирина Сергеевна, e-mail: sonirinadoc@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 14.03.2022.
Поступила после рецензирования 06.04.2022.
Принята в печать 29.04.2022.
About the authors:
Irina S. Svintsitskaya — Cand. of Sci. (Med.), senior lecturer of the Department of Faculty Therapy, S.M. Kirov Military Medical Academy; 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-1317-8276.
Konstantin Yu. Volkov — Senior Resident of the Department of Faculty Therapy, S.M. Kirov Military Medical Academy; 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-8310-5323.
Contact information: Irina S. Svintsitskaya, e-mail: sonirinadoc@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 14.03.2022.
Revised 06.04.2022.
Accepted 29.04.2022.
.
Информация с rmj.ru






