Содержание статьи
Введение
Атопический дерматит, аллергический ринит, бронхиальная астма (БА), хроническая обструктивная болезнь легких, хронический риносинусит с синоназальным полипозом (CRSwNP) относят к гетерогенной группе заболеваний, объединенных общим патогенезом, в основе которого лежит воспаление 2-го типа (T2-воспаление). При развитии Т2-воспаления Т-хелперы (Th) высвобождают провоспалительные вещества — цитокины, в частности интерлейкины (IL): IL-4, IL-5, IL-9 и IL-13 [1]. Иммунный ответ второго типа также способствует выработке иммуноглобулина Е (IgE) и увеличению количества либо активации эозинофилов в крови [1]. У пациентов с перечисленными заболеваниями воздействие определенных аллергенов приводит к развитию Т2-воспаления и, как следствие, к избыточному слизеобразованию, воспалению дыхательных путей и другим атопическим реакциям [1]. Для подавления воспаления 2-го типа разработаны биологические препараты, а именно меполизумаб, реслизумаб, бенрализумаб, дупилумаб, омализумаб и тезепелумаб. В последнее время накапливаются данные о применении биологических препаратов моноклональных антител (МАТ), блокирующих ключевые цитокины: IL-4 и IL-13, IL-5, рецепторы IL-5 либо IgE.
Как известно, CRSwNP часто сопутствует БА. Так у 7–16% пациентов БА сопровождается CRSwNP [2, 3], а у 48–66% пациентов с CRSwNP диагностируют БА [4, 5]. Вследствие коморбидности у больных CRSwNP чаще отмечают тяжелое течение БА [6, 7], а у пациентов с БА чаще отмечают рецидив полипоза после хирургического лечения [8].
Ключевым цитокином для стимуляции, созревания и выживания эозинофилов является IL-5. У большинства пациентов с CRSwNP повышены тканевая эозинофилия и уровень IL-5, что делает анти-IL-5-терапию потенциально привлекательной для лечения [9]. Реслизумаб представляет собой гуманизированное МАТ к IL-5 [10].
Фармакокинетика МАТ вследствие большого размера молекулы характеризуется низким распределением во внесосудистом пространстве и длительным периодом полувыведения (Т1/2), который зависит от медленного внутриклеточного катаболизма без выделения с мочой [10, 11]. Наиболее часто MAТ вводят внутривенно с последующим подкожным (ПК) введением, хотя возможно внутримышечное введение [10]. Перорально МАТ не применяют из-за большого размера молекулы и ее деградации в желудочно-кишечном тракте [11]. Скорость и степень всасывания различны как у разных МАТ, так и у разных людей при применении одного и того же МАТ [10]. При ПК-введении всасыванию в системный кровоток предшествует конвективный транспорт МАТ через интерстициальное пространство в лимфатическую систему [10]. Поток лимфатической жидкости медленный по сравнению с кровотоком, поэтому всасывание MAТ после ПК-введения замедлено, а среднее время достижения максимальной концентрации (Тmax) — 6–8 сут [10]. На параметры фармакокинетики МАТ также могут влиять специфические для пациента факторы. Например, дозу большинства MAТ рассчитывают, исходя из массы тела, которая служит существенным фактором, влияющим на объем распределения (VD) и/или системный клиренс (CLs), хотя это верно не для каждого МАТ [11].
Способ введения МАТ влияет на их пиковую концентрацию в сыворотке (Cmax), что, в свою очередь, может влиять на время клинического ответа [12]. ПК-введение позволяет поддерживать более стабильный уровень МАТ в сыворотке, несмотря на то, что Тmax при ПК-введении больше, чем при внутривенном введении [13]. После внутривенного введения концентрация реслизумаба в сыворотке обычно демонстрирует двухфазное снижение после Тmax, а фармакокинетика пропорциональна дозе в диапазоне доз 0,3–3,0 мг/кг.
Чрезвычайно важны вопросы безопасности генно-инженерной биологической терапии (ГИБТ). Современные МАТ имеют разные способы и схемы введения. Выбор подходящего способа введения определяется эффективностью и безопасностью, а также экономической составляющей, доступностью и предпочтениями пациента, поскольку это обеспечивает оптимальную приверженность лечению.
Иммуногенность — важный компонент фармакологии МАТ и фактор, влияющий на безопасность ГИБТ. На развитие иммуногенности влияют многие факторы: доза, способ введения и структура препарата, а также сопутствующее применение других препаратов и основное заболевание [14]. В этом отношении внутривенный способ введения, по мнению ряда исследователей, возможно, более эффективен, поскольку он связан с более низкой иммуногенностью, а также меньшим количеством местных реакций гиперчувствительности [15]. Считают, что по сравнению с внутривенным введением ПК-введение крупных молекул, таких как МАТ, увеличивает риск иммуногенности за счет взаимодействия с дендритными клетками (ДК) [14]. ДК присутствуют в большем количестве в коже и подкожных слоях и, следовательно, расположены в идеальном положении для захвата лекарственного средства, его переработки и последующей миграции в лимфатические узлы. В лимфатических узлах ДК могут действовать как антигенпрезентирующие клетки для аутологичных Т-клеток, вызывая иммунный ответ [16]. В дополнение к мигрирующим ДК препараты, введенные подкожно, могут подвергаться второму этапу презентации антигена ДК, расположенными в лимфатических узлах [16], вызывая, таким образом, более сильный иммунный ответ, чем при внутривенном введении препарата.
Иммуногенный потенциал всех МАТ для лечения тяжелой БА относительно низок, поскольку эти препараты гуманизированы. Данные клинических исследований препаратов для подкожного введения (омализумаб, бенрализумаб, меполизумаб, дупилумаб) и для внутривенного введения (реслизумаб) указывают на незначительную выработку нейтрализующих антител или ее отсутствие [17].
Биологическая активность реслизумаба была описана в 2006 г. у пациентов с тяжелой персистирующей астмой, получавших высокие дозы ингаляционных или пероральных кортикостероидов. Пациентам вводили внутривенно однократно реслизумаб в дозе 0,3 мг/кг или 1 мг/кг, что приводило через 48 ч к снижению количества периферических эозинофилов по сравнению с исходным уровнем, и этот эффект оказался дозозависимым [18]. Снижение количества эозинофилов в крови при применении реслизумаба в дозе 1 мг/кг оставалось значительным до 30-го дня после введения препарата (р=0,05 при сравнении с плацебо) [18]. У пациентов с недостаточно контролируемой астмой и повышенным уровнем эозинофилов в крови (≥400 клеток в 1 мкл) внутривенное введение 3,0 мг/кг реслизумаба каждые 4 нед. способствовало значительному снижению частоты обострений астмы, а также значительному улучшению показателей объема форсированного выдоха за 1-ю секунду (ОФВ1) и, соответственно, повышению качества жизни при астме, оцененного на основе опросников AQLQ и ACQ, в двух идентично разработанных исследованиях III фазы [19]. В другом исследовании III фазы оценивали применение реслизумаба в дозах 0,3 мг/кг и 3 мг/кг каждые 4 нед. Применение препарата в обеих дозах привело к значительному улучшению показателей ОФВ1 и ACQ, а также сокращению использования β2-агонистов короткого действия [20]. На фоне применения реслизумаба концентрация эозинофилов в крови последовательно снижалась в III фазе исследования [19, 20]. Были проанализированы результаты исследований для выделения групп традиционно трудноизлечимых пациентов, которые могли ответить на лечение реслизумабом. В эти группы включили пациентов с CRSwNP, с тяжестью астмы, соответствующей ступеням 4 и 5 по классификации Global Initiative for Asthma (GINA), пациентов, зависимых от пероральных кортикостероидов, и лиц в возрасте ≥65 лет [19, 21]. Кроме того, последующий анализ клинических испытаний III фазы показал, что у тех пациентов, у которых наблюдается реакция ОФВ1 (≥100%) и/или улучшение оценки ACQ в первые 16 нед., частота обострений БА снижалась в большей степени [22]. Данные факты можно использовать для прогнозирования раннего ответа на лечение реслизумабом и принятия решения о его применении [23]. В целом основные результаты ключевых клинических исследований реслизумаба указывают на то, что данное MAТ эффективно для лечения тяжелой формы БА. Кроме того, появляются все более убедительные данные о том, что наличие полипов у больных с эозинофильной БА предполагает положительный клинический эффект при лечении МАТ, действие которых направлено на эозинофильное воспаление [9, 24–27].
Цель исследования: оценка эффективности реслизумаба в лечении CRSwNP у пациентов с тяжелой эозинофильной бронхиальной астмой (ТЭБА).
Материал и методы
Для решения поставленной задачи нами выполнено пилотное нерандомизированное обсервационное исследование. В работе учитывались требования Хельсинкской декларации (2013 г.). Исследование одобрено локальным этическим комитетом ФГБОУ ВО РостГМУ Минздрава России. Информированное согласие было получено от пациентов в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
Предварительные итоги исследования, включающие анализ результатов применения реслизумаба у 9 пациентов, подробно изложены в нашей статье, опубликованной в 2021 г. [9]. За прошедшее с момента публикации время в исследование было включено еще 12 пациентов. В связи с этим мы решили представить обобщенные данные, так как их результаты подтверждают наметившиеся ранее тенденции и дают возможность делать более уверенные выводы. Кроме того, данная проблема по-прежнему остается актуальной.
В исследование включен 21 пациент в возрасте от 29 до 59 лет (средний возраст 41,8±7,02 года). Исследование проведено на базе пульмонологических отделений многопрофильных лечебных учреждений: ГАУ РО «ОКДЦ» и ГБУ РО «ОКБ № 2» г. Ростова-на-Дону, а также ГБУЗ СК «СККБ» г. Ставрополя в период с января 2018 г. по ноябрь 2021 г.
Критерии включения, исключения и дизайн исследования подробно изложены в предыдущей статье [9]. У всех пациентов был верифицирован диагноз ТЭБА, определена эозинофилия крови и мокроты, диагностирована патология синоназальной области. Все больные ТЭБА получали стандартное лечение, соответствующее ступеням 4 и 5 согласно классификации GINA 2021 г.. Тем не менее контроль симптомов БА на фоне проводимого лечения отсутствовал, либо БА обострялась >1 раза в год. После одобрения экспертной комиссией всем пациентам, включенным в исследование, вводили реслизумаб внутривенно в дозе 3 мг/кг 1 раз в 4 нед. в качестве дополнения к получаемой ранее базисной терапии БА. Следует отметить, что доза реслизумаба зависит от массы тела пациента. Согласно данным литературы в популяционной фармакокинетической модели с реслизумабом более быстрый CLs и больший VD оказались связаны с большей массой тела. Этот факт подтверждает целесообразность подбора дозы препарата в зависимости от массы тела (3 мг/кг) и обеспечивает сопоставимое воздействие во всем диапазоне масс тела. Моделирование дозирования в зависимости от массы тела с использованием данных, собранных из восьми клинических исследований реслизумаба, показало, что стационарное воздействие реслизумаба после внутривенного введения, включая площадь под кривой зависимости концентрации препарата от времени (AUC), Cmax и среднюю концентрацию в сыворотке (Cavg), оставалось неизменным в широком диапазоне масс тела пациентов [13]. Таким образом, подбор дозы реслизумаба для внутривенного введения, в зависимости от массы тела, представляет собой подход, соответствующий индивидуальным требованиям пациента.
Мы проанализировали данные исследования пациентов до начала лечения и после пяти последовательных введений реслизумаба. Всем пациентам проводили эндоскопическое исследование полости носа с определением общего индекса полипов (TPS), спиральную компьютерную томографию (СКТ) околоносовых пазух, аллергологическое исследование с помощью метода ImmunoCAP, спирометрию, определяли риноцитограмму, содержание эозинофилов в крови и эозинофильного катионного протеина (ECP) в сыворотке крови. TPS оценивали в баллах по стандартной схеме [28]. Состояние околоносовых пазух и остиомеатального комплекса на СКТ оценивали по шкале Lund — Mackay. Помимо объективных показателей, для оценки динамики симптомов использовали опросник SNOT-22 (Sino-nasal Outcome Test-22), включающий оценку основных симптомов патологии носа и околоносовых пазух, психологических симптомов и качества сна, и опросник по контролю симптомов астмы АСТ (Asthma Control Test). Эффективность контроля симптомов астмы оценивали по снижению частоты обострений ТЭБА (в том числе обострений, требующих применения системных кортикостероидов), улучшению качества жизни, данным спирометрии и АСТ.
Результаты исследования
Как и в первоначальном исследовании, у всех пациентов (n=21) были симптомы патологии носа и околоносовых пазух: ринорея (n=21), постоянное (n=19) либо ситуационно инициируемое (n=3) затруднение назального дыхания, синдром постназального затека (drip-синдром) (n=17), снижение обоняния (n=19), извращение вкуса (n=19).
У всех пациентов отмечена поздняя диагностика ЛОР-патологии: продолжительность заболевания до установления диагноза составила от 2 до 19 лет. При этом у 18 пациентов заболевание дебютировало с появления симптомов ринита в виде обильных водянистых выделений из носа и приступов чихания, с последующим присоединением заложенности носа, позже — симптомов БА и полипозных разрастаний. У 19 пациентов во время эндоскопического исследования носа были обнаружены полипы с TPS от 2 до 5 (см. таблицу). На СКТ околоносовых пазух у этой группы пациентов обнаружены признаки воспалительных изменений всех пазух, оцененные по радиологической оценочной шкале воспалительных изменений околоносовых пазух и остиомеатального комплекса при хроническом риносинусите (шкала Lund — Mackay) от 11 до 20 баллов (см. таблицу). У двух пациентов назальные полипы обнаружены не были, но отмечен отек слизистой оболочки полости носа и утолщение слизистой оболочки околоносовых пазух по данным СКТ. Эти пациенты в течение длительного времени наблюдались в поликлинике с диагнозом: аллергический ринит. Однако эозинофилия в риноцитограмме (до 75%), значительное повышение содержания ECP в крови и двукратные отрицательные результаты аллергологического обследования позволили нам установить диагноз неаллергического эозинофильного респираторного синдрома (NARES). Следует отметить, что у этих пациентов при применении реслизумаба более выраженный эффект отмечен в регрессе назальных симптомов по данным опросника SNOT-22, тогда как показатели ACT и ОФВ1 улучшились в меньшей степени.
Количество эозинофилов в крови значительно уменьшилось у всех пациентов уже после первого введения препарата, и низкое содержание эозинофилов сохранялось на протяжении всего периода наблюдения, несмотря на некоторые колебания этого показателя (см. таблицу).
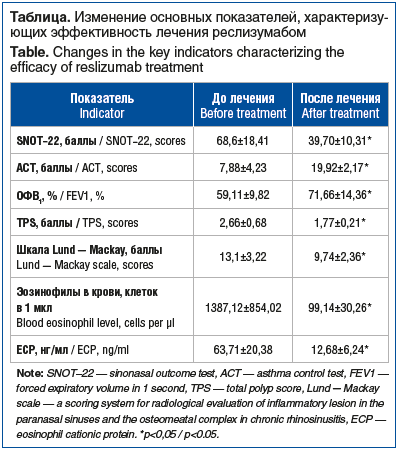
Большинство (n=20) пациентов отметили улучшение носового дыхания, что выразилось в динамике показателей опросника SNOT-22 (см. таблицу). Обоняние улучшилось уже после первого введения реслизумаба у 15 пациентов, а у 6 — в течение 2 мес. после начала лечения. Положительная клиническая динамика течения CRSwNP коррелировала с объективными данными эндоскопии (уменьшение TPS) и СКТ околоносовых пазух (см. таблицу).
Генно-инженерная биологическая терапия реслизумабом положительно отразилась на течении БА у 19 пациентов: увеличился ОФВ1, улучшилась переносимость физической нагрузки, снизилась потребность в β2-агонистах короткого действия. На фоне введения реслизумаба у пациентов отмечено улучшение качества сна, повышение работоспособности, улучшение эмоционального фона. В течение всего периода наблюдения обострений астмы не наблюдалось, достигнут контроль над заболеванием, что также отражали данные опросника АСТ (>20 баллов) (см. таблицу). Отсутствие субъективного и объективного улучшения отмечено у 1 пациентки с аспирин-индуцированной астмой, хотя она полностью соответствовала критериям включения в исследование.
В нашем исследовании особенностей и нежелательных явлений при ГИБТ, связанных с иммуногенностью МАТ, отмечено не было.
Обсуждение
Среди пациентов с ТЭБА, включенных в исследование, CRSwNP обнаружен у 19 пациентов, у двух отмечены симптомы NARES. Воспалительные изменения околоносовых пазух на СКТ отмечены у всех пациентов.
В нашей работе впервые в РФ динамику назальных симптомов при применении реслизумаба мы оценивали с помощью объективных методов диагностики (эндоскопия полости носа, СКТ околоносовых пазух, риноцитограмма). Это дало нам возможность документировать клинические, эндоскопические, радиологические признаки снижения интенсивности назальных симптомов на фоне заметного улучшения контроля БА, функции легких, качества жизни, что подтверждено результатами опросников SNOT-22 и АСТ.
Уменьшение назальных полипов и проявлений воспаления слизистой оболочки околоносовых пазух, оцениваемое по шкале Lund — Mackay, отмечено у 17 из 19 пациентов. Это подтверждает сведения рандомизированных клинических исследований (РКИ) о потенциале обратного развития ремоделирования мукозальной оболочки верхних дыхательных путей под влиянием ГИБТ [29]. Не было отмечено положительной динамики назальных симптомов и течения астмы у 1 пациентки с аспирин-индуцированной БА. Разнонаправленный эффект лечения был у 1 пациентки: достигнут контроль над астмой (положительная динамика АСТ с 8 до 22 баллов, ОФВ1 с 86 до 106%), но отсутствовало влияние на синоназальные симптомы (полипы увеличились, TPS увеличился с 2 до 4 баллов).
По данным литературы, наличие полипов у пациентов с ТЭБА дает возможность прогнозировать положительный результат лечения реслизумабом. В частности, S.F. Weinstein et al. [30] в ретроспективном исследовании проанализировали истории болезни 953 пациентов с неконтролируемой БА, которые получали ГИБТ реслизумабом в течение 52 нед. У 150 (16%) пациентов был CRSwNP, хотя эндоскопическое исследование полости носа и СКТ околоносовых пазух не проводилось. Невзирая на это, авторы сделали вывод, что у пациентов с CRSwNP достигнуто более значительное улучшение показателей легочной функции, нежели у пациентов без CRSwNP. Проведенное нами исследование подтверждает, что более выраженная позитивная динамика функции внешнего дыхания (ФВД) и данных АСТ наблюдается у пациентов с БА, сопровождающейся CRSwNP. При этом в РКИ показано, что положительная динамика ФВД (ОФВ1≥100%) и/или данных опросника контроля ACQ в течение первых 16 нед. ГИБТ реслизумабом ассоциируется со снижением числа обострений БА и может служить прогностическим маркером выбора данного МАТ для дальнейшей биологической терапии, что и было продемонстрировано у наших пациентов [22].
Следует отметить, что любопытные результаты в нашей группе отмечены у двух пациентов без полипов носа с периодическими симптомами ринита (ринорея, чихание, заложенность носа), которые длительно наблюдались с диагнозом: аллергический ринит. После тщательного обследования, которое выявило у них выраженную эозинофилию в риноцитограмме (до 75%), увеличение ECP в крови, двукратные отрицательные результаты аллергологического обследования дали возможность нам установить этим пациентам диагноз NARES. Пациенты с CRSwNP при тщательном сборе анамнеза отметили подобные симптомы в дебюте заболевания, что подтверждает ранее описанную гипотезу о том, что NARES может быть предвестником развития аспирин-индуцированной БА, не-IgE-обусловленной БА и CRSwNP [25].
Положительная динамика клинического течения как ТЭБА, так и сопутствующего CRSwNP свидетельствует о том, что реслизумаб воздействует на эозинофильное воспаление как нижних, так и верхних дыхательных путей. Результаты нашего клинического исследования совпадают с выводами других авторов [25, 26].
Безусловно, изучение цитокинового спектра воспаления дает возможность детализировать патогенетические особенности различных фенотипов заболевания, определяющих направление ГИБТ [31–33]. Однако определение содержания цитокинов в тканях полипов и слизистой оболочке полости носа в настоящее время выходит за рамки возможностей реальной клинической практики. Для включения пациентов в группу, подлежащую ГИБТ реслизумабом, были использованы стандартные критерии [34]. Разнородность обнаруженных нами данных направляет последующие исследования по пути изучения дополнительных маркеров прогнозирования успешности ГИБТ, одним из которых может быть сочетание ТЭБА и CRSwNP у пациента.
Заключение
Данное исследование показало, что у пациентов с ТЭБА и сопутствующими CRSwNP или NARES, получавших реслизумаб, не только улучшился контроль симптомов астмы, но и значительно регрессировали назальные симптомы. Эти результаты хорошо коррелируют с предыдущими проспективными исследованиями и метаанализами, представленными в литературе, показывающими сходные результаты со стороны легких и околоносовых пазух, а также улучшение функционального состояния у пациентов, получавших биопрепараты при воспалительных заболеваниях 2-го типа. Пациентам, которым показана биологическая терапия, эти препараты могут принести значительную пользу.
Сведения об авторах:
Бойко Наталья Владимировна — д.м.н., профессор кафедры болезней уха, горла, носа ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0002-1316-5061.
Чурюкина Элла Витальевна — к.м.н., доцент, начальник отдела аллергических и аутоиммунных заболеваний ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; доцент кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. имени Митрофана Седина, 4; ORCID iD 0000-0001-6407-6117.
Лодочкина Ольга Евгеньевна — врач-оториноларинголог оториноларингологического отделения ГАУ РО «ОКДЦ»; 344000, Россия, г. Ростов-на-Дону, ул. Пушкинская, д. 127; ORCID iD 0000-0001-7401-0680.
Уханова Ольга Петровна — д.м.н., профессор кафедры иммунологии с курсом ДПО ФГБОУ ВО СтГМУ Минздрава России; 355017, Россия, г. Ставрополь, ул. Мира, д. 310; врач аллерголог-иммунолог, главный внештатный специалист МЗ СК и СКФО, заведующая Северо-Кавказским центром аллергологии-иммунологии в КБ № 101 ФФГБУ СКФНКЦ ФМБА России в г. Лермонтове; 357341, Россия, г. Лермонтов, ул. Ленина, д. 26; ORCID iD 0000-0002-7247-0621.
Контактная информация: Чурюкина Элла Витальевна, e-mail: echuryukina@mail.ru.
Источник финансирования: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов: отсутствует.
Статья поступила 05.02.2023.
Поступила после рецензирования 02.03.2023.
Принята в печать 28.03.2023.
About the authors:
Natalia V. Boyko — Dr. Sc. (Med.), Professor of the Otorhinolaryngologic Department, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0002-1316-5061.
Ella V. Chyryukina — C. Sc. (Med.), associate professor, Head of the Department of Allergic and Autoimmune Diseases, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; associate professor of the Department of Clinical Immunology, Allergology and Laboratory Diagnostics, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0001-6407-6117.
Olga E. Lodochkina — otorhinolaryngologist of the Otorhinolaryngologic Department, Regional Consultation and Diagnostic Center, 127, Pushkinskaya str., Rostov-on-Don, 344000, Russian Federation; ORCID iD 0000-0001-7401-0680.
Olga P. Ukhanova — Dr. Sc. (Med.), Professor of the Immunology Department with the Course of Additional Professional Education, Stavropol State Medical University; 310, Mira str., Stavropol, 355017, Russian Federation; allergologist and immunologist, chief outsourcing expert of the Ministry of Health of Stavropol Krai and North Caucasian Federal County, Head of North Caucasian Center of Allergology and Immunology in Clinical Hospital No. 101 of the North Caucasian Federal Research and Clinical Center of FMBA of Russia in Lermontov; 26, Lenin str., Lermontov, 357341, Russian Federation; ORCID iD 0000-0002-7247-0621.
Contact information: Ella V. Chyryukina, e-mail: echuryukina@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received: 05.02.2023.
Revised: 02.03.2023.
Accepted: 28.03.2023.
Информация с rmj.ru





