Введение
Инфантильные гемангиомы (ИГ) являются наиболее распространенными опухолями младенческого возраста [1]. Чаще встречаются у недоношенных детей с массой тела менее 1800 г [2], у девочек европеоидной расы. Эти доброкачественные сосудистые опухоли проходят фазу быстрой пролиферации, которая может продолжаться до 8–12 мес., после чего может начаться медленная спонтанная инволюция, продолжающаяся до 4–7 лет, в связи с чем большинство пациентов не нуждаются в лечении [1, 3]. Однако при диффузном гемангиоматозе внутренних органов высока вероятность развития тяжелых жизнеугрожающих состояний (ЖУС).
При диффузном неонатальном гемангиоматозе множественные гемангиомы кожи могут сочетаться с поражением внутренних органов, в первую очередь печени [4]. Диффузное поражение гемангиомами может приводить к ЖУС — абдоминальному компартмент-синдрому (АКС), развивающемуся на фоне увеличения размеров печени; сердечной недостаточности вследствие нарастающего венозного возврата и увеличения преднагрузки на правые отделы сердца, дыхательной недостаточности [5]. При локализации ИГ в области верхних дыхательных путей вследствие сдавления органов может возникать тяжелая дыхательная недостаточность, респираторный дистресс-синдром [6, 7]. Не исключена и тяжелая приобретенная гипофункция щитовидной железы в результате гиперэкспрессии дейодиназы 3-го типа (фермента, разрушающего тироксин), что приводит к повышенному дейодированию тироксина и трийодтиронина до биологически неактивного Т3 и дийодтиронина Т2. Гипотиреоз всегда наблюдается при диффузных формах поражения, и редко — при мультифокальных вариантах заболевания [2, 8].
Своевременная диагностика ИГ и начало адекватной терапии являются залогом сохранения жизни ребенка. В качестве терапии первой линии при диффузном поражении применяется неселективныйβ-адреноблокатор пропранолол, показавший свою эффективность в лечении ИГ [7, 9].
Представляем клинические наблюдения пациентов с осложненным течением ИГ, потребовавших дифференциальной диагностики со злокачественными новообразованиями и немедленного начала лечения, назначения сопутствующей терапии с целью купирования ЖУС (согласие законных представителей на публикацию получено).
Содержание статьи
Клиническое наблюдение 1
Девочка М. в возрасте 1 мес. в июне 2024 г. поступила в НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (далее — НИИ ДОиГ) с объемным образованием в брюшной полости. Из анамнеза жизни известно, что ребенок от 1-й беременности, протекавшей без особенностей. Пренатально при УЗ-скрининге патологии выявлено не было. Роды самостоятельные при сроке гестации 38 нед. Масса тела при рождении 3150 г, длина тела 49 см. Оценка по шкале Апгар 8/9 баллов. Выписана из роддома на 3-и сутки в удовлетворительном состоянии. С 15-х суток жизни родители ребенка отметили увеличение размеров живота. По месту жительства проведено УЗИ органов брюшной полости (ОБП), по данным которого выявлено тотальное поражение печени множественными гиперэхогенными образованиями округлой формы диаметром до 1,8 см. После проведенного дообследования по месту жительства, в объеме компьютерной томографии (КТ) ОБП, ребенок направлен на госпитализацию в НИИ ДОиГ.
При поступлении в связи с тяжестью состояния, обусловленного АКС: живот резко увеличен в размерах за счет выраженной гепатомегалии (окружность живота при поступлении 47,5 см, печень +5 см от края реберной дуги) (рис. 1), ребенок госпитализирован в ОРИТ, минуя профильное отделение.

При физикальном осмотре отмечено наличие гемангиомы кожи лица в области надбровной дуги слева, акроцианоз, тахипноэ (частота дыхательных движений (ЧДД) более 60 в 1 мин), выраженная венозная сеть на передней брюшной стенке, живот резко увеличен в размерах, пальпаторно плотный, напряженный. В условиях НИИ ДОиГ проведено комплексное обследование ребенка.
Определен уровень опухолевых маркеров: β-хорионический гонадотропин (β-ХГЧ) 0,1 мМЕ/мл, нейрон-специфическая енолаза (НСЕ) 49,93 нг/мл, α-фетопротеин (АФП) 10564,1 МЕ/мл.
В гемограмме отмечена тромбоцитопения (48×109/л).
По данным коагулограммы выявлена гипофибриногенемия до 0,4 г/л.
Данные УЗИ ОБП и забрюшинного пространства (ЗП): гепатомегалия, косой вертикальный размер (КВР) 143 мм, паренхима диффузно неоднородная, со множественными участками пониженнойэхогенности без четких контуров диаметром 10–24 мм. УЗ-картина в большей степени соответствует гемангиоматозу печени.
По данным оценки гормонального профиля отмечено повышение уровня тиреотропного гормона (ТТГ) до 26,41 мМЕ/л, при этом уровень тироксина (свТ4) составил 26,1 пмоль/л, трийодтиронина (свТ3) — 4,8 пмоль/л.
По данным УЗИ щитовидной железы патологии не выявлено.
Учитывая полученные данные, ребенок был осмотрен детским эндокринологом: гипофункция щитовидной железы, вероятнее всего, ассоциирована с основным заболеванием. В связи с этим ребенку назначена заместительная гормональная терапия левотироксином в дозе 2 мкг/кг/сут.
Данные КТ ОБП и ЗП с внутривенным контрастированием: паренхима печени тотально изменена за счет множественных очагов до 4 см в диаметре, с нечеткими неровными контурами, при контрастировании определяется центрипетальный характер накопления, что характерно для гемангиоматоза.
По данным ЭхоКГ обращал на себя внимание врожденный порок сердца: вторичный дефект межпредсердной перегородки 7–8 мм с лево-правым сбросом, незначительная дилатация левого предсердия (z-score +2,34), легочная гипертензия (систолическое давление в легочной артерии 40–43 мм рт. ст.). Сократимость левого желудочка (ЛЖ) удовлетворительная (фракция выброса ЛЖ по Симпсону 72%).
По результатам ЭКГ синусовый ритм, нормальное положение электрической оси сердца (ЭОС).
При поступлении по данным анализа на кислотно-щелочное состояние отмечались смешанный ацидоз (pH 7,119), гиперлактатемия (3,5 ммоль/л), гипонатриемия (123 ммоль/л).
Через 12 ч от момента поступления в ОРИТ состояние с отрицательной динамикой в виде угнетения сознания, нарастания дыхательной недостаточности, на электрокардиомониторе регистрировался синусовый ритм с тенденцией к брадикардии до 70 уд/мин. Введены атропин из расчета 0,01 мг/кг, фуросемид 1 мг/кг, дексаметазон 0,2 мг/кг медленно. Учитывая нарастание дыхательной недостаточности, клиническую картину отека легких, угнетение сознания, развитие жизнеугрожающей брадикардии, принято решение о переводе пациентки на искусственную вентиляцию легких, после чего состояние ребенка было стабилизировано, гемодинамические показатели оставались в норме.
С учетом клинической картины, данных комплексного обследования ребенку установлен клинико-рентгенологический диагноз: диффузный неонатальный гемангиоматоз печени с поражением кожи. Врожденный порок сердца: вторичный дефект межпредсердной перегородки. Легочная гипертензия. Недостаточность кровообращения I. Функциональный класс II по ROSS. Дыхательная недостаточность 1-й степени. Учитывая локализацию, размеры и распространенность процесса, а также высокие риски интра- и постоперационных осложнений вплоть до летального исхода, проведение хирургического вмешательства с целью морфологической верификации диагноза не представлялось возможным. Принимая во внимание доброкачественный характер заболевания, с целью лечения тотального поражения печени множественными гемангиомами ребенку инициирована терапия неселективным β-блокатором (пропранолол) в лекарственной форме раствора для приема внутрь Гемангиол®. По результатам суточного мониторирования ЭКГ нарушений ритма и проводимости не зарегистрировано. Несмотря на то, что в общей характеристике данного лекарственного препарата указано, что стартовая доза составляет 1 мг/кг/сут, разделенная на 2 приема по 0,5 мг/кг, с постепенным увеличением дозы на 1 мг/кг в неделю до достижения терапевтической дозировки в 3 мг/кг, в данном случае препарат был назначен со стартовой дозы 0,5 мг/кг/сут, перорально (в 3 приема), с постепенным увеличением суточной дозы на 0,5 мг/кг/сут, каждые 3 дня до достижения максимальной терапевтической дозы 3 мг/кг/сут. Такой режим дозирования был установлен по решению врачебной комиссии в связи с общим тяжелым состоянием пациентки.
Терапия пропранололом проводилась на фоне гормональной терапии (L-тироксин), инфузионной терапии, профилактики геморрагических осложнений, гепатопротективной терапии, диуретической терапии, заместительных трансфузий эритроцитной взвеси, свежезамороженной плазмы, криопреципитата. Энтеральная нагрузка проводилась через назогастральный зонд адаптированной молочной смесью Нутрилон 1 в трофическом объеме 5 мл/ч.
На 10-й день терапии отмечена выраженная положительная динамика в виде купирования АКС (окружность живота 42 см, печень +3 см от края реберной дуги), появления эффективного самостоятельного дыхания (ребенок экстубирован). На 14-е сутки ребенок в стабильном состоянии переведен в профильное отделение для продолжения терапии пропранололом и сопроводительной терапии.
При достижении максимальной терапевтической дозы пропранолола 3 мг/кг/сут отмечена выраженная положительная динамика в виде сокращения размеров гемангиомы кожи лица с 1,5 см в диаметре до 0,8 см, купирования АКС (окружность живота составила 38 см), нормализации уровня тромбоцитов в соответствии с возрастной нормой, снижения показателей ТТГ, свТ3, свТ4 в динамике. Терапию переносила удовлетворительно, нежелательных явлений за все время наблюдения зафиксировано не было.
По данным инструментальных методов обследования в динамике на 30-е сутки терапии:
УЗИ печени — сокращение КВР до 105 мм; уменьшение размеров множественных очаговых образований до 8×12 мм;
ЭхоКГ — сокращение размеров дефекта межпредсердной перегородки до 5–6 мм; уменьшение полостей сердца до нормальных размеров; отсутствие признаков легочной гипертензии;
МРТ ОБП — картина гемангиоматоза печени с положительной динамикой в сравнении с КТ-картиной при поступлении. В паренхиме печени множественные объемные образования неправильной формы до 3,7 см, субтотально замещающие паренхиму. При внутривенном мультифазном контрастировании определяется центрипетальный тип накопления контрастного препарата образованиями (рис. 2).
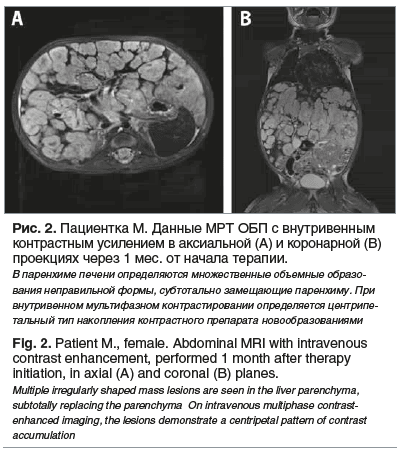
Таким образом, через 4 нед. от старта терапии, учитывая положительную динамику по данным инструментально-лабораторных исследований, отсутствие нежелательных явлений на фоне терапии пропранололом, ребенок был выписан домой с рекомендациями по лечению и дальнейшему наблюдению.
При контрольном обследовании через 2 мес. от начала терапии отмечались дальнейшая положительная динамика в виде уменьшения размеров печени, сокращения размеров очагов, в том числе за счет сокращения зон кровоизлияний в них (рис. 3), а также регресс гипофункции щитовидной железы с нормализацией гормонального профиля.
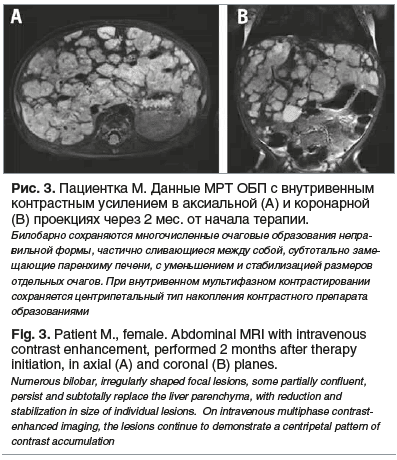
В настоящее время ребенок продолжает получать терапию пероральным раствором пропранолола в дозе 3 мг/кг/сут, переносимость препарата удовлетворительная. Длительность лечения составляет 9 мес. Запланирована контрольная МРТ ОБП.
Клиническое наблюдение 2
Мальчик В. в возрасте 2,5 мес. поступил в НИИ ДОиГ с предварительным диагнозом «диффузный гемангиоматоз печени». Из анамнеза жизни известно, что ребенок от 4-й беременности (1-я беременность 2017 г. — двойня, девочки, здоровы, 2-я беременность 2020 г. — девочка, здорова, 3-я беременность 2021 г. — медицинский аборт), протекавшей без особенностей. Роды третьи, в срок на 39-й неделе, самостоятельные, без осложнений. Масса тела при рождении 3434 г, длина тела 53 см. Оценка по шкале Апгар 8/9 баллов. УЗ-скрининг в роддоме не проводился. Из анамнеза заболевания известно, что при плановом проведении УЗИ ОБП в возрасте 1 мес. визуализированы множественные новообразования различного диаметра от 0,5 до 2,7 см с усиленным кровотоком в режиме цветного допплеровского картирования. При МРТ ОБП с внутривенным контрастированием — картина множественных образований печени с гепатомегалией, предположительно ИГ печени. С целью морфологической верификации диагноза ребенку по месту жительства выполнена биопсия печении. Согласно результатам гистологического исследования в пределах исследованного материала признаков опухолевого роста не обнаружено, больше данных за ИГ. По результатам комплексного обследования ребенку установлен диагноз «диффузный гемангиоматоз печени». В возрасте 2 мес. жизни по месту жительства начата комбинированная терапия по схеме: преднизолон 2 мг/кг/сут, пропранолол с начальной дозировкой 1 мг/кг/сут. На 3-и сутки терапии пропранололом отмечались явления брадикардии, эпизод асистолии до 3,7 с по данным холтеровского мониторирования (ХМ), в связи с чем принято решение о прекращении приема пропранолола. Терапия продолжена в монорежиме преднизолоном 2 мг/кг/сут с увеличением дозы через 12 дней до 2,5 мг/кг/сут. На 15-е сутки от постановки диагноза ребенок госпитализирован в НИИ ДОиГ в тяжелом состоянии. Тяжесть состояния обусловлена АКС: выраженная венозная сеть на передней брюшной стенке, живот резко увеличен в размерах за счет гепатомегалии (окружность живота при поступлении 47 см, печень +11 см из-под края реберной дуги), дыхательная недостаточность (SpO2 92–94%, ЧДД более 55 в 1 мин).
В условиях НИИ ДОиГ ребенок комплексно обследован.
Уровень опухолевых маркеров: НСЕ 15,8 нг/мл, АФП 524,4 МЕ/мл, β-ХГЧ <0,1 МЕ/л.
По результатам коагулограммы выявлена гипофибриногенемия — 1,2 г/л.
В общем анализе крови выраженных отклонений не выявлено.
Пересмотр МРТ ОБП с контрастным усилением: печень увеличена в размерах. Во всех отделах печени визуализируются множественные узловые образования размерами от 1 до 3 см с четкими, ровными контурами (рис. 4).

Данные УЗИ ОБП: печень значительно увеличена, КВР 96 мм, толщина левой доли 80 мм, поперечный размер обеих долей 126 мм. В паренхиме обеих долей определяются множественные изо- или гипоэхогенные образования диаметром 10–20 мм, часть из них имеет гиперэхогенный ободок. Образования частично сливаются между собой.
По данным оценки гормонального профиля отмечено повышение уровня ТТГ до 27,2 мМЕ/л, при этом уровень свТ4 составил 18,5 пмоль/л, свТ3 — 3,0 пмоль/л.
По результатам УЗИ щитовидной железы патологии не выявлено.
Ребенок консультирован врачом-эндокринологом, установлен диагноз «транзиторный гипотиреоз», в связи с чем назначена заместительная гормональная терапия левотироксином 2 мкг/кг/сут.
Данные ЭхоКГ: незначительная дилатация левого предсердия. Фракция выброса ЛЖ 75%. Открытое овальное окно 4,5–5 мм. Гемодинамически незначимые клапанные регургитации.
ЭКГ: синусовый ритм. ЭОС отклонена вправо.
В НИИ ДОиГ проведен референс гистологических препаратов, по результатам которого морфологическая картина соответствовала гемангиоме, признаков опухолевого роста не обнаружено.
Принимая во внимание результаты проведенного комплексного обследования, пациенту установлен окончательный клинический диагноз: диффузный неонатальный гемангиоматоз печени.
Учитывая массивное поражение печени, осложнившееся ЖУС, неэффективность монотерапии преднизолоном, после проведения ХМ, исключив нарушения ритма и проводимости, паузы ритма, превышающие возрастную норму, ребенку возобновили терапию β-блокатором пропранололом в лекарственной форме раствора для приема внутрь Гемангиол®, с начальной дозировки 1 мг/кг/сут, с постепенным титрованием дозы до 3 мг/кг/сут, под контролем витальных функций, результатов лабораторно-инструментальных исследований. Принято решение терапию преднизолоном деэскалировать с постепенной отменой по схеме: -25% от суточной дозы каждые 4 дня.
Терапия пропранололом проводилась на фоне гормональной терапии (L-тироксин), инфузионной терапии, заместительных трансфузий эритроцитной взвеси, свежезамороженной плазмы, криопреципитата.
На 15-е сутки терапии, по достижении максимальной терапевтической дозы (3 мг/кг/сут), отмечена положительная динамика в виде уменьшения окружности живота до 45 см (-2 см), купирования признаков дыхательной недостаточности (уменьшение ЧДД до 40–42 в 1 мин), купирования трансфузионной зависимости.
При проведении контрольного УЗИ ОБП отмечена положительная динамика в виде сокращения размеров левой доли печени до 67 мм (ранее — 80 мм), улучшения визуализации сосудов печени, сокращения средних размеров узловых образований. По данным ЭхоКГ межпредсердное сообщение не визуализируется. Полости сердца не увеличены. Признаков легочной гипертензии нет. Сократительная способность миокарда ЛЖ удовлетворительная. По данным ХМ пауз ритма и нарушения проводимости на фоне терапии не регистрировалось. В лабораторных показателях (общеклинический и биохимический анализы крови, гормональный профиль, коагулограмма) отклонений не выявлено. Гормональная терапия L-тироксином продолжена с уменьшением дозировки до 0,5 мкг/кг/сут с постепенной отменой под контролем лабораторных данных.
Таким образом, через 3 нед. от старта терапии по данным проведенного инструментального и лабораторного обследований отмечена положительная динамика, ЖУС купированы. Учитывая положительную динамику, отсутствие нежелательных явлений, терапию продолжили в амбулаторных условиях по месту жительства.
Спустя 6 мес. от начала терапии проведена МРТ ОБП с внутривенным контрастированием — отмечена дальнейшая положительная динамика в виде уменьшения размеров печени и узловых образований до 0,5–1,6 см (рис. 5).
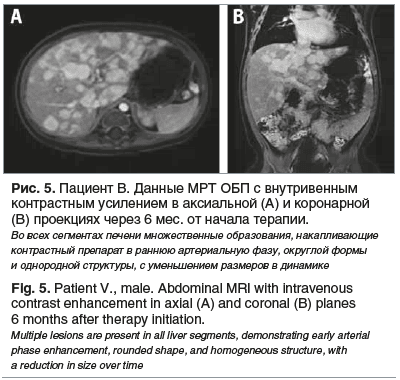
В настоящее время ребенок продолжает получать терапию пропранололом в дозе 3 мг/кг/сут по месту жительства под контролем функции сердечно-сосудистой системы, переносимость препарата удовлетворительная. Длительность терапии составляет 7 мес.
Клиническое наблюдение 3
Девочка И. в возрасте 4 мес. поступила в НИИ ДОиГ с направляющим диагнозом «кистозное образование гортани».
Из анамнеза жизни известно, что ребенок от 1-й беременности, первых родов путем планового кесарева сечения (показания со стороны матери), протекавшей без особенностей. Масса тела при рождении 3270 г, длина тела 50 см. Оценка по шкале Апгар 9/9 баллов. УЗ-скрининг в роддоме не проводился. Из анамнеза заболевания известно, что с 1-го месяца жизни мать стала отмечать шумное дыхание у ребенка, в связи с чем наблюдались у педиатра по месту жительства с предварительным диагнозом «острый бронхит». В течение 3 нед. проводилось консервативное лечение будесонидом (ингаляционно) с кратковременным эффектом. Принимая во внимание развитие одышки (ЧДД 50 в 1 мин), усиление шумного дыхания, в возрасте 3 мес. ребенку выполнены рентгенография органов грудной клетки (ОГК), КТ ОГК, фибробронхоскопия. По результатам обследования: в подъязычном пространстве, с переходом на верхнюю треть трахеи, на верхнюю и нижнюю стенку выявлено кистозное образование, перекрывающее до 2/3 просвета трахеи. Пациент с диагнозом «новообразование щитовидной железы» направлен в НИИ ДОиГ для проведения дообследования.
В возрасте 4 мес. ребенок госпитализирован в НИИ ДОиГ в состоянии средней степени тяжести, обусловленном дыхательной недостаточностью 1-й степени (SpO2 92–94%, ЧДД более 45 в 1 мин). При осмотре обращало на себя внимание наличие на коже волосистой части головы, в теменной области справа, образования синевато-красного цвета, овальных очертаний размером 1,2×1,3 см (рис. 6А).
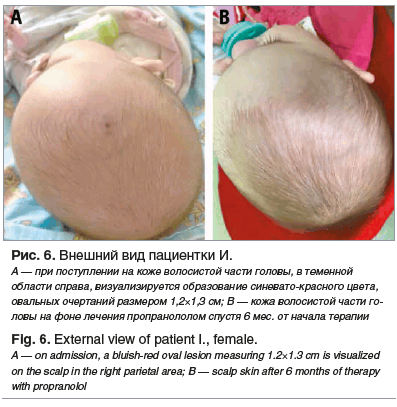
Также при осмотре отмечено шумное дыхание, аускультативно — проводные хрипы. Размеры лимфатических узлов нормальные. Признаков гепатоспленомегалии нет. В условиях профильного отделения проведено обследование в объеме:
опухолевые маркеры: β-ХГЧ 0,1 МЕ/л, АФП 42,7 МЕ/мл, НСЕ 33,3 нг/мл;
УЗИ мягких тканей шеи: в мягких тканях на уровне яремной вырезки определяются рыхлые тяжистые неоднородные ткани по типу инфильтрации, распространяются до левых яремных вен, имеют размеры 3,2×1,3×5 см. Ткани прилежат к нижнему краю левой доли щитовидной железы, окружают трахею, отмечается утолщение и слоистость задней стенки одного из колец 0,43–0,49 см;
МРТ ОГК с внутривенным контрастным усилением: в мягких тканях нижней трети шеи и верхнем средостении располагаются дополнительные ткани, общим размером 3,9×2,7×4,7 см, объемом 25 см3, тесно прилегающие к щитовидной железе, граница четко не прослеживается. В толще тканей проходят левая общая сонная артерия, левая подключичная артерия. В передневерхнем средостении определяются отдельные лимфатические узлы, располагающиеся между рукояткой грудины и плечеголовными венами, размерами от 0,5 до 1,0 см (рис. 7).
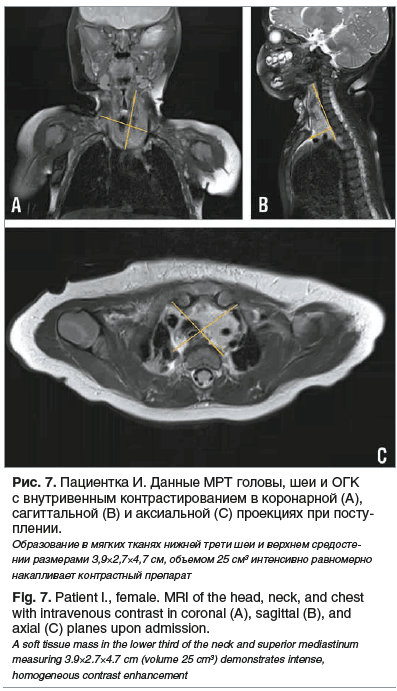
Принимая во внимание первичную локализацию образования, синтопию образования (тесно прилежит к щитовидной железе, граница четко не прослеживается; в толще тканей проходят левая общая сонная артерия, левая подключичная артерия), соотношение с соседними анатомическими структурами, хирургическое лечение на первом этапе невозможно, поскольку сопряжено с высоким риском осложнений в интра- и постоперационном периоде, вплоть до летального исхода. По результатам ларингоскопии образование извне полностью стенозирует просвет трахеи.
С целью морфологической верификации диагноза выполнены бронхоскопия и биопсия образования паратрахеальной локализации слева с одновременной постановкой временной трахеостомы. По результатам гистологического исследования: морфологическая картина соответствует ИГ.
Таким образом, установлен окончательный клинический диагноз: инфантильная гемангиома нижней трети шеи и верхнего средостения.
По данным кардиологического обследования в объеме ЭКГ, ЭхоКГ, ХМ значимой патологии выявлено не было, обращало на себя внимание открытое овальное окно размером до 3 мм, гемодинамически незначимое. Сократительная способность миокарда удовлетворительная. Нарушений ритма и проводимости не регистрировалось.
По данным проведенного исследования уровня гормонов щитовидной железы выраженных отклонений не выявлено, транзиторный гипотиреоз исключен. На 2-е сутки от постановки диагноза начата терапия β-адреноблокатором пропранололом в лекарственной форме раствора для приема внутрь Гемангиол® с титрованием дозы с 1 мг/кг/сут до 3 мг/кг/сут в течение 10 дней. Решение о более быстрой эскалации дозы было принято врачебной комиссией в связи с тяжестью состояния пациентки в виде нарастания симптомов дыхательной недостаточности.
На 14-е сутки терапии, по результатам контрольного УЗИ мягких тканей шеи, отмечена положительная динамика в виде сокращения размеров образования до 2,6×1,4×2 см, объем 3,7cм3 (инициально размеры образования по УЗИ составляли 3,2×1,3×5 см, объем 10,8 см3). Учитывая отсутствие нежелательных явлений, рекомендовано продолжение терапии в дозе 3 мг/кг/сут.
Через 1 мес. терапии: уменьшение размеров гемангиомы на коже волосистой части головы в теменной области справа до 1×1 см, отсутствие шумного дыхания. По данным МРТ ОГК с внутривенным контрастированием отмечалось уменьшение размеров образования в мягких тканях нижней трети шеи, в сравнении с инициальным исследованием до 3,0×2,5×4,6 см, объем 17,9 см3. Образование сократилось на 30,1%. Таким образом, через 1 мес. от старта терапии по данным проведенного инструментального и лабораторного обследования отмечена положительная динамика без побочных явлений, терапия продолжена в амбулаторных условиях по месту жительства. В межгоспитальный период ребенку в рекомендованные сроки выполнялись исследования сердечно-сосудистой системы (ЭКГ, ЭхоКГ, ХМ), данных за патологические изменения получено не было, однако ежемесячная коррекция дозы относительно прибавки массы тела по месту жительства не проводилась.
По данным МРТ ОГК с внутривенным контрастированием через 6 мес. от начала терапии отмечена положительная динамика в виде дальнейшего сокращения размеров образования до 0,8×0,6×3,2 см, объем 0,79 см3, т. е. на 96,8%. Как и ранее, образование тесно прилежит к щитовидной железе, по его левому краю проходят левые общая сонная и подключичная артерии. Левая плечеголовная вена расположена вдоль передней поверхности образования, левая позвоночная артерия — по задней поверхности. Патологические ткани тесно прилежат к дуге аорты, плечеголовному стволу, левой полуокружности трахеи и передней стенке пищевода (рис. 8). На волосистой части головы гемангиома не определяется (рис. 6B).
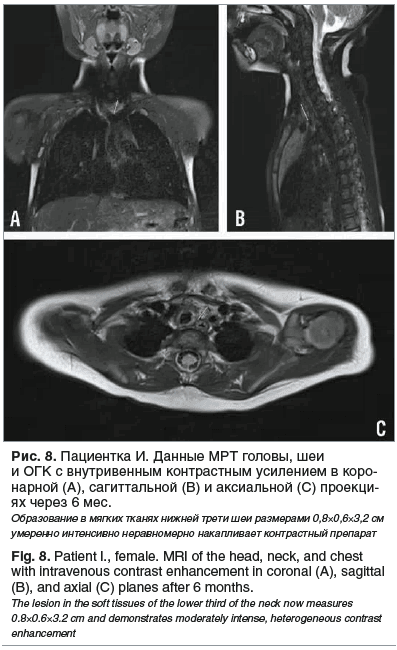
Учитывая выраженную положительную динамику, ребенку удалена трахеостома. В связи с физиологическим уменьшением суточной дозировки препарата до 2,2 мг/кг/сут лечение было продолжено с пересчетом дозы до 2,5 мг/кг/сут. В настоящее время длительность терапии пропранололом составляет 8 мес., переносимость удовлетворительная.
Обсуждение
Гемангиоматоз внутренних органов редкий, но в ряде случаев грозный диагноз, вызывающий множество ЖУС, в связи с чем важна быстрая диагностика и своевременное назначение терапии, в отдельных случаях требуется индивидуальный подход к титрованию дозировок и назначению сопутствующей терапии.
Следует помнить, что ИГ кожи могут сочетаться с висцеральными поражениями. Наиболее частым висцеральным органом, вовлекаемым в патологический процесс, является печень [3, 10]. Выделяют очаговые, мультифокальные и диффузные формы гемангиом печени [11].
Диффузные ИГ печени всегда сопровождаются тяжелым клиническим течением, возникающим по причине АКС, представляя угрозу жизни больного, что требует мультимодального подхода в лечении [4, 12].
В некоторых случаях гемангиомы могут быть частью синдрома, например PHACE (англ.: posterior fossa abnormalities, hemangioma, and arterial, cardiac, eye, and sternal abnormalities), включающего порок развития задней черепной ямки, гемангиомы, пороки развития сердца, аномалии развития глаз. Данный синдром ассоциируется с преэклампсией или аномалиями развития плаценты [12, 13]. Другой синдром, проявляющийся гемангиомами, — синдром поясничного отдела позвоночника — LUMBAR (lumbar spine syndrome — множественные гемангиомы нижней части тела, аномалии развития мочеполовой системы, костные деформации, сосудистые мальформации) [12–15]. При диффузном гемангиоматозе с поражением печени у ряда пациентов наблюдаются стойкая тромбоцитопения и гипокоагуляция, что связано с синдромом Казабаха — Мерритт [12–15]. Также может иметь место вторичный гипотиреоз, требующий назначения заместительной гормональной терапии, однако данное осложнение купируется по мере инволюции опухоли, в связи с чем дозу препарата уменьшают вплоть до полной его отмены [16].
В исследовании С. Leaute-Labreze et al. [17], опубликованном в 2008 г., продемонстрирована эффективность системной терапии неселективным β-адреноблокатором пропранололом. Позже французскими исследователями было создано лекарственное средство для лечения ИГ у детей первого года жизни на основе пропранолола в форме раствора для приема внутрь — Гемангиол®. В настоящее время терапия данным препаратом рекомендована в качестве терапии выбора у пациентов с ИГ, требующими назначения системной терапии [17–19]. Гемангиол® (МНН — пропранолол) — это единственный официально зарегистрированный препарат для лечения ИГ у детей в странах Европы и США, который включен в европейские, американские и российские клинические рекомендации по лечению данной патологии [19, 20]. В России препарат зарегистрирован в 2015 г. и также с успехом применяется в клинической практике у детей с 5 нед. жизни1,2.
Несмотря на то, что гемангиома — это доброкачественное новообразование, при диффузной форме с массивным поражением печени смертность достигает 70% [3, 10, 18]. Высокая летальность связана с развитием полиорганной недостаточности на фоне АКС, а также ДВС-синдромом на фоне коагулопатии при поражении печени.
Также в отдельных случаях могут возникать трудности в диагностике патологического образования, несмотря на то, что УЗИ и МРТ позволяют с высокой точностью проводить дифференциальную диагностику, в редких случаях может требоваться диагностическая биопсия образования, как в одном из представленных клинических наблюдений.
Лечение пациентов в первую очередь направлено на ускорение инволюции опухоли с целью сокращения размеров образования и купирования ЖУС, предотвращения сдавления жизненно важных органов. Нашим пациентам проводилась терапия пропранололом в лекарственной форме раствора для приема внутрь под контролем витальных функций, лабораторно-инструментальных исследований, в каждом случае, в зависимости от тяжести состояния, были подобраны индивидуальный режим дозирования и объем сопутствующей терапии, в результате лечение привело к значительному клиническому улучшению состояния и купированию ЖУС.
Заключение
Гемангиомы внутренних органов у новорожденных — редкое и потенциально опасное для жизни состояние, требующее мультидисциплинарного подхода к диагностике и лечению. Необходимо учитывать сопутствующую патологию, ассоциированную с этим заболеванием, контролировать процесс лечения совместно с врачом-кардиологом и другими профильными специалистами. У пациентов с ЖУС на фоне нарушения функций органов и систем, на первых этапах лечения также может потребоваться наблюдение и участие в лечении врача анестезиолога-реаниматолога. Своевременное выявление и адекватное лечение ИГ существенно улучшают прогноз и качество жизни.
СВЕДЕНИЯ ОБ АВТОРАХ:
Туркия Лана Романовна — врач — детский кардиолог поликлинического отделения НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0009-0007-5457-6530
Муфтахова Гузель Маратовна — к.м.н., врач — детский онколог детского онкологического отделения хирургических методов лечения с проведением химиотерапии детей раннего возраста НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-8487-1879
Карманова Джульета Авазовна — врач — детский онколог детского онкологического отделения хирургических методов лечения с проведением химиотерапии детей раннего возраста НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0009-0005-2692-5938
Ванесян Владимир Шамирович — врач — детский онколог детского онкологического отделения хирургических методов лечения с проведением химиотерапии детей раннего возраста НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-0138-3379
Тухватуллина Регина Рамильевна — врач анестезиолог-реаниматолог НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-7126-2708
Матинян Нуне Вануниевна — д.м.н, заведующая отделом анестезиологии и реанимации НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0001-7805-5616
Чуфистова Екатерина Владимировна — врач-рентгенолог детского отделения рентгенодиагностики НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23;ORCID iD 0009-0005-2485-278X
Казанцев Анатолий Петрович — д.м.н., заведующий детским онкологическим отделением хирургических методов лечения с проведением химиотерапии детей раннего возраста НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0001-7309-1650
Валиев Тимур Теймуразович — д.м.н., в.н.с., заведующий отделением детской онкологии и гематологии (химиотерапии гемобластозов) № 1 НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-1469-2365
Белышева Татьяна Сергеевна — д.м.н., в.н.с., врач-дерматовенеролог поликлинического отделения НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0001-5911-553X
Варфоломеева Светлана Рафаэлевна — д.м.н., профессор, директор НИИ детской онкологии и гематологии им. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 155522, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0001-6131-1783
Контактная информация: Туркия Лана Романовна, e-mail: turkiyal@mail.ru
Источник финансирования: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 10.03.2025.
Поступила после рецензирования 02.04.2025.
Принята в печать 25.04.2025.
ABOUT THE AUTHORS:
Lana R. Turkiya — pediatric cardiologist at the Polyclinic Department, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0009-0007-5457-6530
Guzel M. Muftakhova — C. Sc. (Med.), pediatric oncologist at the Pediatric Oncological Department of Surgical Methods of Treatment with Chemotherapy for Infants, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0002-8487-1879
Juliet A. Karmanova — pediatric oncologist at the Pediatric Oncological Department of Surgical Methods of Treatment with Chemotherapy for Infants, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0009-0005-2692-5938
Vladimir Sh. Vanesyan — pediatric oncologist at the Pediatric Oncological Department of Surgical Methods of Treatment with Chemotherapy for Infants, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0002-0138-3379
Regina R. Tukhvatullina — anesthesiologist and intensive care physician, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0002-7126-2708
Nune V. Matinyan — Dr. Sc. (Med.), Head of the Department of Anesthesiology and Intensive Care, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0001-7805-5616
Ekaterina V. Chufistova — radiologist of the Children’s Department of X-ray Diagnostics, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0009-0005-2485-278X
Anatoly P. Kazantsev — Dr. Sc. (Med.), Head of the Pediatric Oncology Department of Surgical Methods of Treatment with Chemotherapy for Infants, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National
Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0001-7309-1650
Timur T. Valiev — Dr. Sc. (Med.), Leading Researcher, Head of the Department of Pediatric Oncology and Hematology (Hemoblastosis Chemotherapy) No. 1, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0002-1469-2365
Tatiana S. Belysheva — Dr. Sc. (Med.), Leading Researcher, dermatovenerologist at the Polyclinic Department, L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0001-5911-553X
Svetlana R. Varfolomeeva — Dr. Sc. (Med.), Professor, Director of the L.A. Durnov Research Institute of Pediatric Oncology and Hematology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 155522, Russian Federation; ORCID iD 0000-0001-6131-1783
Contact information: Lana R. Turkiya, e-mail: turkiyal@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 10.03.2025.
Revised 02.04.2025.
Accepted 25.04.2025.
1Общая характеристика лекарственного препарата Гемангиол® ЛП-№(000326)- (РГ-RU).
2Клинические рекомендации Минздрава России. Гемангиома инфантильная. 2023.
Информация с rmj.ru






