Системная красная волчанка (СКВ) — хроническое системное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным структурам ядра клеток с развитием иммуновоспалительного повреждения тканей и внутренних органов [1], выраженным клиническим полиморфизмом. В 15–20% случаев заболевание дебютирует до 18 лет, в 80–85% случаев — после 18 лет. Среди пациентов с СКВ до 90% составляют женщины репродуктивного возраста, пик заболеваемости приходится на 15–30 лет. Дебют СКВ у детей приходится на 11–12 лет [2]. По некоторым данным, ювенильная СКВ (юСКВ) отличается от взрослой СКВ (вСКВ) более агрессивным течением, высокой активностью заболевания, большей лекарственной нагрузкой (высокие дозы глюкокортикостероидов (ГКС) и цитостатиков), что приводит к повреждению органов и систем [3, 4]. Так, исследование, проведенное в Испании, показало, что у пациентов с юСКВ значительно чаще встречались клинические проявления, такие как лимфоаденопатия, лихорадка, острая красная волчанка, язвы слизистых оболочек, перикардит, плеврит, феномен Рейно, волчаночный нефрит, тромбоцитопения, гемолитическая анемия, судороги, органическое поражение головного мозга. Отмечались также и высокие цифры индекса активности SLEDAI-2K и индекса повреждения SLICC/ACR-DI, что говорит о более активном течении заболевания и повреждении органов и систем у детей с СКВ в сравнении со взрослой популяцией больных СКВ [5]. По данным другого исследования, у детей с СКВ чаще встречались поражение почек, нейропсихические проявления и гемолитическая анемия [6]. Следует отметить, что наблюдения, подобные вышеупомянутым, немногочисленны и проведены на зарубежных популяциях пациентов, что требует отдельного изучения особенностей клинического течения СКВ у российской популяции пациентов. Актуальность представленной работы определяется и тем, что лечение СКВ в последние годы изменилось, что могло привести к изменению активности заболевания и повреждения органов у пациентов разных возрастных групп.
Цель исследования: сравнить клинические проявления и особенности лечения СКВ у пациентов с дебютом заболевания до 18 лет и после 18 лет.
Содержание статьи
Материал и методы
Исследование проведено на базе СПб ГБУЗ «КРБ № 25», у участников получено добровольное письменное информированное согласие. В обследование были включены 82 пациента с диагнозом СКВ, установленным согласно критериям SLICC (2012) / EULAR (2019). Пациенты были разделены на 2 группы по возрасту дебюта клинических проявлений: 50 (61%) пациентов с дебютом клинических проявлений СКВ в возрасте до 18 лет составили группу юСКВ, 32 (39%) пациента с дебютом СКВ в 18 лет и старше были включены в группу вСКВ. Диагноз был верифицирован у 1-й группы пациентов в возрасте 22,36±7,55 года, а у 2-й группы — в 34,09±6,58 года. Активность заболевания оценивали на момент осмотра с помощью расчета индекса SLEDAI-2K [7]. Для характеристики течения и исходов СКВ использовался индекс тяжести и повреждения SLICC/ACR DI. В терапии СКВ используют препараты с иммуносупрессивными свойствами: ГКС, циклофосфамид, азатиоприн, метотрексат, мофетил микофенолат, аминохинолиновые средства (хлорохин, гидроксихлорохин), а также генно-инженерные биологические препараты (ГИБП): ритуксимаб и белимумаб.
Все полученные в ходе исследования данные пациентов были обезличены и не позволяли идентифицировать пациента.
Статистический анализ проводили с использованием пакета программного обеспечения Jamovi. В случае нормального распределения признака его описывали как среднее ± стандартное отклонение (M±SD). Для сравнения групп применяли t-критерий. Также для сравнения групп применяли критерий χ2. Различия и взаимосвязи считали статистически значимыми при p<0,05.
Исследование одобрено комитетом по этике СПб ГБУЗ «КРБ № 25».
Результаты исследования
Клинико-лабораторная характеристика пациентов, включенных в исследование, представлена в таблице 1.
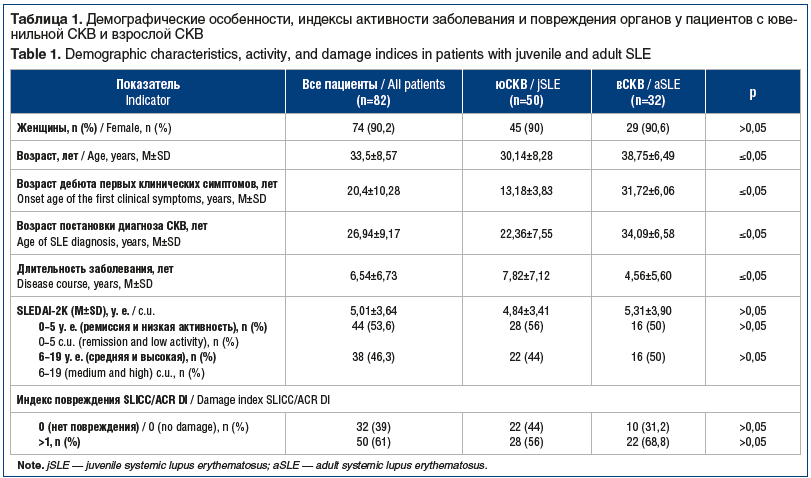
Различия пациентов сравниваемых групп по возрасту, дате дебюта и постановки диагноза закономерны и составляют суть проводимой работы. Несмотря на демографические различия, обследованные нами пациенты не различались по средним значениям индексов активности заболевания SLEDAI-2K и повреждения SLICC/ACR DI (см. табл. 1), но различались по показателям активности болезни: у пациентов с вСКВ средняя и высокая активность заболевания (индекс SLEDAI-2К 6–19 у. е.) встречалась чаще, чем у пациентов с юСКВ (50% и 44% соответственно), тогда как доля пациентов с ремиссией и низкой степенью активности (индекс SLEDAI-2К 0–6 у.е.) была больше в группе юСКВ (56% и 50% соответственно). Медиана активности СКВ в группах юСКВ и вСКВ составила 4,84 и 5,31 у. е. соответственно. В группе юСКВ зафиксировано отсутствие повреждения органов (индекс SLICC/ACR DI=0) в 44% случаев, индекс повреждения SLICC/ACR DI >1 был у 56% пациентов, в группе вСКВ у 31,2% пациентов отсутствовало повреждение органов, у 68,8% пациентов результат SLICС/ACR DI составлял >1.
При анализе поражения отдельных органов и систем организма мы установили отсутствие различий частоты органных поражений у пациентов с юСКВ и вСКВ (p≥0,05 для всех) (табл. 2) при наличии тенденции к более частому поражению кожи и слизистых оболочек в возрасте до 18 лет.
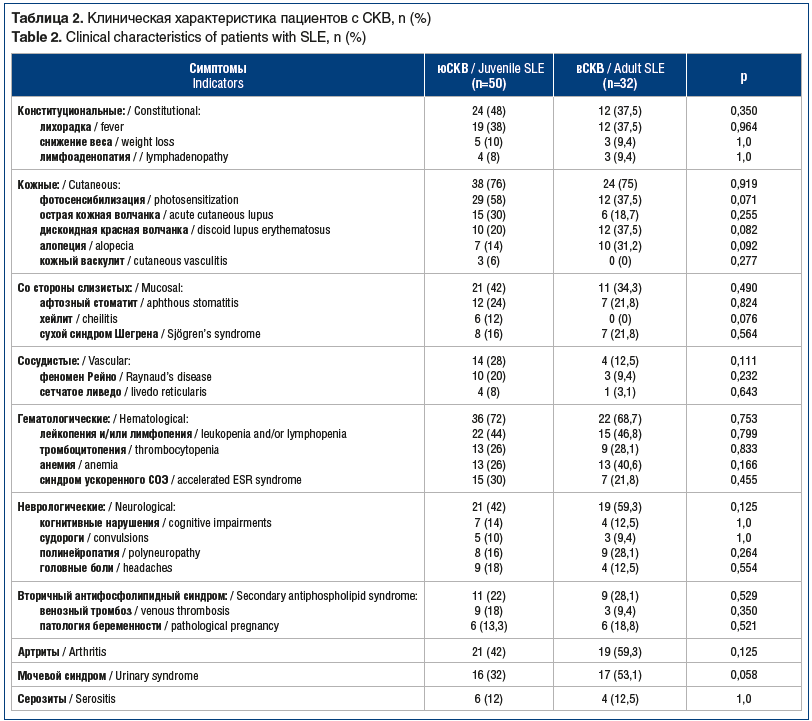
На момент обследования 96% пациентов в каждой группе получали ГКС, тогда как гидроксихлорохин принимали 88% пациентов с юСКВ и 96,8% пациентов с вСКВ. Среди пациентов с активностью заболевания SLEDAI-2K ≤5 у. е. в группах юСКВ и вСКВ ГКС получали 93%. Все пациенты с активностью заболевания SLEDAI-2K >5 у. е. применяли ГКС.
Циклофосфамид чаще получали пациенты с вСКВ, чем пациенты с юСКВ. Азатиоприн и мофетил микофенолат существенно чаще принимали пациенты с юСКВ, а метотрексат применяли менее 10% пациентов в обеих группах. Ритуксимаб получали 20% пациентов с юСКВ и 6,25% пациентов с вСКВ, тогда как белимумаб был назначен только пациентам с юСКВ (табл. 3). Таким образом, при юСКВ ГИБП применяли в 32% случаев, при вСКВ — в 6,25% (p<0,05).
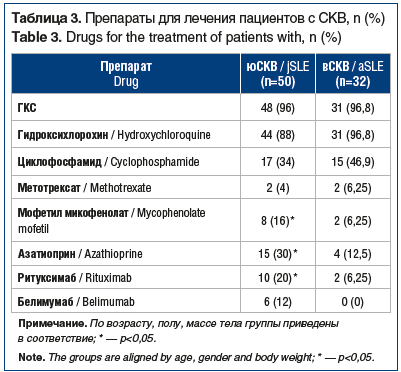
При анализе особенностей применения ГКС у пациентов с разными формами СКВ установлено, что суточная доза ГКС (в перерасчете на преднизолон) у пациентов со средней и высокой активностью заболевания с дебютом СКВ после 18 лет была статистически значимо выше, чем у пациентов с юСКВ, и составила 27,8 мг против 14,65 мг (p<0,01). У пациентов с низкой активностью заболевания различия в средней дозе ГКС в обеих группах были статистически незначимы (p≥0,05): средняя суточная доза ГКС у пациентов с юСКВ и вСКВ составила 8,34 и 7,58 мг соответственно.
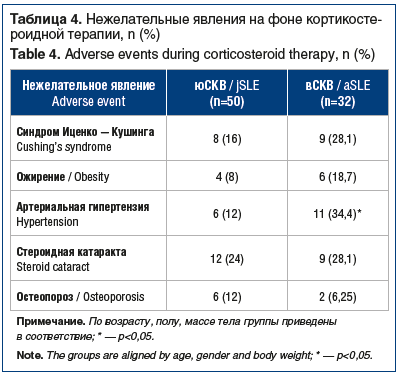
Среди нежелательных побочных реакций на фоне приема ГКС у пациентов с вСКВ достоверно чаще встречалась артериальная гипертензия (р<0,05), наблюдалась тенденция к большей частоте развития синдрома Иценко — Кушинга, ожирения, стероидной катаракты при вСКВ и остеопороза при юСКВ (см. табл. 4).
Обсуждение
В ходе проведенного исследования достоверных различий между клиническими проявлениями СКВ у пациентов с ювенильной и взрослой формами заболевания не обнаружено. Это может быть обусловлено как прогрессом, достигнутым за последние годы в лечении юСКВ, позволившим корригировать ее более агрессивное течение, так и тем, что исследования, продемонстрировавшие более тяжелое течение СКВ, были проведены при участии пациентов из южных популяций (Испания, Португалия и др.), в то время как обследованные нами пациенты проживают на Северо-Западе России, где меньше инсоляция [3, 8–12]. Последнее объяснение подтверждает тот факт, что у пациентов в нашем исследовании наблюдается лишь тенденция к большему поражению кожи, тогда как в исследовании [5] поражение кожи и слизистых отмечалось чаще у пациентов с юСКВ. Исследование, проведенное R. Mina et al. [13], показало, что дискоидная красная волчанка встречалась чаще у пациентов с вСКВ, а фотосенсибилизация чаще обнаруживалась у пациентов с юСКВ. По нашим данным, при вСКВ несколько чаще встречалось поражение почек, что может объяснять большие дозы препаратов, используемые у таких пациентов [3, 6, 12]. Отсутствие большей активности юСКВ в нашем исследовании может объясняться более частым применением у указанных пациентов ГИБП. Этот же факт может объяснять и меньшую нагрузку ГКС у пациентов с активной юСКВ.
Известно, что длительный прием ГКС повышает риск развития нежелательных побочных явлений, таких как синдром Иценко — Кушинга, артериальная гипертензия, стероидный остеопороз, катаракта. При сравнительном анализе нежелательных реакций применения ГКС при вСКВ чаще наблюдались артериальная гипертензия и компоненты метаболического синдрома, а при юСКВ — остеопороз. По данным нашего исследования, 96% всех пациентов получали кортикостероидную терапию. Несмотря на то, что более чем у половины из них была ремиссия или низкая активность заболевания, суточная доза по преднизолону превысила 7,5 мг, что может говорить о недостаточности иммуносупрессивной терапии или наличии вторичной надпочечниковой недостаточности. Следует отметить, что в нашу выборку были включены пациенты молодого возраста и надпочечниковая недостаточность, вероятнее всего, развилась по причине превышения необходимых доз и/или сроков лечения ГКС, то есть свидетельствовала о «перелечивании» пациентов ГКС при вСКВ. В этой связи обращает на себя внимание факт более частого применения ГКС при вСКВ у пацинтов, не достигших низкой активности, по сравнению с пациентами с юСКВ. Именно это может определять большую встречаемость метаболического синдрома при вСКВ по сравнению с юСКВ. В совокупности с ранее опубликованными данными о большей потребности пациентов с юСКВ в активной терапии закономерным представляется вывод о «перелеченности» ГКС пациентов с вСКВ и необходимости совершенствования подходов к базисной иммуносупрессивной терапии в указанной популяции [3, 4]. Одним из перспективных путей улучшения лечения пациентов с СКВ представляется блокада интерферонового пути патогенеза этого заболевания.
Заключение
В условиях применения современных подходов к лечению клинические проявления СКВ, дебютировавшей в ювенильном и взрослом возрасте, не отличаются. При этом у пациентов с активной вСКВ применяются большие дозы ГКС, реже назначаются ГИБП и чаще встречаются артериальная гипертензия и компоненты метаболического синдрома, чем при юСКВ. После достижения низкой активности СКВ более 97% пациентов продолжают применение ГКС вне зависимости от возраста дебюта СКВ.
Полученные данные свидетельствуют о том, что, несмотря на прогресс, достигнутый в лечении СКВ, в том числе ювенильной формы, считавшейся ранее более прогностически неблагоприятной в сравнении со взрослой формой, сохраняется острая необходимость внедрения новых лекарственных средств и схем их применения для реализации идеи лечения с минимизацией нагрузки ГКС.
Сведения об авторах:
Мазуров Вадим Иванович — д.м.н., академик РАН, заслуженный деятель науки Российской Федерации, профессор, руководитель центра аутоиммунных заболеваний СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; главный научный консультант, директор НИИ ревматологии и заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-0797-2051.
Алиев Дамир Бурганович — врач-ревматолог СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0001-8367-4622.
Гайдукова Инна Зурабиевна — д.м.н., заместитель директора НИИ ревматологии, профессор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0003-3500-7256.
Инамова Оксана Владимировна — к.м.н., главный врач СПб ГБУЗ «КРБ № 25»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; заместитель директора НИИ ревматологии, ассистент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-9126-3639.
Контактная информация: Алиев Дамир Бурганович, e-mail: rv-aliev88@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 01.07.2022.
Поступила после рецензирования 26.07.2022.
Принята в печать 18.08.2022.
About the authors:
Vadim I. Mazurov — Dr. Sc. (Med.), Academician of the Russian Academy of Sciences, Honored Scientist of the Russian Federation, Head of the Center of Autoimmune Diseases, Clinical Rheumatological Hospital No. 25; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; Chief Scientific Consultant, Director of the Research Institute of Rheumatology, Head of the Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-0797-2051.
Damir B. Aliev — rheumatologist, Clinical Rheumatological Hospital No. 25; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0000-0001-8367-4622.
Inna Z. Gaydukova — Dr. Sc. (Med.), Deputy Director of the Research Institute of Rheumatology, Professor of the Department of Internal Medicine, Rheumatology, Examination of Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Clinical Rheumatological Hospital No. 25; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0000-0003-3500-7256.
Oksana V. Inamova — C. Sc. (Med.), Chief Officer of Clinical Rheumatology Hospital No. 25; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; Head of the Research Institute of Rheumatology, Assistant Professor of the Department of Internal Medicine, Rheumatology, Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; Mechnikov: 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-9126-3639.
Contact information: Damir B. Aliev, e-mail: rv-aliev88@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 01.07.2022.
Revised 26.07.2022.
Accepted 18.08.2022.
Информация с rmj.ru





