Склероатрофический лихен аногенитальной локализации: клинико-морфологические, дифференциально-диагностические особенности и комплексный метод лечения
Содержание статьи
Введение
Склероатрофический лихен (СЛ) представляет собой хронический аутоиммунный дерматоз, протекающий с очаговой атрофией кожи и поражением тканей аногенитальной области [1–3]. Согласно общеклинической классификации, разработанной S. Peterson, СЛ является одним из клинических вариантов бляшечной ограниченной склеродермии (ОС) [4].
Особенностью клинического течения СЛ являются поражения как кожных покровов, так и тканей аногенитальной области, которые могут быть изолированными или сочетанными [5]. Аногенитальная локализация СЛ встречается чаще у женщин, чем у мужчин, в соотношении 3:1 [6, 7], кроме того, дерматоз может развиться в любом возрасте, однако пик заболеваемости приходится на препубертатный возраст (9–11 лет) и на климактерический и/или постклимактерический период (45–55 лет). У мужчин заболевание развивается обычно после 40 лет [6–8].
Вопросы этиологии и патогенеза СЛ до конца не изучены, однако известно что в патогенезе заболевания важную роль играют: генетическая предрасположенность; угнетение активности гипофизарно-надпочечниковой системы; дисфункция щитовидной и половых желез; вакцинация; травмы; острые и хронические инфекции (иксодовый клещевой боррелиоз (Borrelia burgdorferi), скарлатина, дифтерия, рожа, инфекции передающиеся половым путем (ИППП)); вирус папилломы человека (ВПЧ); вирус простого герпеса (ВПГ); гепатит В и С и др., возможен также паранеопластический генез [9–14]. В последние десятилетия, развитие СЛ аногенитальной локализации связывают с участием эстрогенов и прогестерона и их взаимосвязи с нарушениями в реакции синтеза коллагена и компонентов соединительной ткани [13, 14]. Данные литературы сообщают, что свободная фракция тестостерона и андростендиона значительно понижена у больных с генитальным СЛ, отмечена также аномальная активность фермента 5α-редуктазы [14]. В ряде исследований роль лидирующего фактора отводится гипоэстрогении, т. к. после 30-летнего возраста неуклонно понижается активность стероидогенеза (на 1–3% в год) и к 50 годам он уменьшается почти на 20% [14, 15]. Развитие СЛ в препубертатном периоде в большинстве случаев связано с низким содержанием эстрогенов и эстрогенной насыщенностью органов-мишеней [15]. Однако при развитии СЛ у детей в редких случаях возможен регресс патологических очагов, т. к. с возрастом уровень эстрадиола повышается [15, 16]. Особая роль в патогенезе СЛ отводится патологическому аутоиммунному процессу, развивающемуся в стенках мелких сосудов (капиллярит) и межуточном веществе соединительной ткани, в связи с высоким уровнем антигенной «коллагеновой» стимуляции [15–17].
Уменьшение активности фермента гиалуронидазы, накопление мукополисахаридов и прогрессирующая фибриноидная дегенерация соединительнотканных элементов в сочетании со спазмом сосудов вследствие накопления серотонина приводят к отечно-индуративным изменениям [2, 10, 15]. Запуск целого каскада аутоиммунных, сосудистых и обменных нарушений приводит к усиленному синтезу коллагена (I, III, IV и VII типов) и других компонентов экстрацеллюлярного матрикса, облитерации мелких сосудов, что клинически проявляется прогрессирующим атрофическим процессом тканей [15–17].
В целом ряде случаев поражение половых органов при СЛ может развиваться почти бессимптомно, особенно в начале заболевания [15]. Основными жалобами, предъявляемыми больными при неуклонном прогрессировании процесса, являются болезненность, парестезии, ощущение покалывания и «ползающих мурашек», умеренный зуд, а затем уплотнение тканей в зоне половых органов, выпадение волос и появление трещин. В процессе прогрессирования заболевания, наряду с нарастающими субъективными ощущениями, у больных появляется целый ряд других качественных симптомов. К ним относятся уринарный синдром, включающий персистирующие инфекции мочевыводящих путей, цистоуретрит [16], гастроинтестинальный синдром, проявляющийся болью при дефекации, хроническими запорами [17], и вульвовагинальный синдром, включающий диспареунию и целый спектр дисфункциональных сексуальных расстройств [16, 17].
Типичная клиническая картина СЛ представляет собой множество мелких (диаметром от 3 до 5 мм), четко контурированных участков атрофии, которые имеют тенденцию к слиянию. Элементы высыпаний могут быть рассеянными или сгруппированными. Постепенно их количество и размер увеличиваются, они сливаются и формируют обширные поля истонченного эпидермиса и атрофии, приводя к частичной редукции ткани. Окраска пораженной кожи белесоватая, с перламутровым или ливидным оттенком. Кожу трудно собрать в складку, на ней отсутствуют волосы, апокриновые и потовые железы также отсутствуют [15–18]. Прогрессирование склероатрофических изменений аногенитальной области у мужчин при локализации на коже полового члена, области ануса приводит к истончению крайней плоти, сужению и стриктуре уретры. Нередко развивается парафимоз, фимоз [18, 19]. Серьезным осложнением СЛ полового члена является плоскоклеточная карцинома, составляющая до 50% случаев рака соответствующей локализации [19, 20]. У женщин прогрессирование склероатрофических изменений аногенитальной области приводит к потере структуры вульвы и ее редукции. Вульва легко травмируется, возникает диспареуния. Складки половых губ уплощаются и сглаживаются, клитор и малые половые губы определить практически не удается (как и линию Гарта), из-за выраженного склероза тканей вход во влагалище сужается, уменьшаются размеры его преддверия и наружного отверстия мочеиспускательного канала. СЛ вульвы с хроническим гиперкератозом и эрозиями может осложниться плоскоклеточной карциномой [19–21].
Все эти явления, помимо неприятных субъективных ощущений, причиняют больным значительные моральные страдания и существенно снижают качество жизни, т. к. являются серьезным косметическим дефектом.
Важно также отметить, что пациенты с СЛ аногенитальной локализации наблюдаются в клиниках акушерско-гинекологического профиля, где данное заболевание воспринимается лишь как изолированное поражение гениталий, а не как форма ОС, требующая комплексного обследования и системного подхода к лечению.
Цель исследования: выявить частоту поражения аногенитальной зоны при основных клинических вариантах ОС, установить дифференциально-диагностические клинические критерии поражения аногенитальной области при ОС, усовершенствовать метод лечения с учетом аногенитальной локализации и оценить клиническую эффективность разработанного метода лечения.
Материал и методы
В клинике кожных и венерических болезней им. В.А. Рахманова за период с 2017 по 2019 г. нами было обследовано 104 больных с установленным диагнозом ОС (бляшечная склеродермия, линейная склеродермия, СЛ, атрофодермия Пазини — Пьерини). Из них 86 женщин (82,7%) и 18 мужчин (10,5%). По возрасту больные распределились следующим образом: от 20 до 30 лет — 18 человек (17,3%), от 31 года до 40 лет — 18 (17,3%), от 41 года до 50 лет — 13 (12,5%), от 51 года до 60 лет — 26 (25%), от 61 года до 70 лет — 23 (22,1%), от 71 года и старше — 6 (5,8%).
При проведении клинико-морфологического фенотипирования всех пациентов (n=104) нами были отобраны 62 пациента со склероатрофическими поражениями аногенитальной локализации.
Методика лечения
Курс комплексной терапии включает: инъекции бензилпенициллина в дозе 500 000 ЕД 4 р./сут внутримышечно (в/м) в течение 10 дней (курсовая доза 20 млн ЕД); пентоксифиллин в дозе 100 мг по 1 таблетке 3 р./сут в течение 1 мес.; бовгиалуронидаза азоксимер в виде вагинальных (для женщин) или ректальных (для мужчин) суппозиториев в дозировке 3000 МЕ 1 раз в 2 дня до курсовой дозы 30 тыс. МЕ; эстриол (крем вагинальный) — 1 аппликация (соответствующая 0,5 мг эстриола) 1 р./сут в течение 4 нед., затем 1 аппликация 2 р./нед. в течение 2 мес.; гель с бактериофагами Фагогин по 5–7 мл 3 р./сут в течение 1 мес.
Всем пациенткам со склероатрофическими поражениями аногенитальной зоны проводилось лечение: фракционным СО2-лазером (время облучения 220 мкс, флюенс 3,9 Дж/м2, расстояние между точками 70 мкм). На каждом сеансе было выполнено три прохода, при этом лазер был установлен на низкий уровень (10 Вт) 20 мДж/пиксель, 2 Гц на первом, втором и третьем сеансах и средний (30 Вт) 10 мДж/пиксель, 2 Гц на четвертом и пятом сеансах. Анестезия аппликационная (лидокаин+прилокаин). Время экспозиции составило 25 мин. Курс лечения составил от 3 до 5 сеансов с интервалом 30 дней.
В качестве наружной терапии склероатрофических поражений аногенитальной зоны у мужчин мы применяли бовгиалуронидазу азоксимер методом фонофореза. Курс лечения составил 10–12 процедур с кратностью 1–2 р./нед.
Результаты исследования
Больные с клиническим вариантом в виде бляшечной склеродермии составили 78 человек (75%), линейной склеродермией — 1 человек (0,9%), атрофодермией Пазини — Пьерини — 2 человека (1,9%), СЛ — 23 человека (22,2%).
Склероатрофические поражения аногенитальной локализации наблюдались у 40 больных бляшечной склеродермией (64,5%), у 21 больного СЛ (33,8%), у 1 больного линейной склеродермией (1,7%).
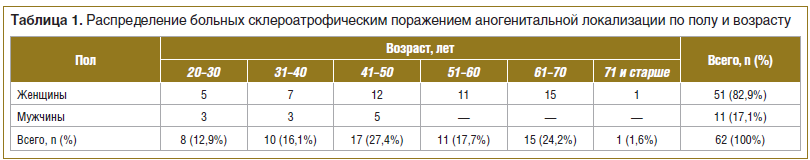
СЛ аногенитальной локализации наблюдался чаще у женщин — 82,9% (51 больная), чем у мужчин — 17,1% (11 больных). Основная группа больных с поражением половых органов встречается в возрастной медиане от 41 до 50 и от 61 до 70 лет, что соответствует периоду пре- и постменопаузы. Половозрастные особенности больных СЛ даны в таблице 1.
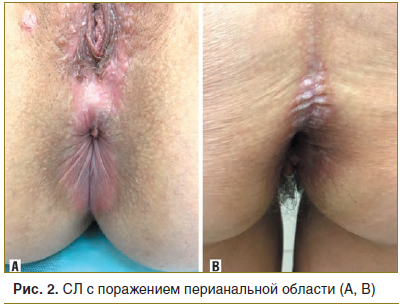
При анализе клинических особенностей распространенности склероатрофических поражений кожного покрова и слизистой половых органов нами установлено, что в 32,3% случаев склероатрофический процесс локализовался только в аногенитальной зоне, а в 67,7% случаев процесс носил сочетанный характер.
Так, согласно нашим данным, в 32,3% случаев (n=20) изолированное поражение аногенитальной локализации наблюдалось при склероатрофическом варианте ОС. При анализе сочетанных поражений кожи и аногенитальной зоны в 46,7% случаев (n=29) нами выявлены сочетание двух форм ОС: бляшечной формы на коже и СЛ аногенитальной зоны. В 19,4% случаев (n=12) нами выявлены сочетанные поражения СЛ кожи и аногенитальной зоны. В 1,7% случаев (n=1) очаги по типу СЛ в аногенитальной зоне сочетались с очагами поражения по типу линейной склеродермии на коже туловища.
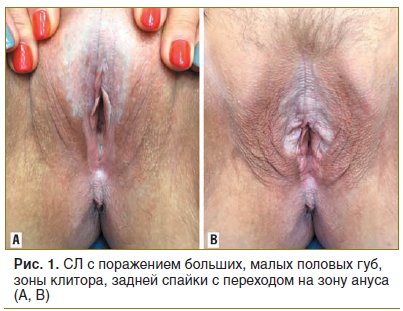
При проведении подробного анализа особенностей локализации склероатрофических поражений аногенитальной зоны у женщин (n=51) установлено, что поражение вульвы встречалось в 41 случае (80,4%), поражение клитора — в 36 (70,5%), поражение ткани промежности — в 38 (74,5%), поражение перианальной области в 24 (47%) (рис. 1, 2).
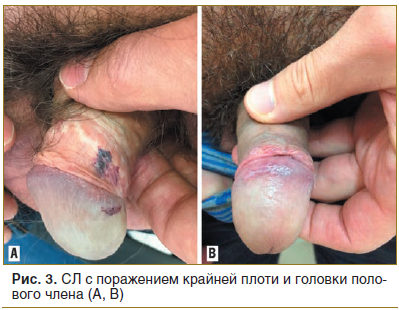
Анализ особенностей склероатрофических поражений у мужчин (n=11) показал склероатрофические поражения головки полового члена в 8 случаях (72,7%), поражение тканей уздечки — в 6 (54,5%), поражение кожи ствола полового члена — в 3 (27,3%), поражение перианальной области — в 4 случаях (36,4%) (рис. 3).
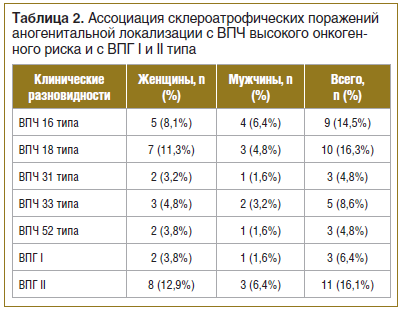
При анализе сопутствующей хронической патологии у исследуемых больных (n=62) нами установлено, что в 71% случаев (44 больных) выявлены ИППП и воспалительные заболевания малого таза, в 86,4% случаев (у 38 женщин) и в 17,1% случаев (у 6 мужчин). В 33,9% (21 больной) случаев обнаружены: ВПЧ высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68) и ВПГ I и II типа — у 16 женщин (25,8%) и 5 мужчин (8,1%) (табл. 2).
Склероатрофические поражения аногенитальной локализации сочетались с бактериальным вагинозом — в 27,4% случаев (17 больных), хламидиозом (Chlamydia trachomatis) — в 24,2% случаев (15 больных), трихомониазом (Trichomonas vaginalis) — в 17,7% случаев (11 больных), гонореей (Neisseria gonorrhoeae) — в 3,2% случаев (2 больных).
Склероатрофические поражения аногенитальной локализации сочетались с хронической персистирующей вирусной инфекцией: ВПГ II типа — в 16,1% случаев (11 больных), ВПГ I типа — в 6,4% случаев (3 больных) (см. табл. 2).
Также важно отметить, что наличие хронической персистирующей вирусной инфекции ВПЧ с высоким онкогенным потенциалом (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68) у пациентов с склероатрофическими поражениями половых органов вызывает значимый интерес ввиду высоких рисков развития злокачественной трансформации (см. табл. 2).
Нами проведен анализ сопутствующей хронической патологии у группы пациентов (n=62) с поражениями аногенитальной локализации. Большой интерес представляют заболевания органов малого таза, которые были выявлены в 40,3% случаев (n=25): миома матки — у 12 женщин, сальпингоофорит — у 5 женщин, сальпингит — у 3 женщин, цистит — у 2 женщин; простатит выявлен у 2 мужчин, аденома простаты — у 1.
Кроме того, была выявлена хроническая очаговая инфекция различной локализации в 27,4% случаев (n=17): у женщин — ринит у 5, хронический тонзиллит — у 3, хронический фарингит — у 3; у мужчин: ринит — у 3, хронический тонзиллит — у 2, хронический фарингит — у 1. Заболевания сердечно-сосудистой системы выявлены в 19,4% случаев (n=12): у женщин — артериальная гипертензия у 7, аритмия у 1; у мужчин — артериальная гипертензия у 3, сердечная недостаточность — у 1. Патология желудочно-кишечного тракта и гепатобилиарной системы встречалась в 3,2% случаев (n=2): у женщин — гастрит у 1, дискинезия желчного пузыря — у 1. Патология не выявлена в 9,7% случаев (n=6).
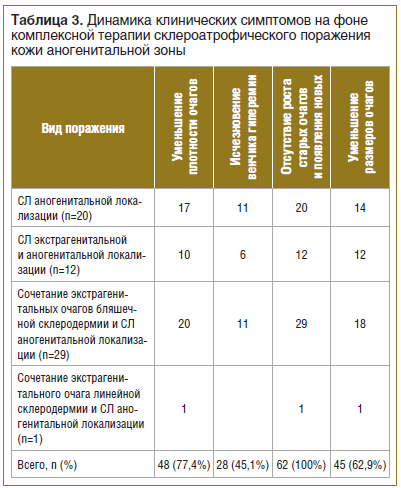
Эффективность курса проведенной терапии оценивали по положительной динамике кожного процесса: уменьшению плотности очагов, исчезновению или побледнению венчика гиперемии, отсутствию роста старых очагов и появления новых, уменьшению размеров старых очагов, уменьшению субъективных ощущений.
После первого курса комплексной терапии следовал перерыв в 1,5–2,0 мес., после которого проводился следующий курс комплексной терапии. При отсутствии и/или незначительности изменений после проведенного курса терапии больным назначался повторный курс (максимальное количество курсов не превышало 5).
Так, из 62 пациентов с ОС и поражением аногенитальной зоны основному количеству больных — 56,5% (35 человек) потребовалось 3 курса комплексной терапии, 16,1% (10 человек) — 4 курса, 11,3% (7 человек) — 2 курса, 6,4% (4 человека) — 1 курс и 8,1% (5 человек) — 5 курсов для полной стабилизации процесса.
На фоне проведенной комплексной терапии уменьшение плотности очагов наблюдалось у 48 (77,4%) больных, побледнение венчика гиперемии — у 28 (45,1%) больных. Отсутствие роста старых очагов и появления новых отмечено у 62 (100%) больных, уменьшение размеров очагов — у 39 (72,6%) больных (табл. 3).
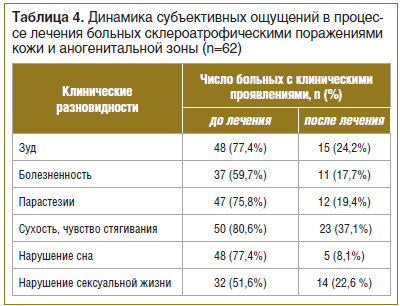
Анализ динамики субъективных ощущений показал положительную тенденцию их уменьшения. Так, до лечения зуд аногенитальной области встречался в 77,4% случаев, после проведения комплексного лечения — в 24,2% случаев. Болезненные ощущения в очагах поражения до лечения наблюдались в 59,7% случаев, после лечения — в 17,7%. Парестезии до лечения наблюдались в 75,8% случаев, после лечения — лишь в 19,4% случаев. Чувство стягивания и сухость до лечения наблюдались в 80,6% случаев, после лечения — в 37,1%. Нарушения сна до лечения определялось в 77,4% случаев, после лечения — лишь в 8,1%. Нарушение сексуальной жизни до лечения встречалось в 51,6% случаев, после лечения — в 22,6% случаев (табл. 4).
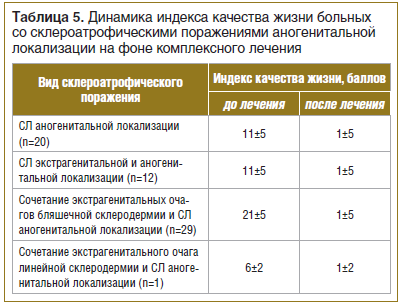
Всем больным (n=62) для оценки степени негативного влияния кожного заболевания на различные аспекты их жизни (отношения в семье с родственниками, с друзьями, коллегами по работе, занятия спортом, сексом, социальная активность и т. д.) был предложен опросник дерматологического индекса качества жизни (ДИКЖ) до и после лечения. После проведения комплексного курса лечения отмечено значительное повышение ДИКЖ у всех больных со склероатрофическими поражениями аногенитальной области (табл. 5).
Заключение
Нами впервые выявлена частота встречаемости СЛ аногенитальной локализации в структуре ОС, которая составила 59,6%.
Выявлена и проанализирована связь аногенитального СЛ с этиологическими факторами заболевания: в 71% случаев выявлены ИППП и воспалительные заболевания малого таза; в 33,8% случаев — ВПЧ высокого канцерогенного риска, ВПГ I и II типа; в 19,3% случаев — хронические воспалительные заболевания органов малого таза; в 27,4% случаев — хроническая очаговая инфекция различной локализации; в 19,4% случаев — заболевания сердечно-сосудистой системы; в 3,2% случаев — патология желудочно-кишечного тракта и гепатобилиарной системы.
Нами был оптимизирован протокол комплексного метода лечения ОС, включая склероатрофические поражения аногенитальной локализации. Протокол может быть рекомендован для усовершенствования лечения пациентов с данной патологией в связи с его высокой клинической эффективностью, достигающей 98%.
Информация с rmj.ru