Введение
Гипермеланозы, или меланодермии, — группа заболеваний, сопровождающихся нарушениями меланинового обмена и формированием косметических дефектов внешности, оказывающих влияние на социальную, семейную и профессиональную жизнь пациентов.
Несмотря на разнообразие существующих методов терапии, лечение нарушений меланогенеза остается сложной задачей. Применение технологий, направленных на разрушение меланина (высокоинтенсивные световые и лазерные методики) или ускоряющих его десквамацию в составе кератиноцитов (пилинги) в случае неконтролируемого усиления воспаления приводят к развитию ятрогенных осложнений, сопровождающихся усилением пигментации и появлением новых очагов [1].
Большое значение имеет проведение диагностического обследования перед началом терапии гипермеланоза. Это позволяет уточнить диагноз, оценить выраженность воспаления, сосудистую реакцию и глубину залегания пигмента, провести дифференциальный диагноз с опухолевыми пигментными заболеваниями. Учитывая рост заболеваемости меланомой кожи, актуальна проблема ранней диагностики врачами-косметологами, к которым первично обращаются пациенты.
Подходы к лечению гипермеланозов
Патогенетическая терапия включает ингибирование синтеза меланина, уменьшение переноса меланосом от меланоцитов к кератиноцитам, ускорение эпидермальной кинетики для удаления гранул меланина в составе кератиноцинов и разрушение избыточно образованного меланина. Солнцезащитные средства широкого спектра действия являются обязательным компонентом лечения меланодермии, но они не предотвращают рецидивы.
В качестве терапии первой линии широко применяются топические средства, включая гидрохинон, ретиноиды, тиамидол, кислоты и экстракты растений. Часто используется сочетание препаратов, включающих гидрохинон, ретинол и гормональные средства, в виде двойной или тройной комбинации. В таблице представлен обзор основных топических средств, применяемых для лечения гиперпигментации, с описанием их механизмов действия и наиболее частых побочных эффектов [1]. Ко второй линии терапии относится применение химических пилингов, аппаратных и инъекционных технологий.
В настоящее время в протоколы лечения гипермеланозов включают препараты, содержащие транексамовую кислоту (ТК) [2–5], c целью повышения эффективности терапии и снижения вероятности рецидивов для предотвращения активации меланоцитов и уменьшения воспаления за счет ингибирования системы активации плазминогена.
Транексамовая кислота — это антифибринолитическое средство, синтетическое производное аминокислоты лизина, основное назначение которого — уменьшать кровотечение, подавляя превращение плазминогена в плазмин, участвующий в расщеплении фибрина. Она широко используется в хирургической практике, травматологии, стоматологии, акушерстве и гинекологии [6]. Помимо антифибринолитического эффекта, ТК обладает противовоспалительными свойствами и способностью подавлять меланогенез [7].
Транексамовая кислота подавляет вызванную ультрафиолетовым (УФ) излучением активность плазмина в кератиноцитах, блокируя взаимодействие меланоцитов и кератиноцитов за счет ингибирования системы плазминоген/плазмин. Блокируя УФ-индуцированную активность плазминогена в кератиноцитах, ТК нарушает взаимодействия меланоцит — кератиноцит, уменьшая синтез факторов воспаления, таких как свободная арахидоновая кислота и ее метаболиты, простагландинов и снижает выработку меланина [8].
По своей структуре ТК похожа на тирозиназу и может нарушать каталитическую активность этого фермента в метаболизме тирозина за счет конкурентного антагонизма [7]. Она подавляет выработку прогормонконвертазы (PC2), фермента, ответственного за первый этап созревания многих нейроэндокринных пептидов из их предшественников. Она расщепляет проопиомеланокортин и уменьшает выработку α-меланоцитстимулирующего гормона в гипофизе, таким образом ингибируя активацию меланоцитов кожи. ТК уменьшает стимуляцию эпидермальных меланоцитов человека простагландином E2 (PGE2), снижает высвобождение кератиноцитами эндотелина-1, активатора гена MITF, необходимого для дифференцировки и функционирования меланоцитов, уменьшает дендритность меланоцитов и перенос меланосом, снижает уровень белка тирозиназы и родственного тирозиназе белка TRP-1 и TRP-2 в меланоцитах, активирует систему аутофагии, разнонаправленно подавляя меланогенез. Повышая уровень Rab5b, мономерного G-белка, определяющего распределение меланоцитов, ТК способствует их кластерному распределению, тем самым уменьшая пигментацию кожи [9].
Являясь ингибитором плазминогена, транексамовая кислота подавляет ангиогенез за счет снижения экспрессии опосредованного плазмином фактора роста эндотелия сосудов (VEGF), снижает неоваскуляризацию, вызванную базовым фактором роста фибробластов (bFGF) и VEGF165, а также избыточную экспрессию и активацию рецепторов VEGF [9].
В экспериментах на животных ТК снижает уровни провоспалительных цитокинов IL-1β, IL-6, TNF-α и медиатора воспаления PGE2 и повышает уровни противовоспалительного цитокина IL-10. Она снижает пролиферацию тучных клеток и ингибирует выработку вторичного липидного медиатора, препятствуя привлечению нейтрофилов [9].
За счет ингибирования трансмембранной сериновой протеазы 2 (TMPRSS2) и снижения активности рецептора PAR2, участвующего в воспалительной реакции кожи и влияющего на дифференцировку, увеличивается приток кальция в кератиноциты, что приводит к восстановлению функции эпидермального барьера. Было обнаружено, что местное введение 5% ТК значительно ускоряет регенерацию поврежденного физико-химическими факторами кожного барьера и увеличивает среднее значение оптической плотности белка плотного соединения окклюдина [10].
Транексамовую кислоту при гипермеланозах можно применять различными способами, включая пероральный прием, местное и внутрикожное введение, а также в сочетании с другими методами лечения [5, 7, 11]. Пероральный прием ТК для пациентов с мелазмой рекомендуется в дозе от 250 до 1500 мг/сут 1–2 р/день [12]. Оптимальная доза составляет 250 мг 3 р/день в течение 12 нед., но возможно двукратное применение 250 мг 2 р/день для пациентов с низкой приверженностью лечению [12, 13]. Согласно данным, полученным T. Lam et al. [13], для пациентов с меланодермией оптимальным будет ежедневная пероральная доза 500–750 мг в течение 12 нед. Для топического и внутрикожного введения применяется ТК в концентрации 2–10% [9].
Большое число публикаций посвящено вопросам перорального приема ТК с целью лечения и профилактики гипермеланозов, возникших после использования высокоинтенсивных световых и лазерных методик [7]. Пероральный прием ТК является многообещающим методом лечения различных видов меланодермии, устойчивых к местному лечению. Однако для определения их эффективности при лечении различных видов гиперпигментации необходимы дополнительные данные, полученные в ходе слепых рандомизированных контролируемых исследований и исследований методом «случай — контроль» [14]. Чаще пероральный прием рекомендуется для лечения рефрактерных форм меланодермии или в составе комбинированных протоколов [2, 3]. Учитывая возможные серьезные риски перорального приема ТК, такие как инсульт и тромбоэмболия, ряд исследователей рекомендуют другие способы ее введения — местное, внутрикожное или при помощи микронидлинга [4].
Применение ТК для профилактики поствоспалительной гиперпигментации (ПВГ) представляет противоречивые данные. Ряд исследований показывает, что пероральный прием, начатый в первый день после лазерного лечения, не эффективен для профилактики ПВГ после лечения лазером QS 532-нм Nd:YAG [15]. Однако имеются данные, что пероральный прием ТК ускоряет исчезновение ПВГ, если его продолжать в течение 6 нед. после лечения [2, 3].
В исследовании M. Minasyan et al. [16] изучалась эффективность перорального приема ТК при лечении ПВГ и ее применение для профилактики ПВГ в сочетании с другими методами лечения. Все исследования продемонстрировали значительное улучшение состояния при ПВГ.
Ряд авторов указывают на высокую эффективность внутридермального применения ТК с целью лечения гипермеланозов [17], позволяющего обеспечить необходимую эффективность и безопасность проводимой терапии. Интрадермальные инъекции и микронидлинг с применением ТК в качестве местного средства оказались эффективными альтернативами пероральному лечению [18]. Также было обнаружено, что ее местное применение переносится лучше, чем гидрохинон [17].
Наиболее распространенными побочными реакциями при системном применении ТК являются расстройство со стороны желудочно-кишечного тракта, гипоменорея или нерегулярные менструации. Кроме того, сообщалось о тромбозе, повышенной чувствительности к препарату, нарушениях функции печени и почек, головной боли, головокружении, помутнении зрения, инсульте, эпилепсии, нарушениях цветовосприятия, ухудшении зрения, учащенном сердцебиении, гипопигментации, тревожности, депрессии, сонливости и бессоннице [10].
Противопоказаниями к пероральному приему являются: непереносимость ТК, нарушение цветового зрения, текущая антикоагулянтная терапия, активная тромбоэмболическая болезнь или венозная или артериальная тромбоэмболия в анамнезе, тяжелая почечная недостаточность, беременность и лактация, прием оральных контрацептивов [5, 6].
Побочные эффекты внутрикожных инъекций и микронидлинга ТК в основном включают боль, раздражение, жжение, кровотечение, легкую эритему, зуд, шелушение, петехии, которые носят временный характер [7]. Местные способы применения безопасны, и о побочных реакциях сообщается редко.
Аппаратные методы лечения пигментации относятся ко второй, а рядом авторов даже к третьей линии терапии и рекомендуются после применения топических и инъекционных методов. В последние годы был накоплен значительный опыт в применении лазерных и световых технологий для коррекции гиперпигментации. Известно, что участки гиперпигментации обладают специфическими тепловыми и поглощающими свойствами, что позволяет осуществлять целенаправленное воздействие на эти области. Однако использование аппаратных методов может усиливать воспалительные реакции и, в некоторых случаях, активировать меланогенез, что приводит к нежелательным эффектам.
Одним из перспективных методов лечения является фракционное инвазивное радиочастотное (radio frequency, RF) воздействие, которое не зависит от количества хромофора и может безопасно применяться для пациентов с любым фототипом кожи при соблюдении рекомендаций в любое время года. Это особенно важно для лечения гипермеланозов при темном фототипе кожи.
Радиочастотная энергия представляет собой высокочастотный переменный ток, который генерируется электромагнитным излучением с частотами в диапазоне от 3 кГц до 300 МГц. Когда этот ток проходит через ткани, он сталкивается с их сопротивлением, известным как импеданс, что вызывает высокочастотные колебания молекул воды в дерме и, как следствие, выделение тепла. Количество выделяемого тепла можно рассчитать с помощью формулы закона Джоуля:
Энергия (Дж) = I2 × R × T,
где I — ток, R — сопротивление ткани, T — время применения.
Это уравнение демонстрирует, что количество энергии, поступающей в ткань, прямо пропорционально импедансу, величине тока и времени его приложения. Таким образом, ткани с высоким импедансом, такие как подкожная жировая клетчатка, генерируют больше тепла и способствуют глубоким дермальным эффектам, возникающим при использовании RF-устройств.
Кожа является неоднородной структурой, поверхность которой содержит потовые железы, заполненные потом в различной степени. Сопротивление сухой и влажной кожи существенно различается. Сухой роговой слой практически не проводит электрический ток, что характеризуется более высоким сопротивлением по сравнению с влажным роговым слоем. Чем выше сопротивление, тем более длительный импульс необходим для получения эффекта [19].
На сегодняшний день в мире существует большое число RF-аппаратов, которые можно разделить на инвазивные и неинвазивные. Неинвазивные RF-аппараты доставляют RF-энергию без повреждения кожи через контактный гель, обеспечивают равномерный прогрев тканей без зон коагуляции. Инвазивные RF-аппараты имеют иглы-электроды и доставляют энергию вглубь кожи посредством повреждения.
По конфигурации электрода RF-аппараты делятся на монополярные и биполярные устройства. В монополярных RF-приборах активный электрод — это иглы, которые находятся непосредственно в манипуле, и пассивный (нейтральный) электрод, который крепится на тело пациента. В биполярных аппаратах замыкание цепи происходит между самими иглами.
В инвазивных RF-аппаратах энергия доставляется путем использования специального игольчатого аппликатора, обеспечивающего проникновение игл в кожу, для создания микротермальных зон (МТЗ). Участки неповрежденной кожи вокруг МТЗ способствуют более быстрой реабилитации, а сами МТЗ могут служить каналом для трансдермальной доставки веществ [20, 21].
![Таблица. Топические средства для лечения гипермеланозов: механизм действия и побочные эффекты [1] Table. Topical preparations for the treatment of hypermelanosis: mechanism of action and side effects [1] Таблица. Топические средства для лечения гипермеланозов: механизм действия и побочные эффекты [1] Table. Topical preparations for the treatment of hypermelanosis: mechanism of action and side effects [1]](https://medblog.su/wp-content/uploads/2025/08/Fraktsionnyj-RF-lifting-i-traneksamovaya-kislota-v-lechenii-gipermelanozov-Bychkova.png)
На сегодняшний день представлены аппараты с разными типами игл: изолированные и неизолированные. Изолированные иглы имеют изоляционное покрытие на всей своей длине, кроме кончика иглы, что обеспечивает прогрев тканей на глубине, без прогрева эпидермиса. Изолированные иглы важны при работе с пациентами, которые склонны к ПВГ.
Согласно данным литературы, игольчатый RF-лифтинг может быть эффективным методом лечения пигментации. В процессе старения в областях гиперпигментации происходит накопление малоактивных фибробластов. Эти измененные фибробласты влияют на дифференцировку и миграцию меланоцитов через стромально-эпителиальные взаимодействия, что приводит к подавлению стромального фактора роста 1 (SDF1), играющего ключевую роль в миграции меланоцитов и усилении пигментации. В настоящее время этот гомеостатический цитокин, являющийся хемоаттрактантом для меланоцитов, рассматривается как один из ключевых регуляторов гиперпигментации, вызванной УФ-излучением. Научные исследования показывают, что нормальные фибробласты способствуют секреции SDF1, который ингибирует меланогенез. Воздействие высокочастотной энергией способствует обновлению пула фибробластов и тем самым усиливает секрецию SDF1 и приводит к ингибированию меланогенеза. Также известно, что воздействие манипулы фракционного RF-аппарата приводит к формированию микроканалов, которые способствуют трансдермальной доставке топических средств, в том числе применяемых для лечения пигментации [22–24].
Наш опыт показывает эффективность сочетанного применения раствора ТК 50 мг/мл и технологии монополярного фракционного RF-воздействия с помощью аппарата Exion (компания BTL Industries Ltd., United Kingdom), оснащенного системой искусственного интеллекта, обеспечивающей равномерную микроабляцию и снижающей вероятность развития осложнений.
Аппарат Exion имеет частоту RF-воздействия 1 мГц и оснащен двумя типами насадок — изолированными и неизолированными иглами, что облегчает задачу в подборе протокола процедуры пациентам с различными фототипами и вариантами дисхромий. Насадки аппарата Exion оснащены 36 иглами с толщиной 0,25 мм и максимальной глубиной воздействия до 3,5 мм в обычном режиме и до 7,5 мм в расширенном режиме при работе с телом. Уникальная комбинация монополярной радиочастоты и системы подачи энергии с помощью искусственного интеллекта позволяет получить хорошие результаты с минимальным риском нежелательных явлений. Во время выполнения процедуры аппарат Exion измеряет импеданс кожи пациента и автоматически выбирает длину импульса от 30 до 550 мс в разных режимах работы аппарата, в зависимости от параметров сопротивления кожи пациента в обрабатываемом участке с максимальным уровнем энергии до 110 мДж на иглу.
В качестве иллюстрации эффективности сочетанного подхода в лечении пациентки с гипермеланозом приводим клиническое наблюдение (согласие на публикацию получено).
Содержание статьи
Клиническое наблюдение
Пациентка, 1977 года рождения, обратилась с жалобами на участки гиперпигментации в области щек. Впервые появление темных пятен отметила 2 года назад. Что именно спровоцировало появление пигментации, пациентка не знает. В течение этого времени проводились косметологические процедуры, включая лечение на пикосекундном лазере, но эффект терапии был кратковременным и неполным, очаги светлели, но спустя непродолжительное время пигментация снова усиливалась.
На основании клинико-анамнестических и инструментальных данных (Antera 3D и лампа Вуда) был поставлен диагноз: мелазма смешанного типа, неясного генеза.
Анамнез жизни: соматически здорова.
Косметологический анамнез: применялись дерматологические пилинги, топические средства, влияющие на меланогенез, фотопротекторы. Однократно проводилась процедура на пикосекундном лазере за 9 мес. до обращения в клинику.
Status localis: фототип IV по Фицпатрику. Кожа в области скул имеет симметричные участки гиперпигментации, представленные темно-коричневыми пятнами. Пигментация диффузная, без четкого контура, покрывает полностью скуловую область. В дополнение к гиперпигментации наблюдается легкая гиперемия. До лечения тяжесть мелазмы по шкале оценки mMASI соответствовала оценке 7,6 (при максимально возможном значении 24), индекс MSS до лечения — 3.
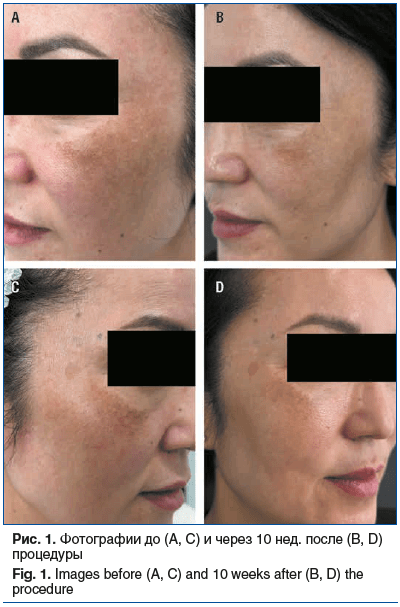
Для исключения сопутствующей патологии проведено обследование терапевтом, эндокринологом и гинекологом. Отклонений в результатах оценки соматического статуса и лабораторных исследованиях не выявлено. Перед началом терапии выполнены фотодокументирование (рис. 1, A, C) и визуализация поверхности кожи с системой полиспектрального анализа (Antera 3D).
Протокол лечения включал в себя следующую комбинацию: однократная процедура игольчатого RF-лифтинга на аппарате Exion: изолированные иглы, уровень энергии 20–30% (~40–50 мДж), длина импульса от 30 до 110 мс в зависимости от импеданса кожи, глубина 0,5–1,0 мм, однократный проход, без использования топических анестетиков. Изолированные иглы выбраны с целью защиты эпидермиса от теплового воздействия, чтобы снизить риски развития ПВГ. Сразу после процедуры был нанесен раствор ТК 50 мг/мл 5 мл с целью регуляции меланогенеза.
Пациентка перенесла процедуру удовлетворительно. Во время проведения игольчатого RF-лифтинга пациентка испытывала незначительные болевые ощущения, соответствовавшие оценке 3–4 балла по визуально-аналоговой шкале. После топического нанесения ТК кратковременно усилилось жжение. В период реабилитации пациентка использовала реэпитализанты 14 дней и фотопротектор широкого спектра действия, который был назначен на постоянной основе для ежедневного применения. Также был назначен пероральный прием ТК в дозе 250 мг 2 р/сут в течение 1 мес. с учетом отсутствия противопоказаний к пероральному приему. Нежелательные явления во время процедуры или в период реабилитации не зарегистрированы.
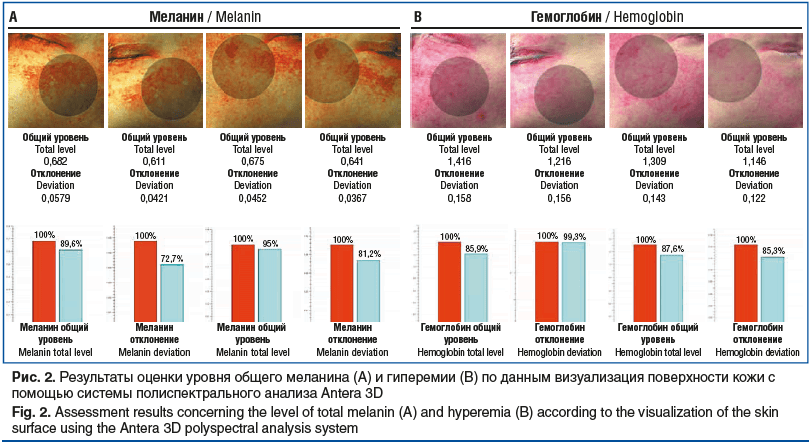
По данным фотографирования (рис. 1, B, D) и Antera 3D-мониторинга через 10 нед. после процедуры по сравнению с исходными данными получены следующие данные: выявлено снижение уровня общего меланина на 10,4% слева и на 5% справа (рис. 2, A). Игольчатый RF-лифтинг также положительно сказался на выраженности гиперемии: снижение произошло на 14,1% слева и 12,4% справа (рис. 2, B), вероятно за счет коагуляции поверхностных сосудов. По шкале оценки тяжести мелазмы mMASI после проведенного лечения получен результат 5,2 балла (снижение на 2,4 балла).
После достижения положительных результатов лечения планируется продолжение курса из 3 процедур комбинированного протокола с использованием аппарата игольчатого RF-лифтинга Exion вместе с топическим нанесением ТК для улучшения достигнутых результатов.
Обсуждение
Наш клинический опыт совместного применения игольчатого RF-лифтинга на аппарате Exion и топического применения ТК в настоящее время представляет большой практический интерес, что обусловлено увеличением распространенности гипермеланозов в популяции и активным развитием аппаратных технологий, используемых для коррекции этих состояний. Сложность лечения пациентки в представленном наблюдении заключается в темном фототипе кожи пациентки и резистентном варианте течения мелазмы, что осложняет выбор терапии. Использованный сочетанный протокол лечения дает возможность провести эффективное лечение меланодермии и снизить вероятность рецидива. В условиях растущего спроса на эффективные и безопасные методы коррекции дисхромий, комбинированные протоколы лечения становятся все более актуальными.
Заключение
Лечение гипермеланозов остается сложной задачей, требующей тщательной диагностики и индивидуального подхода к каждому пациенту. Ошибка при выборе методики может привести к ятрогенным осложнениям и усугублению пигментации. Действия, направленные на ингибирование синтеза меланина и ускорение эпидермальной кинетики, показывают свою эффективность. Топические препараты и химические пилинги остаются важными компонентами лечения гипермеланозов. Включение ТК в протоколы терапии значительно повышает эффективность лечения и снижает риск рецидивов, что делает ее важным средством в борьбе с гиперпигментацией.
Игольчатый RF-лифтинг на аппарате Exion обеспечивает целенаправленное воздействие на ткани, минимизируя риск ПВГ за счет встроенного искусственного интеллекта и измерения импеданса кожи. Это позволяет разрушать меланосомы и обновить базальную мембрану, что способствует уменьшению проявлений пигментации. Образование МТЗ после фракционного RF-воздействия обеспечивает эффективную интрадермальную доставку препаратов, что повышает эффективность процедуры.
Таким образом, сочетание игольчатого RF-лифтинга, выполненного на аппарате Exion (компания BTL Industries Ltd., United Kingdom), с применением ТК представляет собой перспективный и эффективный подход в терапии гиперпигментации, способствующий как улучшению состояния кожи, так и снижению вероятности рецидивов.
Сведения об авторах:
Бычкова Наталья Юрьевна — к.м.н., врач дерматолог, косметолог, доцент, доцент кафедры дерматовенерологии и косметологии с курсом клинической и лабораторной диагностики МБУ ИНО ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России; 123182, Россия, г. Москва, ул. Живописная, д. 46; доцент кафедры дерматовенерологии, аллергологии и косметологии Медицинского института Российского университета дружбы народов; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 6; ORCID iD 0000-0002-8248-084X
Лемытская Валентина Евгеньевна — врач дерматовенеролог, косметолог, невролог, руководитель клинического отдела компании «BTL Russia»; 125284, Россия, г. Москва, Ленинградский пр-т, д. 35, стр. 2, пом. XVIII; ORCID iD 0000-0001-5039-4691
Контактная информация: Лемытская Валентина Евгеньевна, e-mail: lemytskayav@btlnet.com
Источник финансирования: статья подготовлена при поддержке компании «BTL Russia».
Конфликт интересов: В.Е. Лемытская является сотрудником компании «BTL Russia», второй автор заявляет об отсутствии конфликта интересов.
Статья поступила 10.06.2025.
Поступила после рецензирования 21.06.2025.
Принята в печать 28.06.2025.
About the authors:
Natalia Yu. Bychkova — C. Sc. (Med.), dermatologist, cosmetologist, Associate Professor of the Department of Dermatovenerology and Cosmetology with a course in clinical and laboratory diagnostics of the Medical and Biological University of Innovation and Continuous Education, State Research Center — Burnasyan Federal Medical Biophysical Center of Federal Medical Biological Agency; 46, Zhivopisnaya str., Moscow, 123182, Russian Federation; Associate Professor the Department of Dermatovenereology, Allergology and Cosmetology of the Medical Institute, RUDN University; 6, Miklukho-Maklaya str., Moscow, 117198, Russian Federation; ORCID iD 0000-0002-8248-084X
Valentina E. Lemytskaya — dermatovenerologist, cosmetologist, neurologist, Head of the Clinical Department of BTL Russia; 35 build. 2, room. XVIII, Leningradsky Avenue, Moscow, 125284, Russian Federation; ORCID iD 0000-0001-5039-4691
Financial Disclosure: the publication was supported of BTL Russia.
Conflict of interest: V.E. Lemytskaya is an employee of BTL Russia. The second author declares no conflicts of interest.
Received 10.06.2025.
Revised 21.06.2025.
Accepted 28.06.2025.
Информация с rmj.ru




