Введение
Колоректальный рак (КРР) сегодня является третьим по частоте выявления онкологическим заболеванием и находится на втором месте среди причин смертности от злокачественных новообразований [1]. По данным Global Cancer Observatory, на долю КРР пришлось 9,4% от всех случаев онкологической смертности, т. е. практически каждый десятый пациент в мире умер именно от КРР, а темпы роста заболеваемости в 2020 г. были на 10% выше по сравнению с другими злокачественными новообразованиями [2].
Эпидемиологическая ситуация с КРР в России также вызывает опасения. За последние 10 лет отмечается увеличение темпов прироста заболеваемости КРР приблизительно на 2%.
В России в 2023 г. медиана показателя заболеваемости (на 100 тыс. населения, грубый показатель) новообразованиями ободочной кишки составила 32,56 (прирост заболеваемости за 10 лет — 24,2%), прямой кишки и ректосигмоидного соединения — 22,61 (10-летний прирост заболеваемости — 16%), при этом медиана смертности (на 100 тыс. населения, грубый показатель) составляет 14,52 для новообразований ободочной кишки и 9,84 для опухолей прямой кишки и ректосигмоидного соединения — по этому показателю КРР занимает третье место после ЗНО легкого и желудка. При этом 25% впервые выявленных в 2024 г. случаев КРР являются метастатическими, а летальность на первом году жизни составляет 20,2%. Что касается диагностики новообразований визуальных локализаций, то в 2024 г. также отмечены высокие показатели запущенности — 53,7% новообразований прямой кишки выявлены на III–IV стадиях (рис. 1, 2) [3, 4].
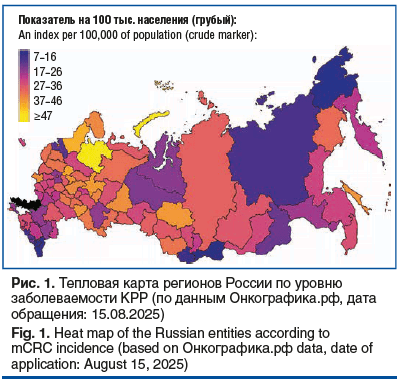
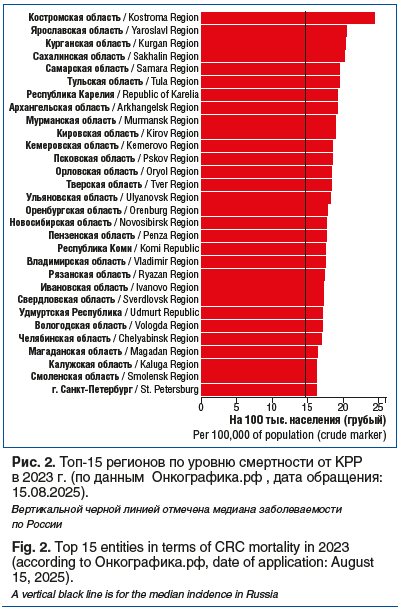
Таким образом, проблемы раннего выявления и лечения КРР остаются крайне актуальными для всех регионов России, а, исходя из эпидемиологической обстановки (частота выявления КРР IV стадии и показатели одногодичной летальности), лечение метастатического КРР (мКРР) требует особого внимания и информированности врачей-онкологов в подавляющем большинстве регионов России.
Фенотипическая картина мКРР весьма гетерогенна [3], с большой частотой мутаций в генах молекулярного каскада MAPK (mitogen-activated protein kinase), включая NRAS (neuroblastoma ras viral oncogene homolog) и KRAS (Kirsten rat sarcoma 2 viral oncogene homolog), наблюдаемые в половине новых случаев КРР, и мутации в гене BRAF (v-raf murine sarcoma viral oncogene homolog B1), наблюдаемые приблизительно в 8–10% случаев. Выявление этих онкомаркеров, наряду с HER2 и микросателлитной нестабильностью (MSI), влияет на выбор терапии при мКРР [5].
Мутации в протоонкогене BRAF часто ассоциированы с развитием довольно характерного подтипа КРР с заменой аминокислоты валин (V600E) на глутаминовую кислоту в результате трансверсии T1799A в 15-м экзоне, что является наиболее распространенной мутацией в гене BRAF. Мутация BRAFV600E встречается чаще при правосторонней локализации КРР, чаще у женщин и в более пожилом возрасте. Мутация BRAFV600E, как правило, характерна для муцинозного гистологического типа опухоли, часто ассоциирована с наличием нарушений в системе репарации ДНК, а также чаще выявляется на поздних стадиях рака и у пациентов с высокой опухолевой нагрузкой [6]. Мутация BRAF вызывает постоянную активацию MAPK-сигнального каскада, что приводит к значительному повышению активности процессов пролиферации, ингибированию апоптоза и повышению жизнеспособности опухолевых клеток. Эффективность стандартной химиотерапии при КРР с мутацией BRAFV600E значительно ниже, чем при КРР с мутацией BRAF дикого типа [6].
В 2021 г. группа российских ученых провела многоцентровое эпидемиологическое исследование, целью которого было определить частоту встречаемости мутации BRAF при КРР в Российской Федерации и ее влияние на прогноз течения заболевания. Согласно результатам исследования частота встречаемости мутации BRAF в России ниже, чем во всем мире, и составляет 5,2%, что, по-видимому, обусловлено особенностями питания в нашей стране. У 97% пациентов была выявлена мутация BRAFV600E, у 11% — сопутствующая MSI. Мутация BRAF была больше характерна для опухолей как ободочной, так и прямой кишки и являлась прогностическим маркером плохого прогноза для пациентов [7].
Хотя наличие мутации BRAFV600E является признаком неблагоприятного прогноза, данная мутация также представляет собой терапевтическую мишень для оптимизации лечения с использованием таргетной терапии. BRAF-ингибиторы продемонстрировали высокую клиническую эффективность в отношении опухолей с мутацией BRAFV600E, таких как немелкоклеточный рак легкого и меланома [8, 9]. На основании результатов самого крупного исследования III фазы среди пациентов с мКРР с мутацией BRAF — исследования BEACON с 2020 г. комбинированная терапия BRAF-ингибитором энкорафенибом и ингибитором эпидермального фактора роста (EGFR) цетуксимабом включена в международные клинические рекомендации ESMO и ASCO для применения у взрослых пациентов с мКРР с мутацией BRAFV600E во 2-й и последующих линиях терапии1 [10, 11]. В исследовании BEACON комбинация энкорафениба и цетуксимаба продемонстрировала достоверное улучшение ответа на терапию и увеличение общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП) по сравнению с контрольной группой (р<0,01) — медиана ВБП составила 4,3 мес., медиана ОВ — 9,3 мес., частота объективного ответа — 20% [12]. Комбинация энкорафениб и цетуксимаб — это первая и единственная на сегодняшний день зарегистрированная таргетная терапия для лечения взрослых пациентов с мКРР с мутацией BRAFV600E после предшествующей системной терапии.
Ключевая роль молекулярно-генетического тестирования на наличие мутаций BRAF в момент постановки диагноза мКРР была подчеркнута как в национальных, так и в международных рекомендациях1,2,3 [10, 11]. Российские клинические рекомендации также указывают на необходимость выполнять молекулярно-генетическое исследование для выявления мутаций в генах KRAS, NRAS (с указанием мутации — приложение A4), BRAF и определение MSI в биопсийном (операционном) материале методом ПЦР или иммуногистохимическое исследование для выявления дефицита белков системы репарации неспаренных оснований, экспрессии или амплификации HER22,3.
Несмотря на столь большое клиническое значение молекулярно-генетического тестирования мутаций в гене BRAF у больных мКРР, доступность, объем и сроки проведения тестирования могут отличаться в разных регионах РФ.
Цель исследования: оценить доступность, объем и сроки проведения молекулярно-генетического тестирования при мКРР в России в условиях рутинной клинической практики.
Содержание статьи
Материал и методы
С целью оценки особенностей назначения тестирования онкологами в условиях реальной клинической практики в разных регионах России был инициирован анонимный социологический онлайн-опрос врачей-онкологов и заведующих отделениями/лабораториями.
Вопросы для социологического исследования были опубликованы на сайте Московского онкологического общества (https://mosoncolog.ru). Опрос включал 12 вопросов, на которые было предложено ответить врачам-онкологам, которые направляют пациентов с мКРР на молекулярно-генетическое тестирование, и заведующим отделениями/лабораториями.
Укажите регион, в котором Вы работаете (один ответ):
А. Москва и Московская область (МО)
Б. Санкт-Петербург и Ленинградская область (ЛО)
В. Центральный федеральный округ (ФО; кроме Москвы и МО)
Г. Северо-Западный ФО (кроме Санкт-Петербурга и ЛО)
Д. Южный ФО
Е. Приволжский ФО
Ж. Уральский ФО
З. Сибирский ФО
И. Дальневосточный ФО
К. Северо-Кавказский ФО
Когда обычно Вы направляете пациента с мКРР на молекулярно-генетическое тестирование (один ответ)?
А. Сразу перед началом терапии, как только установлен диагноз мКРР
Б. После прогрессирования на терапии 1-й линии
В. После прогрессирования на терапии 2-й и последующих линий
Г. Как получится, по-разному
Д. Обычно не направляю
Тестирование на какие молекулярно-генетические маркеры Вы обычно назначаете пациентам с мКРР (множественный выбор)?
А. KRAS-мутация
Б. NRAS-мутация
В. BRAF-мутация
Г. dMMR/MSI
Д. PD-L1
Е. HER2 экспрессия и/или амплификация
Ж. MLH1, MSH2, MSH6, PMS2 мутации
З. Полиморфизм генов DPYD или UGT1A1
И. АРС-мутация
Как часто Вы назначаете тестирование для определения мутации BRAF у пациентов с мКРР (один ответ)?
А. Всем 100% пациентов
Б. Примерно 80–90% пациентов
В. Примерно 70–80% пациентов
Г. Примерно 50% пациентов
Д. Примерно 30–40% пациентов
Е. Менее 30% пациентов
Знаете ли Вы о том, что существуют три класса мутации BRAF, определение которых при молекулярно-генетическом тестировании влияет на назначение таргетной терапии (один ответ)?
А. Знаю
Б. Не знаю
Как Вы обычно назначаете пациенту с мКРР тестирование для определения мутаций BRAF и KRAS/NRAS?
А. Всегда одновременно на обе мутации
Б. Всегда последовательно — сначала на BRAF, затем на KRAS/NRAS
В. Всегда последовательно — сначала на KRAS/NRAS, затем на BRAF
Г. Как получится, никогда об этом не думал(а)
Куда Вы направляете образцы для тестирования на выявление мутации BRAF у пациентов с мКРР (множественные ответы)?
А. Собственная лаборатория лечебно-профилактического учреждения (ЛПУ) (по программе обязательного медицинского страхования, ОМС)
Б. Лаборатория другого ЛПУ в этом же городе (по ОМС)
В. Лаборатория в другом городе (по ОМС)
Г. Через информационный портал молекулярно-генетической диагностики программы RUSSCO (cancergenome.ru)
Д. Коммерческая лаборатория (за счет средств пациента)
При направлении пациента с мКРР на тестирование для выявления мутации BRAF как часто Вы назначаете определение подтипов мутации BRAF (например, BRAF V600E, V600D, V600K) (один ответ)?
А. Всем 100% пациентов
Б. Примерно 70–80% пациентов
В. Примерно 50% пациентов
Г. Примерно 30–40% пациентов
Д. Примерно 10–30% пациентов
Е. Никому не назначаю, просто указываю «мутация BRAF»
При направлении пациента с мКРР на тестирование для выявления мутации BRAF как часто Вы назначаете определение классов мутации BRAF (например, класс 1, 2 или 3) (один ответ)?
А. Всем 100% пациентов
Б. Примерно 70–80% пациентов
В. Примерно 50% пациентов
Г. Примерно 30–40% пациентов
Д. Примерно 10–30% пациентов
Е. Никому не назначаю, просто указываю «мутация BRAF»
При направлении пациента с мКРР на тестирование для выявления мутации BRAF как часто Вы назначаете тестирование методом NGS — секвенирование ДНК нового поколения (один ответ)?
А. Всем 100% пациентов
Б. Примерно 50–80% пациентов
B. Примерно 20–40% пациентов
Г. Примерно 10–30% пациентов
Д. Назначаю только пациентам с подозрением на наследственные синдромы
Е. Никому не назначаю
Сколько времени в среднем занимает получение результатов молекулярно-генетического тестирования на мутацию BRAF у Ваших пациентов с мКРР (один ответ)?
А. 1–3 дня
Б. 4–7 дней
В. 8–14 дней
Г. 15–21 день
Д. 21–30 дней
Е. Более 30 дней
Укажите, пожалуйста, причины, по которым Вы не проводите молекулярно-генетическое тестирование на мутацию BRAF всем Вашим пациентам с мКРР (множественный выбор):
А. Недостаток финансирования по программе ОМС, приходится исключать мутацию BRAF из перечня необходимых тестов
Б. Не считаю нужным проводить тестирование всем пациентам с мКРР, так как у них плохой прогноз и это не влияет на выбор терапии
В. Не знаю о том, что тестирование на мутацию BRAF нужно проводить в обязательном порядке
Г. Выполняю указание руководства
Д. Затрудняюсь ответить
Е. Тестирование провожу всем
С января по апрель 2025 г. фиксировались анонимные ответы врачей, после чего голосование было закрыто и проведен анализ базы данных.
Результаты исследования
В опросе приняли участие 124 врача из разных регионов России. В таблице 1 представлено распределение врачей по регионам.
Как видно из таблицы 1, выборка опрошенных смещена в пользу центральных регионов (Москва, Санкт-Петербург и соответствующие области), что необходимо учитывать при интерпретации ответов респондентов.
Подавляющее большинство респондентов (95 (76,6%) из 124) предпочитают назначать тестирование сразу перед началом лечения и 19 (15,3%) — сразу после прогрессирования на 1-й линии терапии. Однако с учетом региона респондента картина становится более гетерогенной: в Москве, Санкт-Петербурге и соответствующих областях почти все респонденты (92,9%) назначают тестирование пациентам с мКРР перед началом лечения, тогда как в других регионах (преимущественно в Уральском ФО и Сибирском ФО) так поступают только 68,3% респондентов, а 21,95% предпочитают назначать тестирование после прогрессирования на 1-й линии терапии (табл. 2).

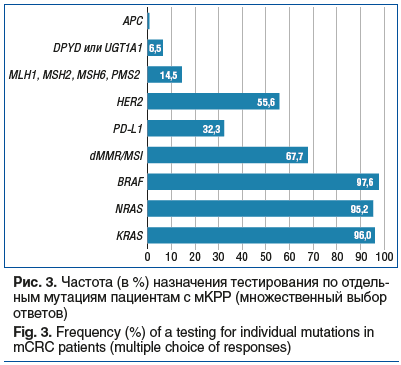
Наиболее часто врачи одновременно назначали пациентам тестирование на мутации KRAS, NRAS, BRAF, dMMR/MSI (25 (20,16%) врачей из 124), в 16,1% случаев к этому списку добавлялось тестирование HER2/neu, еще в 11,3% — PD-L1. Направление пациентов на тестирование на другие мутации (APC, DPYD и др.) врачи предпочитали менее чем в 10% случаев (рис. 3). Что касается мутации BRAF, то 97,6% опрошенных указали эту мишень в списке мутаций, на тестирование которых направляют образцы тканей пациентов с мКРР.
Во всех регионах 64,5% врачей назначают тестирование на мутацию BRAF всем своим пациентам, 25% врачей — менее чем 90% больных, 10,5% опрошенных ответили, что назначают тестирование примерно 50% пациентов и менее. Таким образом, в среднем по стране около 80% больных назначается молекулярно-генетическое тестирование на мутацию BRAF на каком-то из этапов лечения мКРР.
Осведомлены о существовании трех классов мутаций BRAF 99 (79,8%) из 124 респондентов, однако доли врачей, которые ответили на этот вопрос «не знаю о существовании трех классов мутаций BRAF» (25 (20,2%) из 124 респондентов), распределены в регионах РФ неравномерно (рис. 4).
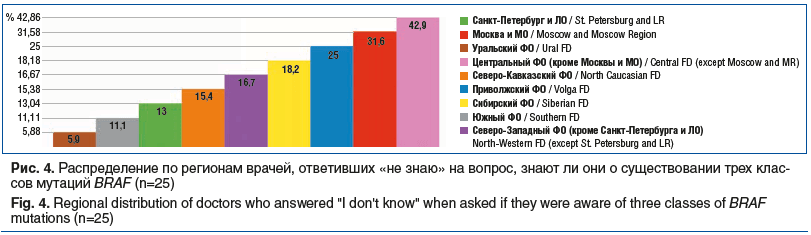
Как видно из рисунка 4, в Центральном ФО (включая Москву и МО) до 42% опрошенных не знают данного факта.
В целом 71% (88 из 124) респондентов предпочитают одновременно направлять образец ткани на тестирование мутаций в генах BRAF, KRAS, NRAS (рис. 5). Однако в некоторых регионах доля врачей, предпочитающих одновременное назначение исследований, меньше, чем в Москве, Санкт-Петербурге и соответствующих областях, и составляет всего 62,2%. В среднем 29% докторов предпочитают последовательное определение мутаций в генах: например, сначала KRAS/NRAS, а затем BRAF. Последовательное определение мутаций увеличивает нагрузку на лабораторию, увеличивает срок установки правильного диагноза и в условиях малого количества образца ткани опухоли может способствовать увеличению риска невыявления значимой мишени.

Чаще всего в Москве и Санкт-Петербурге тестирование выполняется по программе обязательного медицинского страхования (ОМС) либо в собственной лаборатории ЛПУ (42,86%), либо в лаборатории другого ЛПУ в этом же городе (28,57%), тогда как в регионах чаще направляют в лабораторию в другом городе за счет средств ОМС (26,83%) и чуть реже проводят тестирование в собственной лаборатории ЛПУ (20,73%). Другие варианты ответов встречались с частотой не более 10% (частные коммерческие лаборатории за счет средств пациента, через информационный портал молекулярно-генетической диагностики программы RUSSCO).
При анализе ответов респондентов интересным оказался тот факт, что только 45 (36,3%) из опрошенных врачей указывают в направлении на тестирование определенный подтип мутации BRAF(V600E, V600D, V600K и др.) всем пациентам, тогда как 51 (41,1%) респондент вообще не указывает подтип мутации при направлении на тестирование. Остальные 22,6% респондентов при направлении на тестирование в лабораторию указывают подтип мутации BRAF менее чем у 70% своих пациентов. При этом в столичных регионах врачи чаще предпочитают указывать подтип мутации (42,86% в Москве и Санкт-Петербурге против 32,9% в других регионах).
При направлении образцов ткани на тестирование 60,5% респондентов не указывают в направлении определение отдельных классов мутации BRAF (1, 2 или 3-й класс). При этом среди тех врачей, которые все-таки иногда указывают в направлении на тестирование определение классов мутации BRAF (39,5%), доля московских и санкт-петербургских врачей на 15% выше по сравнению с регионами (28,6 и 13,4% соответственно).
Большинство респондентов предпочитают не использовать высокопроизводительное секвенирование (NGS) для тестирования мутаций при мКРР (39 (31,5%) из 124), около четверти врачей назначают тестирование методом NGS только больным при подозрении на наследственный мКРР (32 (25,8%) из 124) и 16,1% респондентов стараются направлять образцы ткани на тестирование методом NGS во всех случаях мКРР.
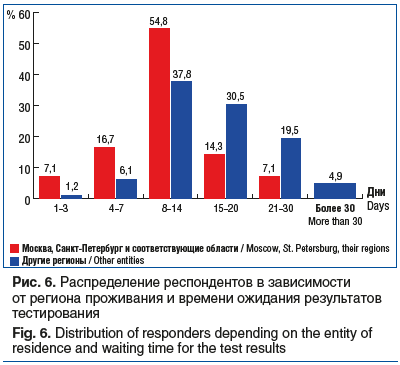
В большинстве случаев время до получения результата тестирования составляет от 8 до 14 дней (43,5% респондентов), 12,9% врачей получают результаты тестирования быстро — до 7 дней, четверть респондентов — от 15 до 21 дня, а 18,6% врачей ждут результаты тестирования 21 день и более. Продолжительность ожидания результатов тестирования в Москве, Санкт-Петербурге и областях приблизительно в 2 раза меньше по сравнению с другими регионами РФ (рис. 6).
Отвечая на вопрос о причинах, которые не дали возможности выполнить тестирование на мутацию BRAF, 48,4% респондентов ответили, что без проблем проводят тестирование всем больным, тогда как 15,3% опрошенных затруднились дать ответ и только 26,6% назвали в качестве причины недостаточное финансирование по программе ОМС.
Обсуждение
В соответствии с клиническими рекомендациями Минздрава России всем пациентам с мКРР рекомендуется выполнять молекулярно-генетическое тестирование для выявления прогностических и предиктивных онкомаркеров. Обязательными маркерами на сегодняшний день на метастатической стадии КРР являются мутации в генах KRAS, NRAS, BRAF (с указанием класса мутации), определение MSI/dMMR и экспрессии или амплификации HER2. Обнаружение указанных выше онкомаркеров может существенно повлиять на выбор таргетного агента для лечения метастатического процесса. Если мутации KRAS, NRAS, BRAF определялись методом ПЦР и не были обнаружены, то возможно проведение дальнейшего генетического поиска методом NGS, что может дополнительно выявить альтерации у 14–17% пациентов2,3.
Выявление мутации BRAFV600E на ранних этапах лечения мКРР имеет большое значение для правильного выбора тактики лечения и дальнейшего прогноза заболевания. На протяжении десятилетий системная химиотерапия была единственным терапевтическим вариантом для этого агрессивного подтипа КРР [13, 14].
В обновленных клинических рекомендациях 2025 г. пациентам с мКРР при положительном статусе мутации BRAF без сопутствующих нарушений репарации ДНК назначение ингибиторов BRAF показано начиная с 1-й линии терапии, а пациентам с MSI/dMMR — начиная со 2-й линии2,3. Учитывая высокую скорость прогрессирования заболевания на метастатической стадии, а также отсутствие большого количества времени для реализации действия иммунотерапии, у пациентов с мКРР более остро встает вопрос о статусе мутации BRAF.
В настоящем опросе приняли участие специалисты здравоохранения, которые ежедневно работают с больными КРР. Подавляющее большинство (76,6%) респондентов предпочитают назначать тестирование сразу перед началом лечения, и 15,3% назначают тестирование только после прогрессирования на 1-й линии терапии. В Москве, Санкт-Петербурге и областях эта закономерность выражена значительно ярче — 92% врачей назначают тестирование перед началом лечения, тогда как в регионах — только 68,3%. При этом всего по стране 80,6% респондентов назначают тестирование BRAF всем своим пациентам, чаще всего в комбинации с NRAS и KRAS. При этом если в Москве, Санкт-Петербурге и областях предпочитают в большинстве случаев одновременно тестировать на наличие мутаций в BRAF, NRAS, KRAS, то в других регионах отдают предпочтение последовательному тестированию, либо сначала BRAF, затем NRAS/KRAS — 15,8%, либо наоборот — 17,1%.
До 40% респондентов в Москве, МО и Центральном ФО не знают о существовании трех классов мутаций BRAF, что значительно больше, чем в других регионах. Согласно клиническим рекомендациям ингибиторы BRAF эффективны только при 1-м и 2-м классе мутации BRAF, при 3-м классе лечение должно проводиться как при КРР с мутацией BRAF дикого типа2,3.
В большинстве случаев врачи не указывают класс мутации BRAF в направлении на молекулярно-генетическое тестирование и в 41% не указывают подтипы мутации. Чаще других такие ответы встречаются у респондентов, которые никогда не назначают мультигенное тестирование методом NGS.
Всего 43% респондентов сообщили, что время ожидания результата тестирования составляет от 8 до 14 дней, даже в Москве, Санкт-Петербурге и областях только 54,8% опрошенных ответили, что тестирование укладывается в этот интервал времени. В других регионах около 50% респондентов ожидают результат от 15 до 30 дней. Увеличение времени ожидания результатов тестирования приводит к назначению химиотерапевтических режимов лечения (дуплет/триплет) ± бевацизумаб в 1-й линии терапии, сдвигая назначение ингибитора BRAF во 2-ю и последующие линии, что приводит к уменьшению эффективности лечения.
Обращает на себя внимание разница в назначении тестирования и времени ожидания результатов тестирования в зависимости от наличия или отсутствия своей лаборатории в ЛПУ. Таким образом, следует рекомендовать организацию собственных лабораторий молекулярной генетики для тестирования в наиболее крупных онкологических учреждениях в регионах, а также шире использовать возможности молекулярно-генетической диагностики в рамках программы RUSSCO и других программ поддержки пациентов.
Заключение
В целом в нашей стране отмечена широкая доступность определения мутации BRAF благодаря различным каналам финансирования: тестирование в рамках программы ОМС, в рамках программы молекулярно-генетической диагностики RUSSCO и в коммерческих лабораториях. При этом 26,6% врачей указали одной из причин отказа от тестирования на мутацию BRAF недостаток финансирования по программе ОМС, что говорит о необходимости проведения мер, направленных на улучшение организации молекулярно-генетического тестирования. Следует также продолжать проведение образовательных мероприятий по увеличению осведомленности онкологов о прогностическом и предиктивном значении мутации BRAF при мКРР, значении трех классов и разных подтипов мутации BRAF. По возможности следует стремиться направлять пациентов с мКРР на молекулярно-генетическое тестирование до начала терапии 1-й линии.
СВЕДЕНИЯ ОБ АВТОРАХ:
Троценко Иван Дмитриевич — к.м.н., исполнительный директор Московского онкологического общества, старший научный сотрудник отдела общей онкологии ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86, стр. 6; ORCID iD 0000-0002-6667-0125
Андреяшкина Ирина Ивановна — д.м.н., заместитель главного внештатного специалиста-онколога ДЗМ, ведущий научный сотрудник ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86, стр. 6; ORCID iD 0000-0003-2646-499X
Хатьков Игорь Евгеньевич — д.м.н., профессор, академик РАН, главный внештатный специалист-онколог ДЗМ, директор ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86, стр. 6; ORCID iD 0000-0002-4088-8118
Контактная информация: Иван Дмитриевич Троценко, e-mail: ivan.trotsenko@mosoncolog.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 17.10.2025.
Поступила после рецензирования 13.11.2025.
Принята в печать 25.11.2025.
ABOUT THE AUTHORS:
Ivan D. Trotsenko — C. Sc. (Med.), Executive Director of the Moscow Oncological Society, Senior Scientific Officer at the Department of General Oncology, A.S. Loginov Moscow Clinical Scientific Center; 86 build. 6, Entuziastov Road, Moscow, 111123, Russian Federation; ORCID iD 0000-0002-6667-0125
Irina I. Andreyashkina — Dr. Sc. (Med.), Deputy Chief Freelance Oncologist at the Moscow Healthcare Department, Leading Scientific Officer, A.S. Loginov Moscow Clinical Scientific Center; 86 build. 6, Entuziastov Road, Moscow, 111123, Russian Federation; ORCID iD 0000-0003-2646-499X
Igor E. Khatkov — Dr. Sc. (Med.), Professor, Academician of the Russian Academy of Sciences, Chief Freelance Oncologist at the Moscow Healthcare Department, Director of A.S. Loginov Moscow Clinical Scientific Center; 86 build. 6, Entuziastov Road, Moscow, 111123, Russian Federation; ORCID iD 0000-0002-4088-8118
Contact information: Ivan D. Trotsenko, e-mail: ivan.trotsenko@mosoncolog.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 17.10.2025.
Revised 13.11.2025.
Accepted 25.11.2025.
1ESMO Living Guideline: Metastatic Colorectal Cancer. version 1.3. July 2025. (Electronic resource.) URL: https://www.esmo.org/guidelines/living-guidelines/esmo-living-guideline-metastatic-colorectal-cancer (access date: 12.10.2025).
2Клинические рекомендации. Рак ободочной кишки и ректосигмоидного перехода. 2025. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/396_4?ysclid=miav02cppd32449749 (дата обращения: 12.10.2025).
3Клинические рекомендации. Рак прямой кишки. 2025. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/554_4?ysclid=miav1o0emv387751047 (дата обращения: 12.10.2025).
Информация с rmj.ru

