Синдром Кэмерона: обзор литературы и описание клинического случая
В.В. Василенко, Д.Л. Виноградов*, М.С. Хамидулина
Первый Московский государственный медицинский университет им. И.М. Сеченова, кафедра госпитальной терапии № 2, Москва, Россия
*Контакты/Contacts. E-mail: wind007(а)mail.ru
Резюме
Синдром Кэмерона представляет собой язвенные или эрозивные повреждения слизистой оболочки грыжевого выпячивания при грыжах пищеводного отверстия диафрагмы, которые сопровождаются хроническим оккультным или явным кровотечением и железодефицитной анемией. Грыжи пищеводного отверстия диафрагмы являются часто встречающейся патологией, которая в большинстве случаев проявляется диспепсическими явлениями разной степени выраженности, либо течет бессимптомно.
Описание синдрома Кэмерона как важного состояния, ассоциированного с грыжами пищеводного отверстия диафрагмы, редко встречается в литературе, в том числе и зарубежной. Это приводит к недостаточной осведомленности специалистов терапевтического и хирургического профиля и врачей-эндоскопистов о данной патологии. Повреждения Кэмерона заслуживают особого внимания, потому что могут стать причиной как хронической скрытой кровопотери, так и жизнеугрожающего кровотечения. Подобные повреждения верхних отделов желудочно-кишечного тракта часто неправильно интерпретируются или упускаются из виду при проведении стандартной диагностики, что создает опасность постановки ошибочного диагноза и ложной тактики ведения пациентов с синдромом Кэмерона. В данном обзоре представлены сведения о патогенезе, особенностях течения и диагностике этой патологии, а также современным подходам к лечению. Диагностика синдрома Кэмерона представляет трудности, в том числе связанные с тем, что на ЭГДС такие повреждения слизистой оболочки не всегда выявляются. Разобраны основные причины несостоятельности рутинных методов диагностики, и описаны критерии, по которым можно заподозрить синдром Кэмерона в случаях, когда результаты эндоскопии неоднозначны. При описании клинического случая рассматривается важная проблема, с которой зачастую сталкиваются врачи, ведя пациентов с данным синдромом — повреждения Кэмерона могут сопровождаться устойчивой железодефицитной анемией, не поддающейся медикаментозной коррекции. Такой вариант течения заболевания важно принять во внимание, т.к. при возникновении данной симптоматики синдром Кэмерона необходимо включить в круг диагностического поиска источника упорной кровопотери.
Поскольку повреждения Кэмерона могут протекать как бессимптомно, так и проявляться в виде тяжелых хронических анемий, появляется много вопросов о тактике ведения пациентов. В обзоре рассмотрены основные методы лечения и приведены критерии, на которые врач может опираться, отдавая предпочтение в пользу консервативной или же хирургической тактики.
Ключевые слова: повреждения Кэмерона, грыжа пищеводного отверстия диафрагмы, кровотечения из верхних отделов пищеварительного тракта, трансфузионно-устойчивая анемия.
АД — артериальное давление,
ГПОД — грыжа пищеводного отверстия диафрагмы,
ЖДА — железодефицитная анемия,
ЖКТ — желудочно-кишечный тракт,
ПК — повреждения Кэмерона,
ЧД — частота дыханий,
ЧСС — частота сердечных сокращений,
ЭГДС — эзофагогастродуоденоскопия.
По данным обзора, представленного Институтом Американской гастроэнтерологической ассоциации [2], самыми частыми причинами кровотечений из верхнего отдела пищеварительного тракта, которые пропускают при рутинном обследовании, являются т.н. повреждения Кэмерона при больших грыжах пищеводного отверстия диафрагмы, варикозное расширение вен дна желудка, пептические язвы, болезнь Дьелафуа и расширение сосудов антрального отдела желудка.
В 1986 г. Cameron и Higgins [6] в проспективном исследовании оценили состояние 109 пациентов с крупными грыжами пищеводного отверстия, у которых как минимум 1/3 желудка располагалась над диафрагмой. У 55 пациентов была диагностирована анемия, при этом у 23 из них обнаружили линейные эрозии желудка на гребнях слизистой оболочки, располагающиеся на уровне или около диафрагмы. Среди 54 пациентов с большой грыжей пищеводного отверстия диафрагмы без анемии, у 13 было обнаружено такое же повреждение слизистой оболочки желудка. Данная комбинация повреждений слизистой оболочки в сочетании с железодефицитной анемией получила в последующем наименование «повреждение Кэмерона» (ПК) [19].
При грыже пищеводного отверстия диафрагмы (ГПОД) происходит пролапс части желудка в грудную полость (рис. 1, 2, 3). Распространенность ГПОД достаточно велика — Grey D.M. c соавт. [10] в ретроспективном когортном исследовании оценили 8260 ЭГДС, выполненных по разному поводу, и доля ГПОД составила 20,2%.
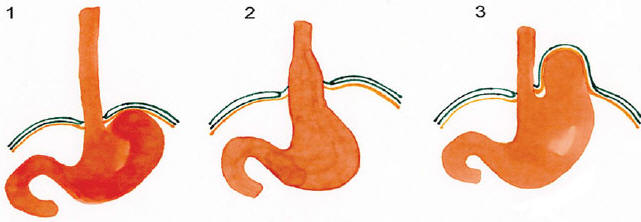
Рис. 1. Пищеводно-желудочный переход 1 — норма, 2 — скользящая ГПОД, 3 — параэзофагеальная ГПОД, область перехода остается фиксированной в пищеводном отверстии диафрагмы
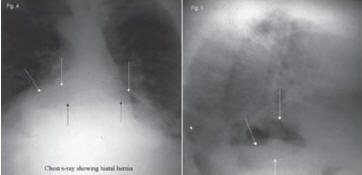
Рис. 2. Рентгенограммы грудной клетки в прямой (слева) и боковой (справа) проекциях. Большая грыжа пищеводного отверстия диафрагмы обнаруживается по воздушном у пузырю желудка (Sawyer MAJ. MD Consulting Staff, Department of Surgery, Comanche County Memorial Hospital; Medical Director, Lawton Bariatrics)
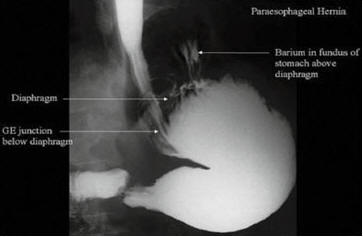
Рис. 3. Параэзофагеальная грыжа рентгено-контрастное исследование. Складки слизистой оболочки желудка обнаруживаются в грудной полости рядом с пищеводом (Sawyer MAJ. MD Consulting Staff, Department of Surgery, Comanche County Memorial Hospital; Medical Director, Lawton Bariatrics)
ПК первично описано как линейные язвы или эрозии желудка на складках слизистой оболочки желудка в области диафрагмального вдавления у пациентов с крупной ГПОД. В целом, по данным эндоскопических исследований, ПК обнаруживается у 5% пациентов с ГПОД [19]. Термин используется для обозначения как язв, так и эрозий, так как при рутинной ЭГДС сложно дифференцировать данные поражения [9].
Патогенез ПК не изучен до конца. Предложены несколько гипотез: (1) механическая травма слизистой, возникающая в результате сокращений диафрагмы во время дыхательных движений [6]; (2) повреждение кислотой, как результат гастроэзофагеального рефлюкса, который часто ассоциирован с ГПОД; (3) механическая компрессия сосудов желудка в грыжевых воротах, которая приводит к локальной ишемической гастропатии в виде коагуляционного некроза [11]. Другими возможными патогенетическими факторами считают гастростаз, лимфостаз и отек слизистой оболочки. И все-таки точка зрения об одновременной роли нескольких факторов, как механического, так и кислотного [10], в патогенезе данной патологии находит место в большинстве современных публикаций. Если рассматривать как причину лишь механическую травму, то синдром Кэмерона мог бы быть излечен только хирургической коррекцией ГПОД, но накопленный опыт показывает, что активная терапия блокаторами протонной помпы приводит к заживлению эрозий.
Изучалась и роль Helicobacter pylori в формировании ПК. Weston A.P. [19] провел множественные биопсии желудка и только у 32% тест на наличие пилорического хеликобактера был положительным. Yakut M. [17] в сходном исследовании обнаружил, что доля положительных тестов на хеликобактер среди пациентов с ГПОД оказалась всего 25,7%.
Следует отметить малую освещенность синдрома Кэмерона в мировой литературе. По анализу 7 ключевых европейских и австралийских учебников по хирургии, только в 3-х из них имеется упоминание о том, что ГПОД могут сопровождаться железодефицитной анемией, причем в качестве причины этой анемии приводится только рефлюкс-эзофагит. Первое наблюдение синдрома Кэмерона в Российской Федерации было сделано нами в 2011 году [1].
В контролированном исследовании Cameron A.J. регистрирует следующее [5]. У пациентов с крупными ГПОД, когда они настолько большие, что могут быть видны на обычных рентгенограммах грудной клетки, где одна треть желудка располагается над диафрагмой, визуализируется газовый пузырь, — анемия встречается в 18 раз чаще, чем у людей того же возраста и пола.
Распространенность ПК связана с размерами грыжи. При ГПОД размером 15 см ПК встречаются в 10-20% случаев [15], причем в 2/3 из них обнаруживаются множественные повреждения [13]. При ГПОД более 5 см ПК наблюдается в 12,8% [10]. D.M. Grey и соавт. [10] высказываются в пользу необходимости дополнительного проведения контрастной эзофагограммы для определения истинных размеров ГПОД.
В проводимом ими исследовании было показано, что размер ГПОД, оцененный во время ЭГДС, часто значительно меньше, чем данные, полученные при контрастной эзофагограмме с барием у одного того же пациента (например, 6 см при эндоскопии и 10 см при контрастной эзофагограмме). Авторы наблюдения объясняют эту особенность ключевыми различиями между двумя диагностическими методами. Если врач опирается только на ЭГДС, есть риск недооценить размер ГПОД и ложным образом исключить синдром Кэмерона из возможных причин железодефицитной анемии.
ПК являются патологией, о которой следует помнить при возникновении у пациента желудочно-кишечного кровотечения «неустановленной этиологии». Было отмечено, что ПК очень часто не обнаруживаются при первичной ЭГДС, и выявляются лишь при повторных исследованиях [4]. Если врач-эндоскопист не пытается прицельно «искать» такие повреждения у больного, то вероятность того, что они будут пропущены, может быть весьма высока [3].
Эндоскопический метод является золотым стандартом диагностики ПК, но даже при проведении данного исследования нередко повреждения неверно интерпретируются как проявления гастроэзофагеальной болезни (несмотря на отсутствие у пациента изжоги), эзофагита или язвенной болезни [3].
В первую очередь это связано с малой осведомленностью врачей о существовании такой патологии.
Примечателен обзор с названием «Cameron ulcers: you will find only what you seek» («Язвы Кэмерона: ты найдешь только то, что ищешь») [7], где описывается история пациентки 71-года, страдавшей от тяжелой железодефицитной анемии в течение 4 лет, получавшей агрессивную терапию препаратами железа перорально и внутривенно без эффекта. За этот период ей было проведено 16 гемотрансфузий. Пациентка прошла различные диагностические обследования в 3-х различных госпиталях на выявление причины анемии, в том числе ей проводилась ЭГДС и колоноскопия, по результатам которых диагноз не был установлен. На ЭГДС была выявлена ГПОД III степени, 50% желудка располагалось над диафрагмой, но синдром Кэмерона, как причина ЖДА не рассматривался.
И только при повторных ЭГДС в другом лечебном учреждении была выявлена язва Кэмерона размером 1,5 см на слизистой грыжевого мешка. Таким образом, можно сделать заключение, что терапевт должен знать об ассоциации крупной ГПОД с повреждениями Кэмерона, как причине анемии, даже если результаты первичной ЭГДС отрицательны. Эрозии и язвы при синдроме Кэмерона то заживают, то появляются вновь, что и приводит к хроническому оккультному (или явному) кровотечению. Повреждения и, соответственно, кровопотеря имеют интермиттирующий характер, поэтому выявить их в конкретный момент времени при помощи ЭГДС не всегда представляется возможным. По этой же причине, анализ кала на скрытую кровь также не имеет высокой информативности [10].
При обнаружении ПК следует начинать лечение ингибиторами протонной помпы или блокаторами Н2-рецепторов в сочетании с прокинетиками и препаратами железа [13].
Синдром Кэмерона может иметь различные по степени тяжести проявления, от бессимптомной ЖДА до острого жизнеугрожающего кровотечения. Существует прямая корреляция между размером ГПОД и тяжестью анемии. В контролированном исследовании Cameron A.J. [5] регистрирует следующее: у пациентов с крупными грыжами, когда они настолько большие, что могут быть видны на обычных рентгенограммах грудной клетки (одна треть желудка над диафрагмой, газовый пузырь), анемия встречается в 18 раз чаще, чем у людей того же возраста и пола.
В двойном слепом исследовании был показан положительный эффект применения транексамовой кислоты (по 1,5 г каждые 8 часов).
Число повторных гемотрансфузии было меньше в группе пациентов, принимавших транексамовую кислоту. Эти результаты сочетаются с концепцией наличия фибринолитического компонента в кровотечении из верхних отделов ЖКТ, что может быть особенно важно, если источником кровотечения являются острые поверхностные эрозии [8]. Следует отметить, что при ПК затруднено проведение эндоскопического гемостаза, в основном из-за анатомической сложности остановки кровотечения в области ГПОД грыжи [12].
Проблема возникновения тяжелой анемии, устойчивой к коррекции препаратами железа и гемотрансфузиями, по-видимому, является ключевой при выборе тактики лечения. «Трансфузионно-зависимые анемии» — так были названы подобные состояния.
В исследовании [19] были отобраны пациенты, у которых, во-первых, симптомы анемии не поддавались коррекции в течение длительного срока (в среднем — год), и, во-вторых, была безуспешна агрессивная терапия — количество гемотрансфузий составляло от 2 до 36. Что важно отметить, на ЭГДС повреждения Кэмерона были обнаружены только у 2-х пациентов из 7, причем у одного из них на ЭГДС непосредственно перед операцией они уже найдены не были. Поэтому авторы акцентируют внимание на том, что врач должен всегда помнить об ассоциации крупных грыж диафрагмы и анемии с повреждениями Кэмерона, и даже если они не были обнаружены на ЭГДС — не исключать подобный диагноз. Ставится вопрос о целесообразности проведения повторных ЭГДС, т.к. всем описанным пациентам не раз была сделана ЭГДС, но результаты по прежнему оставались малоинформативными. Авторы исследования делают заключение, что относительно молодым и здоровым пациентам с тяжелой и устойчивой анемией и отсутствием других возможных источников кровопотери, кроме ПК, следует предложить операцию, нежели подвергать рискам, связанным с проведением повторных гемотрансфузий и ЭГДС.
Хирургическое лечение в данном исследовании было проведено 138 пациентам и привело к успешной коррекции анемии и отсутствию рецидивов в течение 26 месяцев.
Плановое хирургическое лечение (фундопликация — лапароскопическая или открытая) рекомендуют пациентам, у которых болезнь не поддается терапевтическим воздействиям [14]. В исследовании о «трансфузионно-зависимых анемиях» получена статистика, что доля пациентов, у которых анемия не корректируется медикаментами, составляет 5% [17]. Weston A.P. с соавт. [19] в своем исследовании наблюдали пациентов в течение 34 месяцев, и в 20% отметили появление осложнений ПК в виде рецидива кровотечения (3 пациента), упорной анемии (4 пациента) и смерти (1 пациент). Другие авторы утверждают, что длительное послеоперационное наблюдение не выявляет рецидива ПК и анемии [5]. F. Panzuto с соавт. [16] тщательным образом отобрали 21 пациента с ГПОД и анемией, где ПК являются наиболее вероятной причиной анемии. Всем пациентам была проведена коррекция анемии препаратами железа, а в тяжелых случаях — гемотрансфузиями. Далее препараты железа были отменены, и всем пациентам была начата терапия ингибиторами протонной помпы (ланзопразол 30 мг в день внутрь).
Пациенты были разделены на две группы, одной группе была сделана лапароскопическая фундопликация по Ниссену. Вторая группа получала только ингибитор протонной помпы. Далее лабораторные показатели сравнивались на протяжении года. Каких-либо различий между результатами выявлено не было, рецидивов анемии не наблюдалось ни в одной из групп. Несмотря на то, что обе группы пациентов не получали препараты железа в течение года, уровни гемоглобина и ферритина не снижались, а постепенно восстанавливались.
Описание клинического случая
В стационар был госпитализирован пациент 37 лет с анемией неясной этиологии. При относительно удовлетворительном общем состоянии имели место выраженная бледность кожных покровов и видимых слизистых, значительная одутловатость лица, отечность голеней, стоп и передней брюшной стенки; тахипноэ (ЧД 20/мин), умеренная тахикардия (ЧСС=112 уд/мин), АД= 110/70 мм рт.ст., температура тела — 38°С.
Две-три недели назад, со слов родственников, они отметили у больного усиление бледности кожи, учащение пульса до 100-110 уд/мин в покое, слабость при ходьбе и работе по дому, лихорадку, периодическую (2-3 раза в неделю) рвоту, не связанную с приемом пищи. Симптоматика прогрессировала, присоединились периферические отеки. Основанием для госпитализации явились обморочные состояния.
Пациент, с детства страдающий олигофренией и эпилепсией, в течение многих лет принимает карбамазепин в дозе 300 мг/сут, сонапакс 75 мг/сут.
При первичном анализе в стационаре была выявлена железодефицитная анемия тяжелой степени: Hb 25 г/л, эритроциты 1,1*1012/л; сывороточное железо 0,2 мкмоль/л, лейкоциты 11,0*109/л, СОЭ 80 мм/ч, тромбоциты 376*109/л, ретикулоциты 0,02%, выраженный микроцитоз, пойкилоцитоз +, гипохромия эритроцитов ++, общий белок 51,0. Проведены две гемотрансфузии эритроцитарной массы по 350 мл каждая, после которых уровень Hb повысился до 73 г/л, эритроцитов —до 2,63*1012/л, лейкоциты 6,8*109/л, СОЭ 60 мм/ч, тромбоциты 499*109/л, ретикулоциты 1,7%, умеренный анизоцитоз, незначительный пойкилоцитоз, общий белок 61,0.
Сохранялся постоянный субфебрилитет. Родители не давали согласия на проведение ЭГДС. Проводилось симптоматическое лечение (аминокапроновая кислота в/в, цефазолин в/м, циплокс внутрь). Через 2 недели после госпитализации был получен резко положительный результат анализа кала на скрытую кровь, и с согласия родственников пациенту провели ЭГДС, при которой была обнаружена гигантская язва нижней трети пищевода средней глубины, с фибрином в дне, размерами более 3,0 см; гистологически установлен хронический характер язвенного дефекта; недостаточность пищеводно-желудочного сфинктера, скользящая нефиксированная грыжа пищеводного отверстия диафрагмы 3 степени.
Назначено лечение омепразолом, ранитидином, алмагелем, цианкобаламином в/м, феррум-лек в/м. Состояние и самочувствие пациента постепенно улучшились: уменьшилась слабость, нормализовалась температура тела, исчезла отечность. Рвота прекратилась. По настоянию родственников пациент был выписан и в дальнейшем наблюдался амбулаторно.
Было рекомендовано: феррум-лек жевательные таблетки по 1 таб. в день; париет 20 мг -1 таб. в день; мотилиум 1 таб. 3 р. в день за 30 мин до еды; актовегин 1 драже 3 раза в день; мезим-форте 1 т. 3 р. в день, а также алмагель или облепиховое масло 1-2 чайные ложки 4 раза в день за 30 минут до приема пищи и перед сном.
На ЭГДС, проведенной после 4-х месяцев непрерывного лечения, были обнаружены высокие папиллярные разрастания покровно-ямочного эпителия с выраженным отеком стромы в области кардиоэзофагеального перехода и диффузную лимфоплазмоцитарную инфильтрацию с примесью сегментированных лейкоцитов вблизи от края сохраняющейся хронической язвы. Еще через 2 месяца был обнаружен гнойно-некротический детрит, с фиброзом и воспалительной инфильтрацией в месте дна фагеденической язвы. Картина ЭГДС от 21.04.2010. отражена на рис. 4.
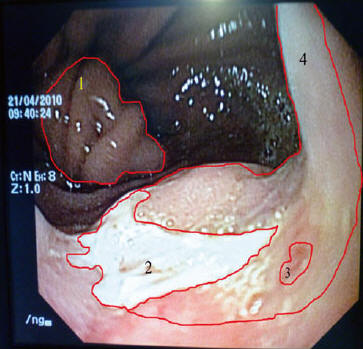
Рис. 4. Эндоскопическая картина области эзофаго-кардиального перехода. 1. – Пролапс слизистой оболочки желудка. 2. — Язвенный дефект 0.5х0.6 см. на нижней стенке. 3. – Область свежего эпителия (свежий рубец. 4. – Границы зарубцевавшейся язвы
Динамика картины ЭГДС за период лечения представлена в виде диаграммы на рис. 5. ЭГДС спустя год от начала лечения (от 10.09.10), язвенных и эрозивных дефектов не обнаружила. Тем не менее, несмотря на прием препаратов железа, анемия продолжает сохраняться и уровни сывороточного железа и ферритина остаются очень низкими. Высокая СОЭ объясняется гидремией. 25.11.10 при ЭГДС вновь обнаружен язвенный дефект размером 5 х 7 мм.
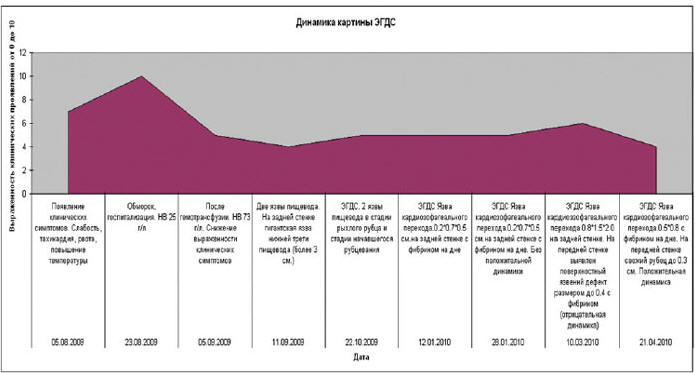
Рис. 5. Динамика картины ЭГДС за период лечения. Прослеживается четкая корреляция между выраженностью клинических проявлений и эндоскопической картиной. Отражена безуспешность консервативного лечения. Через короткий промежуток времени после зарубцевания поражений появляются новые язвенные дефекты
Была назначена транексамовая кислота в дозе 750 мг два раза в сутки.
По оценке лабораторных показателей, уровень гемоглобина после агрессивной коррекции гемотрансфузиями и препаратами железа достиг 116 г/л, но затем, спустя год, снова было отмечено до 82 г/л. Гипохромная микроцитарная анемия так и не была полностью скорректирована. Через год после лечения уровень железа сыворотки составил 2,4 мкмоль/л (при норме 10,7-8,6 мкмоль/л), ферритин — 12 мг/л (20–50 мкг/л), % насыщения трансферина — 3,80 (при норме 15–0%), эритроциты 2,80 млн/мкл (4,30–5,70 млн/мкл), гематокрит 26,50% (при норме 39,0–9,0%).
Результаты рентгеноконтрастного исследования верхнего отдела ЖКТ (от 01.06.10) представлены на рис. 6. Обнаружены: эзофагит, недостаточность кардиального отверстия диафрагмы со скользящей грыжей, хронический гастрит — представленный извитыми складками слизистой оболочки, образующими зазубренности по большой кривизне желудка, с глубокой перистальтикой.
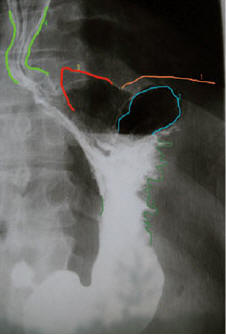
Рис. 6. Симптом грыжевых ворот – расположение части рентгеновской тени желудка над диафрагмой. 1. – Линия диафрагмы. 2. — Газовый пузырь желудка. 3. – Грыжа пищеводного отверстия диафрагмы 4. – Пищевод. 5. Дефект наполнения контрастом желудка
С родителями пациента неоднократно обсуждалась возможность хирургического вмешательства, однако окончательное решение ими принято не было.
Заключение
Большинство авторов рассмотренных нами исследований сделали вывод, что консервативный метод остается эффективным, и препаратами выбора являются ингибиторы протонной помпы и прокинетик и, а также препараты железа для коррекции анемии. Эффективность блокаторов протонной помпы доказывает важность роли химического повреждения слизистой оболочки кислотой в патогенезе повреждений Кэмерона.
Если пациент устойчив к данной терапии, а также если размеры грыжи крупные и имеется тяжелая степень анемии, то лучше предложить хирургическое лечение. В описанном нами клиническом случае предпочтительна хирургическая тактика. Данный случай можно считать примером «трансфузионно-зависимой анемии», встречающейся, как уже было сказано ранее, в 5% случаев ГПОД [14,19]. Для таких пациентов метод лапароскопической фундопликации является эффективным и единственным способом предотвращения рецидивов анемии [14].
Список литературы/References:
- Василенко В.В., Вязкова Н.В., Лопатина И.А., Тимофеев С.Е. Синдром Кэмерона как причина хронической постгеморрагической анемии. Российский журнал гастроэнтерологии, гепатологии, колопроктологии (приложение № 38, Материалы Семнадцатой Российской Гастроэнтерологической Недели) 2011; 5: 5. Vasilenko V.V., Vyazkova N.V., Lopatin I.A., Timofeev S.E. Cameron’s syndrome as a cause of chronic post-hemorrhagic anemia. Russian Journal of Gastroenterology, Hepatology, Coloproctology (Appendix № 38, Proceedings of the Seventeenth Russian Gastroenterological Week) 2011; 5: 5.
- American Gastroenterological Association (AGA) Institute Medical Position Statement on Obscure Gastrointestinal Bleeding. GASTROENTEROLOGY 2007; 133: 1694–696.
- Appleteard M.N., Swain C.P. Endoscopic difficulties in the diagnosis of upper gastrointestinal bleeding. World J Gastroenterol 2001; 7: 308–12.
- Bornstein J.D., Brazer S.R. Cameron erosions. Gastrointest Endosc 1999; 49: 514.
- Cameron A.J. Incidence of iron deficiency anemia in patients with large diaphragmatic hernia. A controlled study. Mayo Clin Proc 1976; 51: 767–69.
- Cameron A.J., Higgins J.A. Linear gastric erosion. А lesion associated with large diaphragmatic hernia and chronic blood loss anemia. Gastroenterology 1986; 91:338-342.
- Chun C.L., Conti C.A., Triadafilopoulos G. Cameron Ulcers: You Will Find Only What You Seek. Digestive Diseases and Sciences 2011; 56: 3450-3452.
- Cormack F., Jouhar A.J., Chakrabarti R.R., Fearnley G.R. Tranexamic acid in upper gastrointestinal hemorrhage. The Lancet. 1973; 301(7814): 1207-1208.
- Dulai D., Jensen M.E., Lam F., Jutabha R., Jensen D.M. Occult gastrointestinal hemorrhage from linear gastric ulcers in giant, sliding hiatal hernias: an enteroscopic case series (abstract). Gastrointest Endosc 1999; 49: AB166.
- Gray D.M., Kushnir V., Kalra G., Rosenstock A., Alsakka M.A., Patel A., Sayuk G., Gyawali C.P. Cameron lesions in patients with hiatal hernias: prevalence, presentation, and treatment outcome. Dis Esophagus. 2015; 28(5): 448-452.
- Katz J., Brar S., Sidhu J.S. Histopathological characterization of a Cameron lesion. Int J Surg Pathol. 2012; 20 (5): 528-530.
- Lin C.C., Chen T.H., Ho W.C., Chen T.Y. Endoscopic treatment of a Cameron lesion presenting as life-threatening gastrointestinal hemorrhage. J Clin Gastroenterol 2001; 33: 423–24.
- Maganty K., Smith R.L. Cameron lesions: unusual cause of gastrointestinal bleeding and anemia. Digestion 2008; 77: 214 –17.
- Moschos J., Pilpilidis I., Kadis S., Antonopoulos Z., Paikos D., Tzilves D., Katsos I., Tarpagos A. Cameron lesion and its laparoscopic management. Indian J Gastroenterol 2005; 24: 163.
- Nguyen N., Tam W., Kimber R., Roberts-Thomson I.C. Gastrointestinal: Cameron’s erosions. J Gastroenterol Hepatol 2002; 17: 343.
- Panzuto F., Giulio E. D. I, Capurso G., Baccini F., D`Ambra G., Dellefave G., Annibale B. Large hiatal hernia in patients with iron deficiency anemia: a prospective study on prevalence and treatment. Aliment. Pharmacol. Ther. 2004; 19: 663–70.
- Yakut M., Soylan I., Kabacam G. Clinical Characteristics and Evaluation of Patients with Large Hiatal Hernia and Cameron Lesions. Southern. medical journal. 2011; 104(3): 179-184.
- Richard J., Skipworth E., Staerkle R.F., Leibman S., Smith G.S. Transfusion-Dependent Anaemia: An Overlooked Complication of Paraoesophageal Hernias. Int. Sch. Res. Notes. 2014; 2014: 479240.
- Weston AP. Hiatal hernia with Cameron ulcers and erosions. Gastrointest. Endosc. Clin. N. Am. 1996; 6: 671–79.
Статья опубликована на сайте http://www.gastroscan.ru
материал с сайта MedLinks.ru

