В статье представлены результаты исследования, посвященного оценке влияния метаболических и иммунологических нарушений на течение хронического гепатита С
Содержание статьи
Актуальность
Хронический гепатит С (ХГС) на протяжении многих лет остается актуальной медико-социальной проблемой в мире, и, несмотря на достигнутые успехи, неуклонно продолжает расти заболеваемость и сохраняется высокий риск развития его отдаленных неблагоприятных исходов, таких как цирроз печени (ЦП) и гепатоцеллюлярная карцинома (ГЦК). В Глобальном докладе ВОЗ в 2017 г. отмечено, что число больных ХГС в мире оценивается в 71 млн человек, а ежегодно от данной патологии и ее осложнений умирают более 350 тыс. больных [1]. В РФ зарегистрировано около 5 млн граждан, инфицированных вирусом гепатита С (ВГС), из них около 2 млн больных ХГС, и в 65% случаев это пациенты активного, трудоспособного возраста от 30 до 50 лет [2].
В ряде стран мира распространенность ХГС начинает снижаться благодаря доступности противовирусной терапии (ПВТ) [3], целью которой является элиминация ВГС. В настоящее время считается, что каждый больной ХГС должен получить лечение, а успешное лечение снижает риск развития ЦП и ГЦК [3, 4]. Следует отметить, что в России только 29,6 тыс. человек (около 5% больных) получают ПВТ, а большинство пациентов не имеют доступа к необходимому обследованию и лечению [2].
ХГС связывают с метаболическими нарушениями, и уже доказана самостоятельная роль НCV-инфекции в развитии неалкогольной жировой болезни печени (НЖБП), которую считают одним из ключевых факторов прогрессирования заболевания [4]. Механизм индуцированного возбудителем стеатоза обусловлен присутствием в структуре вируса «стеатозогенных» белков, ответственных за нарушение липидного обмена в гепатоците [5]. Уже установлено, что распространенность НЖБП среди всех пациентов, обратившихся за медицинской помощью, составляет 37,3%, а у больных ХГС НЖБП встречается в 35–80% случаев, что в 2,5 раза выше, чем у лиц без данной патологии [6].
У больных ХГС важную роль в активации процессов фиброзирования играет противовирусный иммунный ответ, а именно естественные киллеры (NK-клетки) и Т-лимфоциты, несущие маркеры NK-клеток (NK-Т-клетки), в больших количествах представленные в печени [7]. Высокую цитотоксичность лимфоцитов и естественных киллеров связывают с неблагоприятным прогнозом течения HCV-инфекции, т. к. избыточное неспецифическое повреждение гепатоцитов стимулирует фиброзирование печеночной паренхимы [8, 9]. Ранее не изучались значение циркулирующих лимфоцитов, экспрессирующих цепи рецепторов ИФН-α/β и ИФН-γ (CD118+, CD119+) в иммунопатогенезе ХГС, и их роль в прогрессировании фиброза печени. Ранее проводимые собственные исследования описывают достоверное увеличение CD119+ у пациентов с ХГС по сравнению со здоровыми лицами и больными ХГВ [9].
Таким образом, у всех больных ХГС неизбежно происходит формирование фиброза печени, и очевидно, что поиск значимых критериев прогрессирования заболевания остается чрезвычайно актуальной и важной задачей, решение которой определит выбор адекватной тактики ведения больного.
Цель исследования: определить влияние метаболических и иммунологических нарушений на течение хронического гепатита С.
Материал и методы
Под наблюдением находились 250 больных ХГС на базе клинического отдела инфекционной патологии ЦНИИ Эпидемиологии и инфекционного отделениия 5 ВКГ ВНГ РФ г. Екатеринбурга. Обследование и лечение больных ХГС соответствовало европейским и национальным стандартам и протоколам лечения болезней печени и утверждено локальным этическим комитетом. Диагноз ХГС установлен на основании жалоб, комплексного клинико-эпидемиологического анамнеза, объективного осмотра, результатов лабораторных исследований (общий анализ крови, общий анализ мочи, биохимический анализ крови), определения количества РНК ВГС и генотипирования ВГС методом полимеразной цепной реакции. Исследование субпопуляционного состава лимфоцитов периферической крови проводилось методом проточной цитофлуориметрии на цитометре EPICS XL (BeckmanCoulter). Наряду со стандартной панелью иммунного статуса определяли уровни циркулирующих лимфоцитов, экспрессирующих цепи рецепторов ИФН-α/β и ИФН-γ (CD118+, CD119+); проводили инструментальные исследования: УЗИ органов брюшной полости, фиброэластометрию, а также пункционную биопсию печени (ПБП) с определением степени стеатоза печени. Для оценки степени жировой дистрофии печени предложены критерии единой шкалы D.E. Kleiner CRN (2005 г.) — процентное содержание жировой ткани в гепатоцитах: менее 5% — стеатоз отсутствует, 5–33% — стеатоз I степени, 33–66% — II степени и более 66% — III степени [10].
Критерии включения в исследование: лица старше 18 лет с диагнозом ХГС, наличие добровольного информированного согласия на обследование и лечение, отсутствие ПВТ в анамнезе. Критерии исключения: алкоголизм, наследственные и генетические заболевания, заболевания печени, беременность, микст-гепатиты и коинфекция, отказ от проведения исследования и лечения. Статистическую обработку результатов осуществляли средствами стандартного статистического пакета SPSS-20, IBM и Microsoft Excel. Проверку гипотез о различиях исследуемых совокупностей осуществляли по статистическому критерию Стьюдента с одновременной проверкой равенства дисперсий. Критический уровень значимости всех параметров в исследовании был принят равным 5%. Частотный анализ номинальных (качественных) признаков определяли с помощью таблиц сопряженности с оценкой значимости по критерию хи-квадрат (χ2) Пирсона.
Результаты и обсуждение
В группе наблюдения мужчины составили 64%, женщины — 35%. Индекс массы тела (ИМТ) у мужчин (28,6±0,4 кг/м2) превышал данный показатель у женщин (26,4±0,5 кг/м2, р=0,024), тогда как женщины были достоверно старше мужчин (40,5±1,2 против 36,7±0,9, р=0,042). Существенных различий по результатам общего анализа крови не выявлено, за исключением уровня лейкоцитов, который был выше у мужчин (р=0,05), чем у женщин, и оставался в пределах нормы. Уровень гамма-глутамилтранспептидазы (ГГТП) у мужчин (84,1±5,9 Е/л) почти в 2 раза превышал этот показатель у женщин (49,5±5,5 Е/л, р=0,001). Выявлены более высокие значения АЛТ (р=0,001), сывороточного железа (р=0,049) и холестерина (р=0,001) у лиц мужского пола. В ходе обследования больных ХГС установлено, что преобладали пациенты с минимальным фиброзом F0–1 — 50,4% случаев (126 человек), фиброз F2 выявлен в 27,2% случаев (68 человек), F3 — в 12% случаев (30 человек) и F4 — в 10,4% (26 человек). Основные показатели в зависимости от стадии фиброза представлены в таблице 1.
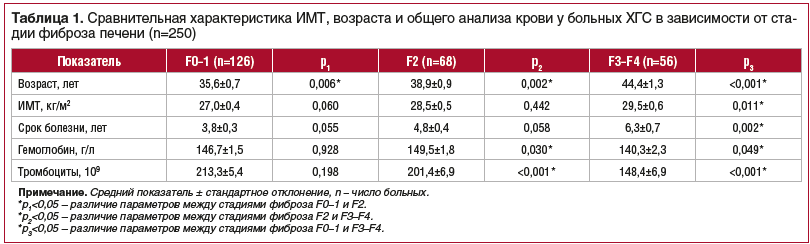
При определении генотипа вируса ХГС выявлены: 1 генотип в 57,6% случаев (144 больных), 2 генотип в 7,6% случаев (19 больных) и 3a генотип в 34,8% случаев (87 больных). У мужчин преобладал 1 генотип вируса: 48,1% случаев против 35,0% у женщин (р<0,05). Значительно чаще регистрировался 3 генотип у женщин: 48,3% случаев против 39,8% у мужчин (р<0,05). Уровень вирусной нагрузки у мужчин и женщин не имел достоверных различий (р=0,150).
Прогрессирование фиброза печени у больных ХГС влияло не только на активность трансаминаз, но также и на липидный и углеводный обмен. Так, уровень триглицеридов крови был минимальным на стадии фиброза F0–1 и составил 1,5±0,1 ммоль/л, а при стадии фиброза F2 — 1,9±0,1 (р<0,001). Максимальные значения определялись на стадии F3–F4 (2,7±0,2 ммоль/л, р<0,001). У 214 (85,6%) больных ХГС были выявлены сопутствующие заболевания ЖКТ, из них в 55,4% случаев обнаружена неалкогольная жировая болезнь печени (НЖБП) по результатам ПБП. Отмечается, что среди больных ХГС с «не 1» генотипом стеатоз печени выявлен в 56,8% случаев и достоверно чаще, чем при 1 генотипе. При этом степень стеатоза печени прогрессировала пропорционально стадии фиброза у больных ХГС (табл. 2). По результатам ПБП и оценки степени жировой дистрофии печени стеатоз отсутствовал (S0) у 42% (105 человек), выявлен стеатоз I степени (S1) у 32,8% (82 человека), II степени (S2) — у 20% (50 человек) и III степени (S2) — у 5,6% (14 человек). Прогрессирование фиброза печени у больных ХГС сопровождалось более частым выявлением жировой дистрофии, а на стадии фиброза F3–F4 стеатоз печени выявлен у 89,3% больных.
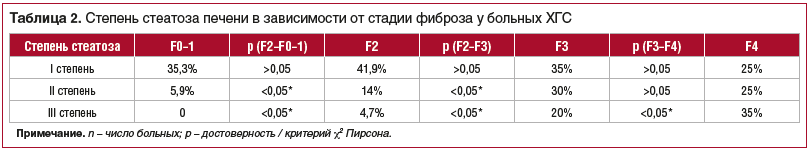
Существенных различий показателей в группах больных ХГС при отсутствии стеатоза и I степени жировой дистрофии не выявлено, за исключением ИМТ, который достоверно увеличивался при прогрессировании НЖБП. Так, при S0 ИМТ=26,6±0,4 (р=0,003), а при S1 и S2 — ИМТ=28,7±0,5 и 29,2±0,6 соответственно (р=0,001). Выраженные биохимические изменения отмечены у больных ХГС с жировой дистрофией II и III степени. Так, активность ферментов АЛТ, АСТ, ГГТП у них значительно выше (р<0,05), чем у больных без НЖБП. Степень воспаления в ткани существенно выше при наличии стеатоза печени, чем при его отсутствии (р=0,007). На основании проведенных исследований было сделано заключение, что повышение уровней триглицеридов, холестерина и ЛПНП и снижение количества ЛПВП могут отвечать за развитие НЖБП и инсулинорезистентности.
Диагностировать стеатоз печени I степени по лабораторным показателям у больных ХГС крайне сложно, т. к. достоверные различия выявлены только по уровню триглицеридов: при S0 — 1,3±0,07, а при S1 — 1,8±0,1 (р<0,001). Установлена прямая умеренная корреляция между степенью стеатоза и стадией фиброза (ρо=0,501, р<0,001). У больных ХГС с 3 генотипом чаще выявлено ожирение и гипертриглицеридемия. ХГС сопровождается не только нарушением липидного, но и углеводного обмена. Сахарный диабет 2 типа выявлен у 16,7% (42 человека), и достоверно чаще он регистрировался при стадии фиброза печени F3–F4 (р<0,01) (табл. 3).

У больных ХГС, отягощенным НЖБП, достоверно чаще выявляется выраженный фиброз печени — F3–F4 (до 89% случаев), чем в группе пациентов без стеатоза печени (р=0,009). Наши данные согласуются с результатами, полученными другими исследователями [11], доказавшими, что формирование стеатоза печени сопряжено с 3 генотипом вируса и превышением в 2 раза относительного риска его возникновения, чем у больных ХГС с 1 генотипом (ОР 2,0; 95% ДИ 1,4–2,97), при этом на фоне стеатоза печени регистрируются высокие показатели С-реактивного белка [11].
Безусловно, метаболические нарушения у больных ХГС значительно отягощают течение заболевания, требуют более тщательного и углубленного медицинского обследования перед назначением лечения. Пациентам с таким неблагоприятным коморбидным фоном необходим персонифицированный подход с учетом образа жизни, рациона питания и разгрузочно-диетической терапией, а также более расширенный лабораторный мониторинг, а при назначении ПВТ предпочтительны препараты прямого противовирусного действия.
С учетом выявленных корреляций степени стеатоза и стадии фиброза печени, а также существенного влияния НЖБП на естественное течение HCV-инфекции выбрана группа из числа больных ХГС с нормальным ИМТ и отсутствием жировой дистрофии печени для исследования влияния иммунологических параметров на течение заболевания (табл. 4). В результате исследования пациентов с ХГС выявлено несколько новых лабораторных закономерностей в характере иммунологических сдвигов в зависимости от стадии фиброза печени, требующих осмысления и более детального изучения.
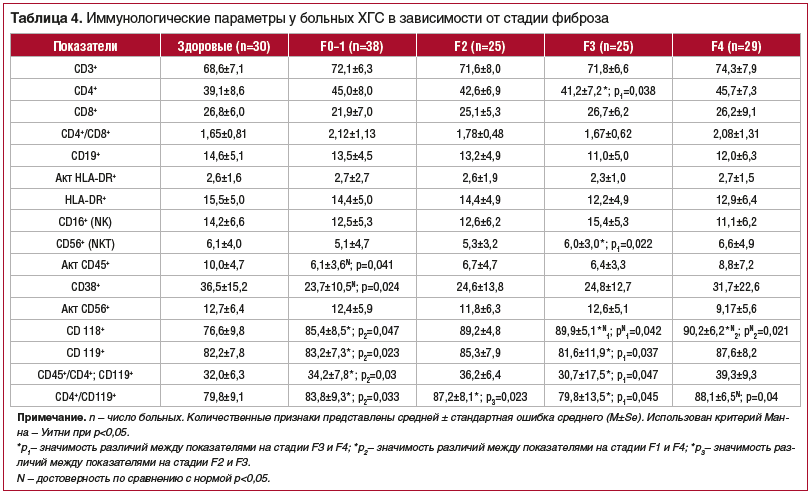
Анализ зависимости показателей иммунитета от стадии фиброза печени показал, что при стадии фиброза F3–F4 отмечалось достоверное уменьшение как процентного, так и абсолютного количества цитотоксических лимфоцитов по сравнению с его уровнем при фиброзе F1–F2 (р=0,031; р=0,021). За счет этого выявлено значимое увеличение иммунорегуляторного индекса при фиброзе F3–F4 (р=0,041). Уменьшение количества цитотоксических Т-лимфоцитов и увеличение за счет этого иммунорегуляторного индекса при стадии фиброза F3–F4 свидетельствуют о недостаточности ЦТЛ, что может стимулировать процесс фиброзирования. Уменьшение процентного содержания CD8+ с увеличением длительности гепатита и возрастание процентного содержания CD19+ при длительности ХГС больше 10 лет свидетельствуют о формировании иммунного ответа по Th2-типу. Множественные сравнения показателей иммунного статуса больных ХГС с разной стадией фиброза выявили различия по субпопуляции CD16+/CD56+-клеток (NKT), относительное количество которых возрастало вместе с выраженностью фиброза (R=0,451, p=0,008), обнаружено достоверное превышение этого показателя у больных с фиброзом F4 в сравнении с таковым у пациентов с F0–1 (p=0,024, критерий Манна — Уитни).
Анализ иммунного статуса больных ХГС со стадией фиброза F0–1 характеризуется незначительным повышением общего количества Т-лимфоцитов и Т-хелперов на фоне снижения общего количества цитотоксических лимфоцитов. Наблюдается незначительное повышение активированных Т-клеток с фенотипом HLA-DR+. Уровень NK-клеток и активированных Т-лимфоцитов с маркером NK-клеток (NKT-клетки) ниже, чем у пациентов из контрольной группы. Выявлены достоверные различия уровня циркулирующих лимфоцитов, экспрессирующих цепь 2-го рецептора ИФН-α/β (CD118+) и α-цепи рецептора ИФН-γ (CD119+) по сравнению с больными с F4 (p=0,041 и p=0,023 соответственно). Отмечается достоверное повышение уровня лимфоцитов CD4+/CD119+ среди всех CD45+, несущих α-цепи рецептора ИФН-γ (CD45+/CD4+/CD119+), и доли лимфоцитов, продуцирующих γ-ИФН (CD4+/CD119+) уже на стадии F2 (р=0,023) и F3 (р=0,045) с максимальными значениями CD4+/CD119+ при выраженном фиброзе (F4), значимо отличающимися в сравнении со здоровыми и пациентами с F2 (p=0,04 и p=0,033 соответственно).
На стадии фиброза печени F3 продолжает нарастать уровень Т-лимфоцитов. Уровень цитотоксических Т-клеток и иммунорегуляторный индекс постепенно нарастают и на этой стадии возвращаются к нормальным значениям. Наблюдается нарастание количества NK- и NKT-клеток, а также уровень CD4+, CD56+ и CD38+. Уровень циркулирующих лимфоцитов, экспрессирующих цепь 2-го рецептора ИФН-α/β (CD118+), достоверно выше, чем в контрольной группе (p=0,042).
Выраженный фиброз печени (F4) иммунологически характеризуется достоверным повышением количества Т-хелперов в сравнении со стадией F3 (p=0,038). Уровень NKT-клеток достоверно ниже, чем при F3 (p=0,022). Наблюдается достоверное нарастание уровня лимфоцитов, экспрессирующих α-цепи рецептора ИФН-γ (CD119+), в сравнении с группами больных с F1 и F3 (p=0,023 и p=0,037 соответственно). Отмечается достоверное увеличение количества CD45+/CD4+/CD119+ в сравнении с F3 (p=0,047). Уровень Т-лимфоцитов, продуцирующих ИФН-γ (CD4+CD119+), достоверно выше, чем у здоровых (p=0,040), а также в сравнении с показателями больных ХГС со стадией фиброза F1 и F3 (p=0,033 и p=0,045 соответственно).
Таким образом, исследование иммунного статуса больных ХГС в зависимости от стадии фиброза выявило значимые изменения субпопуляции клеток CD16+/CD56+, CD3+/CD118+, CD3+/CD119+, CD4+/CD119+, количество и активность которых возрастали вместе с выраженностью фиброза и могут рассматриваться как критерии прогноза прогрессирования заболевания.
Заключение
Выявленные взаимосвязи некоторых параметров иммунного статуса и стадии фиброза печени позволяют использовать уровни CD118+ и CD119+ как дополнительные иммунологические маркеры прогнозирования выраженного фиброза печени у больных ХГС. Метаболические нарушения значительно утяжеляют течение ХГС и достоверно чаще ассоциируются с прогрессированием стадии фиброза, что требует индивидуального подхода, тщательного и углубленного обследования для определения тактики ведения больных.
Информация с rmj.ru




