Содержание статьи
- 1 Введение
- 2 Клеточно-молекулярный механизм адаптации к патологической гипоксии
- 3 Перекрест сигнальных путей HIF и NF-kВ
- 4 HIF — основной регулятор метаболической функции иммунных клеток
- 5 HIF-зависимая регуляция митохондрий
- 6 Возможные регуляторы экспрессии HIF
- 7 Возможные терапевтические подходы на основе HIF-регулирования
- 8 Заключение
Введение
При многих патологических состояниях, в частности хронических воспалительных заболеваниях легких, легочном фиброзе, хронической дыхательной недостаточности и др., нарушается баланс между потребностью клеток в кислороде и его доставкой, что осложняет течение заболеваний и часто становится потенцирующим фактором их прогрессирования. Дефицит кислорода, конечного акцептора электронов в митохондриальной электронтранспортной дыхательной цепи, приводит к подавлению биоэнергетической функции митохондрий, снижению продукции макроэргических молекул аденозинтрифосфата (АТФ) и нарушению обеспечения энергией многочисленных физиологических процессов. Микроокружение в участках воспаления часто приобретает гипоксический характер (так называемая воспалительная гипоксия) [1–3]. Потребление кислорода возрастает в очагах воспаления из-за высокой метаболической потребности мигрирующих воспалительных клеток (нейтрофилов, моноцитов), локальной клеточной пролиферации и активации экспрессии множества оксигеназ [2]. Патологическая гипоксия может стимулировать дисфункцию ткани и развитие заболевания посредством дисрегуляции иммунных клеток [4, 5]. Недавно стало ясно, что гипоксия, являясь следствием воспаления, в свою очередь, сама может активно воздействовать на воспалительные процессы посредством регуляции чувствительных к кислороду сигнальных путей во множественных подтипах иммунных клеток [5, 6].
Клеточно-молекулярный механизм адаптации к патологической гипоксии
Основным регулятором клеточного ответа на дефицит кислорода считается семейство гипоксией индуцируемых факторов (hypoxia inducible factors, HIFs) [4, 7, 8]. Открытие HIF-опосредованного молекулярного механизма клеточной адаптации к недостатку кислорода послужило основанием для присуждения трем исследователям (W.G. Kaelin, G.L. Semenza, P.J. Ratcliffe) Нобелевской премии в области физиологии и медицины за 2019 г. Формирование долгосрочной адаптации к недостаточному снабжению клеток кислородом генетически детерминировано и сопряжено с экспрессией специфического белкового фактора HIF, который выполняет функцию активатора транскрипции и ключевого регулятора различных клеточных и системных ответов на гипоксию [9].
HIF представляет собой гетеродимерный ДНК-связывающий транскрипционный фактор, состоящий из лабильной субъединицы HIFα и стабильно экспрессируемой субъединицы HIF-1β, также известной как ядерный транслокатор арильных углеводородных рецепторов (ARNT). HIF представлен во всех типах клеток. Субъединица HIF-1β/ARNT участвует в ряде процессов, не связанных с гипоксией, тогда как α-субъединица является гипоксически-регулируемым компонентом. При нормоксии HIFα в небольшом количестве обнаруживается в цитоплазме, но при гипоксии ее содержание резко возрастает и определяется исключительно в ядре. Идентифицированы три изоформы субъединицы HIFα (HIF-1α, HIF-2α, HIF-3α), различающиеся по наборам генов-мишеней и функциям, выполняемым в клетке [10]. Роль недавно обнаруженной изоформы HIF-3α в клеточном ответе на гипоксию пока не ясна [6, 11, 12].
Кислородозависимая регуляция субъединицы HIFα происходит на посттранскрипционном уровне и опосредуется семейством диоксигеназ (HIF-гидроксилазы), которое включает три пролилгидроксилазы (PHD1, 2, 3) и аспарагин-гидроксилазу — фактор, ингибирующий HIF (FIH) [7, 13]. В условиях нормоксии, когда снабжение клеток кислородом превышает потребность, пролилгидроксилазы гидроксилируют HIF и направляют его на опосредованное убиквитин-E3-лигазой фон Гиппеля — Линдау (рVHL) убиквитинирование с последующей протеасомной деградацией (рис. 1). Ген, кодирующий белок VHL, входит в число важнейших генов — супрессоров опухолей. Помимо убиквитинирования, рVHL может блокировать HIF, привлекая к нему белки-репрессоры, препятствующие активации транскрипции генов-мишеней. Еще один механизм подавления HIF обеспечивается фактором, ингибирующим HIF, который гидроксилирует HIFα по остатку аспарагина, препятствуя взаимодействию HIFα с белками-коактиваторами транскрипции (CBP и p300), вследствие чего заметно снижается уровень активации транскрипции генов-мишеней [5, 13].
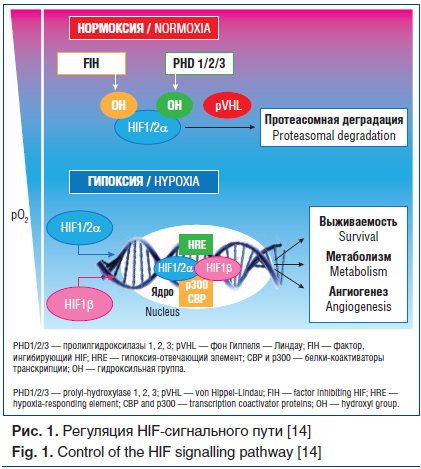
Бóльшая часть клеточного потребления кислорода при нормоксии происходит в митохондриях во время генерации молекул АТФ посредством окислительного фосфорилирования, но имеется некоторый запас немитохондриального кислорода, от наличия которого и зависит деградация субъединиц HIFα. Реакции гидроксилирования происходят при непосредственном участии молекулярного кислорода, а также ионов железа (Fe2+) и α-кетоглутарата. При недостатке любого из этих компонентов реакция гидроксилирования становится невозможной, взаимодействие HIFα с белком VHL прекращается, что приводит к увеличению содержания белка HIFα.
Полноценный клеточный ответ на гипоксию развивается при снижении напряжения кислорода (рО2) примерно на 1% нормы и ниже. При этих значениях рО2 и отсутствии немитохондриального кислорода HIF-гидроксилазы теряют свою активность, что приводит к стабилизации субъединиц HIFα и образованию стабильных димеров HIF в результате соединения с HIF-1β в ядре (см. рис. 1). Описаны две основные транскрипционно активные изоформы димеров HIF (HIF1 и HIF2), которые содержат наряду с HIF-1β либо субъединицу HIF-1α, либо субъединицу HIF-2α и имеют различные, но во многом перекрывающиеся наборы экспрессируемых генов-мишеней. Образовавшиеся димеры HIF связываются с белками-коактиваторами транскрипции CBP/p300, инициируя формирование функционально активного транскрипционного комплекса [5, 13]. После сборки комплекс HIF связывается с отвечающим на гипоксию элементом (HRE) генома — пентануклеотидной последовательностью ДНК, которая присутствует в промоторах генов-мишеней HIF (см. рис. 1). Таким образом, стабилизация HIFα является начальным этапом запуска канонического пути HIF и позволяет клетке осуществлять транскрипционную программу, регулируя «гипоксические» гены, участвующие в гипоксическом сигналинге [13].
Исследованиями последних лет установлено, что HIFs, индуцируя транскрипцию более 300 генов, являются центральными регуляторами многих врожденных и адаптивных иммунологических функций, включая ангиогенез, пролиферацию, миграцию, регенерацию, презентацию антигенов, продукцию цитокинов и антимикробных пептидов, фагоцитоз, аутофагию и апоптоз, клеточное метаболическое перепрограммирование [7, 14, 15]. HIF1 способствует гликолизу и подавляет окислительное фосфорилирование; HIF1 и HIF2 стимулируют сосудистый эндотелиальный фактор роста VEGF и выживаемость клеток, усиливают экспрессию и транскрипцию эндотелина-1 и ангиотензинпревращающего фермента [5, 16]. Установлено, что неканонический сигнальный путь HIF участвует в регуляции других сигнальных каскадов: Notch, c-Myc, p53, NF-kB и др. [6].
Перекрест сигнальных путей HIF и NF-kВ
Воспаленная слизистая бронхов представляет собой гипоксическую среду, для которой характерно увеличение экспрессии HIF-1a [17, 18]. Активация HIF-1a подавляет врожденные иммунные механизмы защиты, присущие клеткам бронхоальвеолярного эпителия [19], усиливает апоптоз альвеолоцитов 2 типа, препятствуя заживлению эпителия после повреждения, изменяет профиль генной экспрессии альвеолоцитов 2 типа и угнетает экспрессию сурфактантных протеинов [20]. Тесное, перекрестное взаимодействие существует между HIF-сигналингом и сигнальной системой ядерного транскрипционного фактора kВ (NF-kB), одного из основных регуляторов воспаления и иммунных реакций [5, 17]. Эти сигнальные пути имеют общие стимулы, общие регуляторы и гены-мишени [6, 21]. Пролилгидроксилазы, которые регулируют HIF, также обеспечивают чувствительность к гипоксии сигнального пути NF-κB посредством кислородозависимого гидроксилирования его ключевых компонентов [5, 22]. Повышенная каноническая активность NF-κB, которая вызывается цитокинами или бактериальными лигандами (например, липополисахаридом), способствует транскрипции мРНК HIF-1α, стимулируя тем самым активность HIF в условиях хронического воспаления [5]. Исследования in vitro показали, что HIF-1α активирует NF-κB, который в свою очередь контролирует транскрипцию HIF-1α из генома. Активация HIF-1α может происходить одновременно с ингибированием NF-κB [5, 21]. Гипоксическая активация NF-κB опосредована киназой IκB (IKK) и TGFβ-активированной киназой. Киназный комплекс фосфорилирует ингибитор IκB, что приводит к его деградации и высвобождению/транслокации димеров NF-κB в ядро. HIF-ингибирующие факторы способны снижать активность воспалительной киназы IKK и подавлять воспаление [1]. Истощение HIF-1α в клетках млекопитающих приводит к увеличению транскрипционной активности NF-κB [21]. Таким образом, HIF-1α предотвращает чрезмерную активацию NF-κB-провоспалительных реакций, способных оказать повреждающее действие на ткани. С другой стороны, NF-κB является прямым модулятором экспрессии HIF-1α при воспалении.
Примером перекреста сигнальных путей HIF и NF-κB может служить их взаимодействие при хронической обструктивной болезни легких (ХОБЛ), для которой характерно персистирующее воспаление [23]. На модели ХОБЛ, созданной у крыс, блокирование транскрипционной активности NF-κB путем ингибирования IkB-киназы с помощью целекоксиба (селективного ингибитора циклооксигеназы-2) сопровождалось снижением экспрессии NF-κB-регулируемых генов, к числу которых относится HIF-1α, о чем свидетельствовало уменьшение содержания белка HIF-1α в бронхоальвеолярной лаважной жидкости (БАЛЖ) [24]. Возможный механизм торможения HIF-сигнального пути представлен на рис. 2. В цитоплазме NF-kB находится в неактивном состоянии в комплексе с ингибиторным белком IkBa. Под влиянием воспалительного стимула происходит фосфорилирование IkBa (IkBa-р) специфической IkB-киназой с последующей деградацией ингибиторного белка убиквитинпротеасомной системой. Свободный NF-kB поступает в ядро и активирует транскрипцию контролируемых генов, в данном случае HIF-1α и циклооксигеназы-2 (сyclooxygenase-2, СОХ-2). Ингибирование IkB-киназы (-), опосредованное целекоксибом, блокирует транскрипционную активность NF-kB, вследствие чего подавляется экспрессия генов HIF-1α и СОХ-2 и продукция соответствующих белков.
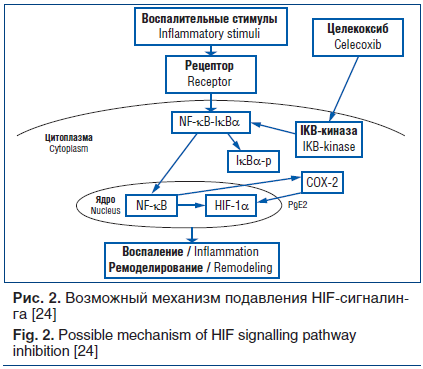
Следствием ингибирования активности гипоксийного сигналинга было снижение содержания провоспалительного цитокина интерлейкина (IL) 17 в БАЛЖ, нейтрофильно-лимфоцитарного воспаления и восстановление структуры бронхоальвеолярного эпителия и его функциональной активности [24]. Результаты исследования подтвердили существование функциональной связи HIF-1α- и NF-κB-сигнальных каскадов, обеспечивающих интеграцию воспалительных и гипоксических регуляторных механизмов в патогенезе заболеваний дыхательных путей, что может стать основой для нового подхода к патогенетическому лечению ХОБЛ. Крайне сложное перекрестное взаимодействие двух важнейших сигнальных систем представляет значительные трудности для изучения, но очень важно для определения механизмов этого взаимодействия при заболеваниях, при которых гипоксическое воспаление является преобладающим фактором, а также для разработки новых терапевтических стратегий.
HIF — основной регулятор метаболической функции иммунных клеток
Основной механизм, с помощью которого HIF регулирует эффекторную функцию иммунных клеток, а следовательно, влияет на развитие воспаления, заключается в контроле клеточного метаболизма [14, 25–27]. Мигрируя в очаги воспаления из сосудистого русла, иммунные клетки оказываются в гипоксическом микроокружении и должны соответствующим образом адаптироваться. Контролируемый HIF-сигнальной системой гликолиз является основным источником продукции АТФ в гранулоцитах [26]. HIF-сигналинг — один из ключевых ассоциированных с митохондриями механизмов клеточной регуляции. Обе изоформы, HIF-1α и HIF-2α, одинаково уменьшают зависимость клетки от митохондриального окислительного фосфорилирования, подавляя цикл трикарбоновых кислот и стимулируя ремоделирование клеточного метаболизма в сторону увеличения анаэробной продукции АТФ [28–30].
Гипоксия является общей чертой микросреды физиологических и патологических иммунологических ниш [5]. При физиологической гипоксии HIF способствует гомеостазу врожденных и адаптивных иммунных клеток, тогда как при патологической гипоксии передача сигналов HIF может вызывать повреждение тканей и дисфункцию иммунных клеток [5]. HIF оказывает специфическое влияние на экспрессию генов различных типов иммунных клеток и присущую им эффекторную функцию [3, 4]. В нейтрофилах HIF играет ключевую роль в регуляции продолжительности жизни, продукции антимикробных пептидов и апоптозе [31, 32]. Активация HIF-сигнального пути в нейтрофилах мыши и человека увеличивает их выживаемость, экспрессию β2-интегрина, продукцию антимикробных пептидов и экспрессию ключевых гликолитических ферментов [26, 31, 32]. Отсутствие HIF-1α в нейтрофилах ингибирует генерацию АТФ, что приводит к ухудшению воспалительного ответа из-за уменьшения агрегации и подвижности нейтрофилов, снижает их способность проникать в ткани и убивать бактерии.
HIF-сигналингу принадлежит важная роль в регуляции фенотипической поляризации макрофагов (M1 и M2) [32]. Делеция гена HIF-1α нарушает выработку АТФ, что отрицательно влияет на выживаемость, инвазию, подвижность, агрегацию и бактерицидную активность макрофагов [32]. Показано, что HIF-1α усиливает миграцию макрофагов в очаг заражения, увеличивая экспрессию рецептора хемокина CXCR4 и уменьшая экспрессию рецептора хемокина CCR5 [14]. Мишенью для HIF-1α является IL-8. Увеличение секреции этого цитокина альвеолярными макрофагами рассматривается как фактор риска быстрого развития острого респираторного дистресс-синдрома. Современные данные свидетельствуют о том, что HIF-опосредованное метаболическое перепрограммирование участвует в активации, дифференцировке, пролиферации, миграции и апоптозе дендритных клеток [14, 31, 33]. HIF является важным регулятором синтеза интерферона-γ (IFN-γ), а также продукции IL-22 и IL-10 в дендритных клетках человека и мыши [14]. В условиях гипоксического микроокружения в дендритных клетках усиливается экспрессия рецепторов хемокинов, привлекающих нейтрофилы [14, 31].
HIF-1α играет ключевую роль в регуляции выживания в Т-клетках человека, что затем было подтверждено на мышиных моделях с нокаутами HIF-1α и рVHL [14]. HIF-1α-сигналинг контролирует метаболическое перепрограммирование, дифференцировку и функцию регуляторных (Treg) клеток, а также баланс Th17/Treg-клеток, имеющий значение для патогенеза аутоиммунных заболеваний [14, 34]. Активация HIF-1α в CD8+-T-клетках способствует гликолитическому метаболизму, который необходим для эффекторной функции и генерации популяции CD8+-T-клеток с противоопухолевой активностью [35]. Гликолитический метаболизм в CD8+-T-клетках, вызванный условным нокаутом гена VHL, способствует ускоренной дифференцировке долгоживущих эффекторных CD8+-T-клеток памяти против вирусной инфекции [36]. В исследовании А. Palazon et al. [37] гипоксия и сигнальный путь HIF влияли на инфильтрацию опухоли цитотоксическими Т-клетками, а делеция гена HIF-1α приводила к уменьшению инфильтрации и снижению киллинга опухолевых клеток. В условиях гипоксии сигнальная система HIF усиливает гликолитический метаболизм в В-лимфоцитах, что влияет на их развитие, пролиферацию, апоптоз и выработку высокоаффинных антител [14, 38].
Стабилизация HIF-1α играет существенную роль в выживании и функционировании эозинофилов и тучных клеток. Активация сигнального пути HIF-1α индуцирует синтез провоспалительных цитокинов IL-8 и TNFα тучными клетками после стимуляции лигандами Toll-подобных рецепторов и экспрессию гена гистидиндекарбоксилазы, катализируя образование гистамина [14]. В тучных клетках бронхиального эпителия активация HIF-1 стимулирует экспрессию VEGF, приводя к повышенной проницаемости сосудов, экстравазации белка в альвеолярное пространство и отеку дыхательных путей [14]. HIF-1α и HIF-2α контролируют хемотаксис эозинофилов, участвуя в патогенезе бронхиальной астмы [39]. HIF-1α-сигналинг поддерживает базофильную активность в процессе хронического воспаления [40]. Недавние исследования выявили связь между HIF и образованием внеклеточных ловушек тучных клеток и нейтрофилов, обеспечивающих антимикробную защиту [41, 42].
HIF-зависимая регуляция митохондрий
Регуляция HIF может быть опосредована митохондриями, поскольку активные формы кислорода (АФК), продуцируемые комплексами электронтранспортной дыхательной цепи, могут ингибировать его деградацию. Митохондриальные АФК необходимы для стабилизации белка HIF-1α при гипоксии [43]. Показано, что применение антиоксиданта эбселена, поглощающего АФК, предотвращает стабилизацию HIF-1α и его связывание с отвечающим на гипоксию элементом генома [44]. Предполагается, что механизм, с помощью которого АФК приводят к стабилизации HIF, обусловлен их влиянием на окислительно-восстановительное состояние кофактора железа в активном центре домена пролилгидроксилазы [44]. При окислении АФК железа до трехвалентного состояния (Fe3+) снижается гидроксилирование HIF-1α и его узнавание белком VHL. При воспалении выработка АФК повышена, и механизмы эндогенной антиоксидантной защиты могут оказаться несостоятельными, что приводит к оксидативному стрессу, влияющему на профиль активности HIF в клетках и их эффекторную функцию. АФК модулируют путь HIF, однако механизмы, с помощью которых АФК регулируют экспрессию и активность HIF, до конца не ясны [43, 44].
Возможные регуляторы экспрессии HIF
Активность HIF может стимулироваться семейством чувствительных к стрессу гистоновых деацетилаз, которые влияют на транскрипцию генов, метаболизм, репарацию ДНК и продолжительность жизни, действуя в качестве датчиков окислительно-восстановительного состояния клеток [45].
В качестве возможных регуляторов уровней экспрессии HIF активно изучается роль малых некодирующих РНК (микроРНК) [46]. Исследования последних лет свидетельствуют о том, что мишенью HIF-опосредованного восприятия клеточного стресса является фактор транскрипции Forkhead box O3 (FOXO3a) [47]. FOXO3a рассматривается как основной регулятор клеточного гомеостаза, поскольку может модулировать различные стрессовые реакции на дефицит питательных веществ, окислительный стресс, гипоксию, повреждение ДНК и пр. Было показано, что HIF-активация FOXO3a происходит на уровне транскрипции, поскольку подавление экспрессии гена HIF-1α снижает уровни мРНК и белка FOXO3a [47]. Гипотеза о том, что FOXO3a является прямой мишенью для HIF, подтверждается данными о взаимодействии белок-белок между FOXO3a и HIF-1α, а также наличием в FOXO3а промоторе трех консервативных HIF-связывающих сайтов, называемых элементами, отвечающими на гипоксию (hypoxia-response element — HRE) [47].
Возможные терапевтические подходы на основе HIF-регулирования
Вмешательство в сигнальную систему HIF может быть потенциальным терапевтическим подходом для контроля воспаления, расстройств, связанных с иммунитетом и злокачественным ростом. Пока все сведения о физиологическом и терапевтическом потенциале HIF-сигналинга получены из доклинических исследований. Предложено множество белковых факторов для модуляции путей HIF, но их применение для HIF-таргетной терапии ограничено. Одна из главных причин такого положения — тесное, многоуровневое, перекрестное взаимодействие HIF-сигнального пути с другими сигнальными системами организма, участвующими в регуляции воспаления, иммунитета, метаболизма, регенерации и т. д. Учитывая многофункциональность HIF как регуляторного сигнального пути, в зависимости от вида патологии необходимо искать различные способы фармакологического контроля, нацеленные либо на активацию, либо на подавление HIF-сигналинга.
Существует ряд фармакологических вариантов вмешательства в сигнальный путь HIF. Наиболее изученными из них являются ингибиторы гидроксилазы, которые активируют путь HIF блокированием гидроксилирования HIF. В доклинических исследованиях было показано, что ингибиторы HIF-гидроксилаз могут эффективно уменьшать выраженность воспаления [4]. На модели пневмонии, вызванной у мышей Pseudomonas aeruginosa, применение ингибитора HIF-гидроксилазы диметилоксалилглицина за 48 ч до заражения уменьшало интернализацию бактерий в эпителиальные клетки и значительно снижало смертность [48]. Ингибиторы HIF-гидроксилазы предохраняли от развития стерильного сепсиса, который был вызван введением мышам бактериального липополисахарида, но усугубляли летальный исход от бактериального сепсиса [49]. Недавно было показано, что микроРНК, которые эндогенно регулируют экспрессию генов посредством РНК-интерференции, играют ключевую роль в переключении сигнальных систем, реагирующих на гипоксию, что открывает новые терапевтические возможности для селективного модулирующего воздействия на HIF [50]. Влияние специфических фармакологических ингибиторов HIF-сигнального пути на воспаление и иммунитет практически не изучено, но представляет направление потенциально высокой терапевтической значимости. В опытах на модели ХОБЛ ингибирование HIF достигалось торможением активации NF-κB-сигналинга и экспрессии NF-κB-регулируемых генов, в т. ч. HIF-1α, что предотвращало деструкцию бронхоальвеолярного эпителия, аномальное ремоделирование дыхательных путей и легочной ткани, позволяло сохранить защитную и барьерную функцию бронхиального эпителия [24].
Заключение
Индуцируемый гипоксией транскрипционный фактор-1 является важнейшим фактором, отвечающим за регуляцию экспрессии генов при патологических состояниях, связанных с клеточным энергодефицитом. При многих заболеваниях легких (ХОБЛ, хронической дыхательной недостаточности и др.) нарушается баланс между потребностью клеток в кислороде и его доставкой, что осложняет течение заболеваний и потенцирует их прогрессирование. Исследования последних лет, направленные на изучение механизмов HIF-опосредованной адаптации клеток к гипоксии и на поиск способов регуляторного воздействия на активность HIF-сигнального пути, способствуют пониманию патогенеза многих патологических процессов, особенно сопряженных с воспалением, и открывают возможности для разработки новых терапевтических подходов к их профилактике и лечению на основе таргетного фармакологического воздействия на HIF-1α.
Сведения об авторах:
Титова Ольга Николаевна — д.м.н., профессор, директор, ORCID iD 0000-0003-4678-3904;
Кузубова Наталия Анатольевна — д.м.н., заместитель директора по научной работе, ORCID iD 0000-0002-1166-9717;
Лебедева Елена Сергеевна — к.б.н., ведущий научный сотрудник, ORCID iD 0000-0001-6887-0166.
НИИ пульмонологии ПСПбГМУ им. акад. И.П. Павлова. 197022, Россия, г. Санкт-Петербург, ул. Л. Толстого, д. 6–8, корп. 44.
Контактная информация: Кузубова Наталия Анатольевна e-mail: kuzubova@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 19.03.2020.
.
Информация с rmj.ru

