Содержание статьи
- 1 Введение
- 2 Патогенез РОС
- 3 Методы лечения РОС
- 4 Пневморетинопексия
- 5 Эписклеральное пломбирование
- 6 Pars plana витрэктомия
- 7 Сравнительный анализ эффективности различных методов лечения РОС
- 8 Пневморетинопексия и витрэктомия
- 9 Эписклеральное пломбирование и витрэктомия
- 10 Микроинвазивные технологии лечения РОС
- 11 Комбинированная микроинвазивная лазер-хирургическая технология
- 12 Заключение
Введение
Регматогенная отслойка сетчатки (РОС) — тяжелое заболевание органа зрения, которое при отсутствии лечения приводит к слабовидению и слепоте. Распространенность заболевания составляет 6,3–17,9 на 100 000 населения в год [1]. При этом инвалидность пациентов с отслойкой сетчатки составляет 2–9% среди всех причин инвалидности по зрению. Первые шаги в лечении РОС датируются 1923 г., когда Gonin выявил, что возникновение заболевания может быть связано с наличием разрыва в сетчатке, и впервые достиг прилегания сетчатки путем проведения термокоагуляции через трепанационное отверстие в склере [2]. Затем были предложены следующие хирургические техники: эписклеральное пломбирование (ЭП), при котором на склеру устанавливается пломба, pars plana витрэктомия (ППВ) c частичным или полным удалением стекловидного тела, пневморетинопексия (ПР), при которой используется расширяющийся газ для придавливания отслоенной части сетчатки к прилежащим слоям [3–5]. Модифицированные версии этих трех техник являются классическими общепризнанными вариантами лечения РОС и в настоящее время. По данным различных авторов, применение указанных методов лечения высокоэффективно — достигается полное прилегание отслоенной сетчатки [6–8]. Важно отметить, что, несмотря на высокие анатомические результаты применения данных методов, не была достигнута согласованность относительно того, какой подход можно считать «золотым стандартом» в лечении РОС. Причинами данной несогласованности являются вариация функциональных исходов заболевания, развитие осложнений и рецидивов в зависимости от выбранной техники и наличие сопутствующей патологии.
Патогенез РОС
За последние 10 лет было проведено большое количество исследований, раскрывающих истинную структуру патогенеза РОС. Вопреки распространенному заблуждению, разрыв сетчатки играет не ключевую, а опосредованную роль в формировании РОС. Развитие РОС напрямую связано с изменением фибриллярной структуры стекловидного тела, с развитием синхизиса и синерезиса, кульминацией которого является формирование незавершенной задней отслойки стекловидного тела (ЗОСТ) с появлением участков постоянного тракционного воздействия, которые, в свою очередь, приводят к разрыву сетчатки [9, 10].
В исследовании П.В. Лыскина были получены новые данные о механизме формирования витреоретинальной адгезии и ЗОСТ. Исследование проводилось с применением сканирующей электронной микроскопии, в ходе которой был выявлен эпиретинальный слой стекловидного тела (СТ) толщиной 3–5 мкм, фиксированный к поверхности сетчатки после удаления кортикального СТ. По мнению автора, данный слой также остается фиксированным к сетчатке после ЗОСТ ввиду наиболее прочного контакта эпиретинального СТ с внутренней пограничной мембраной сетчатки [11]. Эволюция в понимании структурных изменений витреоретинальных взаимоотношений произошла с появлением новой суспензии для контрастирования стекловидного тела «Витреоконтраст» [12]. Авторы в ходе хромвитрэктомии с помощью данной суспензии обнаружили, что при образовании дефектов в кортикальных слоях структура СТ изменяется, формируется грыжа СТ, что может служить одним из звеньев патогенеза РОС. Также выявлено, что в случае плотной фиксации кортикальных слоев СТ к сетчатке, при формировании ЗОСТ возникает витреошизис. Данное исследование подтвердило наличие эпиретинального слоя СТ, который плотно фиксируется к внутренней пограничной мембране и может оставаться на поверхности сетчатки при индукции ЗОСТ [13]. Считается, что он может играть роль в патогенезе пролиферативной витреоретинопатии (ПВР), которая также имеет важное значение в патогенезе РОС и ее рецидивов [14].
В свою очередь, индуцированный ЗОСТ разрыв сетчатки приводит к скоплению жидкости в субретинальном пространстве, способствуя разобщению нейроэпителия и ретинального пигментного эпителия (РПЭ). Согласно мнению ряда авторов наличие только разрыва (без тракционного воздействия) не вызывает развития РОС [15, 16]. Это подтверждается также тем, что РОС, как правило, развивается при наличии клапанного разрыва, который, как известно, ассоциирован с наличием тракционного компонента. В исследовании А.В. Большунова было выявлено, что из всех возможных факторов риска формирования РОС и неэффективности барьерной лазеркоагуляции (ЛК) статистически достоверным является только наличие шварт, фиксированных к разрыву [17]. Однако не во всех случаях формирования ЗОСТ возникает РОС. Известно, что поддержание контакта нейроэпителия и РПЭ осуществляется посредством метаболических и механических факторов. К ним относятся гидростатическое давление, создаваемое внутриглазной жидкостью, онкотическое давление хориоидеи, а также насосная функция РПЭ. В то же время существуют патологические факторы, приводящие к разобщению данных слоев (тракционный компонент, гравитационное воздействие). Только при превалировании патологических факторов над факторами нормальных ретинальных взаимоотношений возникает РОС. При этом предрасполагающими факторами развития РОС выступают заболевания, сопровождающиеся изменением структуры стекловидного тела: миопия, афакия, артифакия, травма, воспалительные и инфекционные заболевания глаз (цитомегаловирусная инфекция, токсоплазмоз), синдром Марфана, возрастные изменения (ЗОСТ, сенильный ретиношизис).
Методы лечения РОС
Пневморетинопексия
Данная операция была впервые предложена в 1938 г. B. Rosengren. Она заключалась в ограничительной коагуляции краев разрыва с последующим введением воздуха. Частота прилегания сетчатки составляла 77%, однако вследствие затруднительного обнаружения разрывов и экспозиции воздуха, недостаточной для формирования хориоретинальной адгезии, отмечался высокий процент рецидивов. Данная операция была модифицирована E.W. Norton и H. Lincoff в начале 1970-х гг., G.F. Hilton и W.S. Grizzard — в 1980-х гг., они предложили проводить тампонаду с использованием расширяющегося газа SF6 c дальнейшей коагуляцией краев разрыва после прилегания сетчатки [5, 18]. Важным условием, определяющим анатомо-функциональный результат ПР, является соответствие локализации газового пузыря области разрыва, что достигается путем соответствующего позиционирования головы. Стоит отметить, что с появлением перфторуглеродных газов тампонада отслойки проводилась с использованием не только SF6, но и CF4, C2F6, C3F8, C4F10.
Традиционно ПР проводится при наличии неосложненных РОС с разрывами, локализуемыми в верхней полусфере глазного дна. Последние исследования демонстрируют худшие результаты после ПР у пациентов с артифакией, связанные с затруднительной визуализацией периферии и с большей вероятностью возникновения множественных разрывов [19, 20]. Также существуют работы, демонстрирующие высокие результаты применения ПР при наличии нижних разрывов сетчатки, однако применение ПР у таких пациентов сопряжено с длительным вынужденным положением головы вниз, что ограничивает область применения данной методики [21]. Последние рандомизированные клинические исследования (РКИ) демонстрируют потенциальную экономию затрат при применении ПР в 60%, это говорит о том, что более широкое использование ПР может иметь важные финансовые преимущества по сравнению с другими хирургическими методами [20, 22].
Тем не менее ПР осложняется формированием новых разрывов в 15% случаев и развитием ПВР в 4% случаев. Кроме того, анатомический успех после инъекции газа составляет 91%, а после его резорбции рецидив может возникнуть в 11% случаев, что дает первичную частоту прилегания в 80% в связи с возобновлением тракционного воздействия со стороны стекловидного тела [23].
Эписклеральное пломбирование
Техника ЭП, заключающаяся в создании вала вдавления путем наложения пломбы, была впервые предложена в 1950-х гг. C.L. Schepens и E. Сustodis [3]. Важным условием достижения стабильного анатомического результата при проведении ЭП является точная локализация разрыва, которая традиционно осуществляется при помощи непрямой офтальмоскопии. Наряду со значительными преимуществами данная методика имеет ряд недостатков, таких как необходимость многократного изменения положения тела хирурга во время операции, что приводит к увеличению продолжительности операции. Таким образом, дальнейшие инновации в эписклеральной хирургии заключались в поисках более универсального метода офтальмоскопического контроля. В последние годы было проведено несколько исследований, демонстрирующих эффективность применения широкоугольной системы визуализации совместно с интраокулярным панорамным эндоосветителем 25G и 27G [24, 25]. Однако, несмотря на высокие результаты использования данной технологии, сообщается о нескольких случаях возникновения послеоперационного эндофтальмита [26].
Согласно данным РКИ технология ЭП показывает свою анатомическую эффективность в 82% случаев [27]. Тем не менее наличие постоянного имплантата при экстрасклеральной хирургии не исключает развития ряда осложнений, таких как индуцированная близорукость и астигматизм, протрузия пломбы, эрозия склеры, экструзия, не исключен риск перфорации глазного яблока при наложении эписклеральных швов для фиксации пломбы. Диплопия после ЭП с частотой около 4% может сохраняться в течение всей жизни [28].
Pars plana витрэктомия
Как известно, витрэктомия, заключающаяся в удалении стекловидного тела с использованием инструментов 17G, была предложена в 1972 г. R. Machemer для лечения РОС с витреальной тракцией и ПВР [4]. С появлением микроинвазивной витрэктомии 23–29G эта техника стала (и по настоящее время является) самой частой операцией, проводимой для лечения РОС [29–31]. Несмотря на это, существуют данные, указывающие на высокий процент развития осложнений после ППВ, включающих развитие ПВР и прогрессирование катаракты [32]. Данных осложнений можно избежать при проведении витрэктомии с пилингом внутренней пограничной мембраны в сочетании с экстракцией катаракты [33]. Однако все еще остались нерешенными вопросы о предпочтительном выборе тампонирующего агента. Преимуществами газовой тампонады являются самостоятельное рассасывание газа и отсутствие необходимости в повторном оперативном вмешательстве, в результате чего частота рецидивов РОС при данном виде тампонады меньше. Недостатком данного метода являются длительное вынужденное положение пациента в послеоперационном периоде. В то же время использование в качестве тампонирующего агента силиконового масла сопряжено с развитием следующих осложнений: катаракта (33–100%), вторичная гипертензия (0–32%), эмульгирование силиконового масла (1–100%) и силиконовая кератопатия (3–62%) [34]. Существуют работы о применении бинарной тампонады у пациентов, имеющих разрывы в верхней и в нижней полусфере глазного дна [35]. Авторы данного исследования отмечают высокий процент прилегания сетчатки, но при этом частое развитие катаракты и эмульгации тампонирующих веществ. В связи с этим в настоящее время все еще ведутся поиски наиболее эффективного и безопасного тампонирующего вещества. Последние инновационные разработки в этой области предлагают использование искусственного стекловидного тела в качестве постоянного тампонирующего агента. Для этого необходимо применение биосовместимых, оптически прозрачных материалов, обладающих соответствующей вязкостью и отсутствием токсичности для сетчатки. В данных работах наилучшие результаты показывают гидрогели на основе гиалуроновой кислоты [36, 37].
Таким образом, несмотря на высокую популярность витрэктомии и ее возможности в полном устранении тракционного компонента, при данной операции отмечается достаточно высокий процент развития осложнений. Несомненно, витрэктомия является операцией выбора при наличии субтотальных и тотальных РОС, гигантских разрывов или множественных разрывов, расположенных в различных квадрантах глазного дна. Однако для пациентов с локальными отслойками, сохранной макулярной зоной и нативным хрусталиком предпочтительно использование более щадящих методов лечения.
Сравнительный анализ эффективности различных методов лечения РОС
Пневморетинопексия и витрэктомия
Недавнее РКИ PIVOT по сравнению эффективности между ПР и ППВ показало, что ПР можно считать операций выбора для пациентов, отвечающих данным критериям: наличие разрывов сетчатки в соседних меридианах в пределах одного сектора, локализованных в верхней полусфере глазного дна [38]. Результаты данного РКИ демонстрируют меньшие показатели вертикальной метаморфопсии и большую удовлетворенность качеством жизни после ПР по сравнению с ППВ (табл. 1). В то же время отмечаются более низкие по сравнению с ППВ показатели первичного прилегания сетчатки.
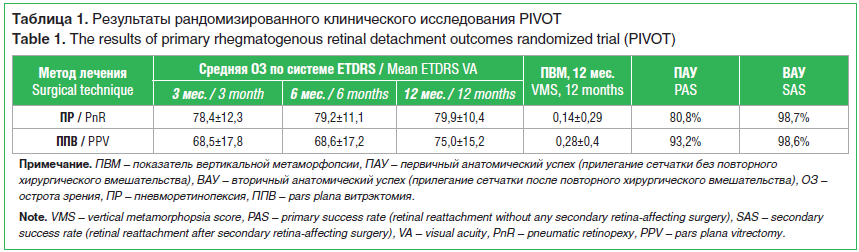
Эписклеральное пломбирование и витрэктомия
В мультицентровом РКИ SPR с участием 681 пациента (416 — факичных, 265 — артифакичных) проводилось сравнение ППВ и ЭП с определением прогностических факторов для достижения наилучшего анатомического результата после оперативного лечения РОС [39]. Результаты данного исследования демонстрируют сопоставимый анатомический результат между ЭП и ППВ у пациентов с нативным хрусталиком и лучший анатомический исход в группе ППВ у пациентов с артифакией. Также выявлено, что интраоперационное использование криотерапии сопряжено с формированием ПВР, более выраженным послеоперационным воспалением и снижением остроты зрения по сравнению с применением ЛК.
Метаанализ базы данных Cochrane демонстрирует более высокий анатомический результат в группе ППВ, равный 96%, по сравнению с 81,9% в группе ЭП [27]. В данном метаанализе показана большая частота развития рефракционных изменений и отслойки хориоидеи в группе ЭП и большая частота развития катаракты и ПВР в группе ППВ.
Пневморетинопексия и эписклеральное пломбирование
Метаанализ базы данных Cochrane, проведенный с участием 216 пациентов, продемонстрировал более высокий анатомический результат в группе ЭП, равный 81,9%, по сравнению с 72,9% в группе ПР [40]. В группе ЭП превалировали миопический сдвиг, развитие ПВР и отслойка хориоидеи. В группе ПР чаще встречались рецидивы отслойки, вызванные появлением новых разрывов. В многоцентровом РКИ по применению ЭП с дренированием субретинальной жидкости в сочетании с ПР (159 пациентов) показана эффективность данного метода, равная 91,82%, со сроком наблюдения 12 мес. [41]. При этом, как отмечают авторы, анатомо-функциональный успех операции сопоставим с таковым при проведении витрэктомии при большей экономической эффективности и меньшей инвазивности.
Проведенные сравнительные исследования демонстрируют, что конечный анатомо-функциональный исход зависит от правильного выбора оперативного лечения с учетом предоперационных характеристик пациента и вероятности развития осложнений (табл. 2).
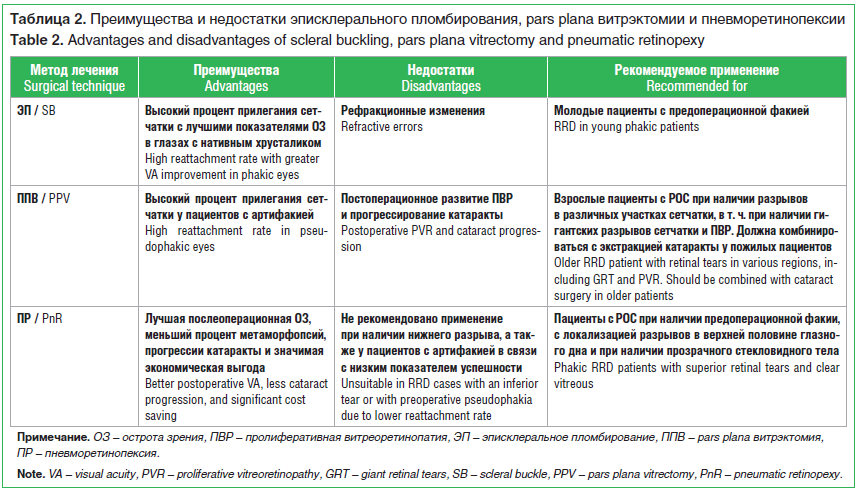
Микроинвазивные технологии лечения РОС
Однопортовая витрэктомия
Данная технология заключается в постановке 1 порта (25G) без постановки ирригационной канюли. Проводится локальная витрэктомия вокруг разрыва, основной задачей которой является удаление тракций, непосредственно вызывающих разрыв. После удаления субретинальной жидкости и восполнения объема стекловидного тела физиологическим раствором проводится эндолазеркоагуляция и введение в витреальную полость газовоздушной смеси. Авторы исследования отмечают анатомический успех операции, равный 95,4% [42]. Преимуществом данной операции по сравнению с классической технологией является отсутствие ятрогенных разрывов сетчатки, при этом наблюдаются лучшие показатели послеоперационной остроты зрения и меньший процент рецидивов отслойки (7%). Таким образом, данная технология демонстрирует высокие анатомо-функциональные результаты с меньшим процентом интра- и послеоперационных осложнений в силу минимизации хирургического вмешательства.
Комбинированная микроинвазивная лазер-хирургическая технология
Одним из перспективных направлений в хирургии РОС является использование YAG-лазерных методов лечения. В одном из исследований сообщается об успешном применении YAG-лазерной ретинотомии в лечении субклинической отслойки сетчатки. Данный метод заключается в отсечении основания клапана (с целью устранения тракционного компонента) в сочетании с ограничительной ЛК краев разрыва. Авторы исследования отмечают достижение прилегания сетчатки в 58% за 12 мес. [43]. Дальнейшее использование YAG-лазерных технологий привело к появлению метода комбинированного лазер-хирургического лечения локальных РОС. Данная технология применяется при наличии локальных РОС с клапанным разрывом, локализованным в верхней половине глазного дна, и проводится в 3 этапа. На первом этапе проводят иссечение области витреоретинального сращения, определяемой при помощи оптической когерентной томографии. Таким образом полностью устраняется основное патогенетическое звено РОС — тракционный компонент. На втором этапе проводят тампонаду отслойки газовоздушной смесью, включающей 10% С3F8, с целью достижения прилегания сетчатки. На третьем этапе, после полного прилегания сетчатки, проводится ограничительная ЛК сетчатки. При применении данной технологии достигается полное прилегание сетчатки и устранение тракционного компонента [44–47]. При этом рецидивов заболевания за 12 мес. не наблюдалось. Исходя из этого, применение YAG-лазерных технологий является многообещающим в лечении РОС. Однако необходимо дальнейшее исследование данной технологии с анализом отдаленных результатов лечения и формированием показаний к ней.
Заключение
Таким образом, на данный момент не существует консолидированного представления об универсальном методе лечения РОС. Тем не менее применяемые в настоящее время хирургические техники позволяют добиться высокой эффективности. Правильный выбор метода лечения в зависимости от предоперационных характеристик пациента позволяет сохранить зрительные функции, избежать осложнений и добиться полного прилегания сетчатки. Проведенный анализ последних РКИ демонстрирует тенденцию к применению микроинвазивных технологий с предпочтительным использованием тканесохраняющих методов. Микроинвазивные методы лечения РОС позволяют уменьшить процент послеоперационных осложнений и рецидивов с достижением высокого анатомо-функционального результата и тем самым улучшить качество жизни пациента.
Сведения об авторах:
Дога Александр Викторович — д.м.н., профессор, заместитель генерального директора по научно-клинической работе, ORCID iD 0000-0003-2519-8941;
Шкворченко Дмитрий Олегович — к.м.н., заместитель главного врача по медицинской части, ORCID iD 0000-0002-0176-928X;
Крыль Леонид Анатольевич — к.м.н., старший научный сотрудник отдела лазерной хирургии сетчатки, ORCID iD 0000-0003-1125-1692;
Таевере Мариям Рамазановна — очный аспирант отдела лазерной хирургии сетчатки, ORCID iD 0000-0003-1013-6924;
Буряков Дмитрий Анатольевич — к.м.н., заведующий отделом экспорта медицинских услуг, ORCID iD 0000-0002-4528-1446.
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 127486, Россия, г. Москва, Бескудниковский бульв. д. 59А.
Контактная информация: Таевере Мариям Рамазановна, e-mail: taeveremr@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 09.03.2020.
About the authors:
Aleksandr V. Doga — MD, PhD, Professor, Deputy Director General for Scientific Clinical Work, ORCID iD 0000-0003-2519-8941;
Dmitriy O. Shkvorchenko — MD, PhD, Deputy Head Doctor for Medical Work, ORCID iD 0000-0002-0176-928X;
Leonid A. Kryl’ — MD, PhD, Senior Researcher of the Division of Laser Retinal Surgery, ORCID iD 0000-0003-1125-1692;
Mariyam R. Taevere — MD, postgraduate student of the Division of Laser Retinal Surgery, ORCID iD 0000-0003-1013-6924;
Dmitriy A. Buryakov — MD, PhD, Head of the Division of Export of Medical Services, ORCID iD 0000-0002-4528-1446.
S.N. Fedorov NMRC “MNTK “Eye Microsurgery”. 59A, Beskudnikovskiy blvd, Moscow, 127486, Russian Federation.
Contact information: Mariyam R. Taevere, e-mail: taeveremr@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 09.03.2020.
.
материал rmj.ru
