Содержание статьи
Проблемы пренатальной диагностики генетической патологии
плода на уровне женской консультации
Л. В. Акуленко*, 1, доктор медицинских наук, профессор
И. Б. Манухин*, доктор медицинских наук, профессор
Т. К. Мачарашвили*
Э. О. Ибрагимова**
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
В соответствии с данными Всемирной организации здравоохранения (World Health
Organization, WHO), у 2,5–3% новорожденных уже при появлении на свет
обнаруживаются различные врожденные пороки развития (ВПР). Около 1% из них
являются проявлением моногенных болезней, около 0,5% — хромосомных болезней и
1,5–2% приходится на долю ВПР, обусловленных действием экзогенных и эндогенных
факторов. Частота ВПР к концу первого года жизни ребенка достигает 7% за счет
проявления невыявленных при рождении пороков развития органов зрения, слуха,
нервной и эндокринной систем. В Российской Федерации ежегодно на каждую тысячу
новорожденных рождается 40–50 детей с врожденными и наследственными
заболеваниями. Не менее 30% перинатальной и неонатальной смертности обусловлено
этими формами патологии, что свидетельствует о чрезвычайной значимости их
профилактики не только для семьи, но и для общества в целом [1–3].
Решающая роль в комплексе мероприятий по профилактике наследственных и
врожденных заболеваний принадлежит пренатальной диагностике (ПД) — разделу
медицинской генетики, возникшему в 80-х годах XX века на стыке клинических
дисциплин (акушерства, гинекологии, неонатологии) и фундаментальных наук
(патофизиологии, биохимии, цитогенетики, молекулярной биологии, генетики
человека) [1, 2].
В России ПД регламентирована Приказом Министерства здравоохранения № 457 от
28 ноября 2000 года «О совершенствовании пренатальной диагностики в профилактике
наследственных и врожденных заболеваний у детей», который до настоящего времени
является основополагающим и предусматривает двухуровневый порядок обследования
беременных женщин. Первый уровень заключается в проведении массового скрининга
беременных акушерско-гинекологическими учреждениями (женскими консультациями,
кабинетами и другими родовспомогательными учреждениями) в I и II триместрах
беременности на основе использования фетальных биохимических и ультразвуковых
маркеров. Второй уровень включает мероприятия по диагностике конкретных форм
поражения плода, оценке тяжести болезни и прогнозу состояния здоровья ребенка, а
также решение вопросов о прерывании беременности в случаях тяжелого, не
поддающегося лечению заболевания плода, которые осуществляются в региональных
(межрегиональных) медико-генетических консультациях [4].
С генетической точки зрения проблемы, связанные с ПД, в настоящее время уже
принципиально решены. Однако эффективность дородовых профилактических
мероприятий все еще остается крайне низкой, несмотря на попытки кардинальных
преобразований в организационной системе ПД, предпринятых в последние годы [3,
5–8].
Учитывая то обстоятельство, что главная роль в системе мероприятий по
профилактике генетической патологии плода принадлежит врачам первого контакта с
беременной женщиной — акушерам-гинекологам, нами было предпринято исследование,
направленное на изучение потребности в совершенствовании деятельности
амбулаторного звена акушерско-гинекологической службы как первого уровня ПД
генетической патологии плода.
Материал и методы исследования
Исследование выполнено на ретроспективном материале одной из женских
консультаций г. Москвы. Материал исследования представили амбулаторные карты 290
женщин, состоявших на учете по беременности с 2007 г. по 2011 г. Согласно
приказам, регламентирующим ПД в эти годы [4, 8], обследование беременных на I
уровне включало:
1. Трехкратное ультразвуковое исследование:
1) на 10–13 неделе (оценка копчико-теменного
расстояния и толщины воротникового пространства плода);
2) 20–23 недели (выявление пороков развития и эхографических маркеров
хромосомных болезней плода);
3) 30–33 недели (выявление пороков развития с поздним проявлением,
функциональная оценка состояния плода).
2. Обязательное двукратное исследование уровня не менее двух биохимических
маркеров врожденной патологии плода:
1) плазменного протеина-А, связанного с
беременностью (PAPP-A) и β-субъединицы хорионического гонадотропина (β-ХГ) на
сроке 10–13 недель;
2) α-фетопротеина (АФП) и β-субъединицы хорионического гонадотропина (β-ХГ) в
сроке 16–20 недель (оптимально 16–18 недель).
Концентрацию β-ХГЧ и PAPP-A в материнской сыворотке в I триместре и АФП,
свободного β-ХГЧ и E3 во II триместре беременности определяли на анализаторе
6000 Delfia Xpress (Perkin Elmer, Wallac) иммунофлюоресцентным методом с
разрешением по времени. Значения сывороточных маркеров считали нормальными, если
они находились в пределах от 0,5 до 2,0 МоМ.
Ультразвуковое исследование (УЗИ) выполнялось на аппарате Sonix RP,
оснащенном всеми типами датчиков, использующихся в акушерских исследованиях. Во
всех случаях измеряли копчико-теменное расстояние (КТР) и толщину воротникового
пространства (ТВП). Все измерения проводились согласно существующим
рекомендациям.
Окончательный расчет риска рождения ребенка с хромосомной патологией
производили в лаборатории Московского городского центра неонатального скрининга
на базе детской психиатрической больницы № 6 с помощью аппаратно-программного
комплекса Life Cycle, основной функциональной задачей которого является
пренатальный скрининг (ПС) плода на наличие синдрома Дауна (СД) и синдрома
Эдвардса (СЭ). База данных программы формировалась из листов опроса, содержащего
информацию о беременной женщине, включая возраст, вес, срок беременности,
курение, этническую принадлежность, количество плодов, применение
экстракорпорального оплодотворения, наличие/отсутствие сахарного диабета, данные
УЗИ и показатели биохимических маркеров. На основании всего массива данных
программа автоматически рассчитывает риск рождения ребенка с СД и СЭ, который
указывается в цифрах. Пороговое значение риска составляет 1:250. Степень риска
хромосомной патологии оценивали как высокую при соотношении 1:250 и ниже.
Для сбора материала исследования была разработана специальная анкета, которая
содержала полную информацию о пациентке и плоде, включая репродуктивный и
семейный анамнез, подробные сведения о проведении ультразвукового и
биохимического скрининга в I и II триместрах беременности, данные об исходе
беременности и состоянии новорожденного. Статистическая обработка данных
выполнена на индивидуальном компьютере с помощью электронных таблиц Microsoft
Excel и пакета прикладных программ Statistica for Windows 7.0. Для сравнения
непрерывных данных использовали t-критерий Стьюдента, статистически значимыми
считались отличия при p < 0,05 (95%-й уровень значимости).
Результаты исследования
Первоочередной задачей настоящего исследования явился ретроспективный анализ
точности исполнения женской консультацией приказов, регламентировавших
проведение ПС беременных с 2007 по 2011 год. Как можно видеть в табл. 1, из 290
женщин, состоявших на учете по беременности с 2007 года по 2011 год, в I
триместре встали на учет 201 (69,3%) женщина, во II триместре — 79 (27,1%)
женщин, в III триместре — 10 (3,4%) женщин.
Ультразвуковому скринингу в I триместре беременности в положенные сроки были
подвергнуты 192 (66,2%) женщины, 96 (33,8%) женщинам УЗИ не проводилось (табл.
2).
Биохимическому скринингу в II триместре беременности были подвергнуты 176
(60,7%) женщин, 114 (39,3%) женщин не были обследованы (табл. 3).

Заключения об индивидуальном риске хромосомных аномалий (ХА) у плода,
автоматически рассчитанные по данным биохимического и ультразвукового скрининга
в I триместре беременности, имелись в амбулаторных картах только у 172 (59,3%)
беременных женщин.
Во II триместре у 77 (26,6%) беременных сроки выполнения ультразвукового
скрининга были нарушены, у 29 (10%) беременных УЗИ не проводилось вовсе, только
у 184 (63,4%) женщин ультразвуковой скрининг был проведен в положенные сроки
(табл. 4).
Что же касается биохимического скрининга, то образцы сыворотки крови были
взяты своевременно только у 52 (18,0%) беременных, у 209 (72%) женщин сроки были
нарушены, а у 29 (10,0%) не получены вовсе. Заключения лаборатории об
индивидуальном риске ХА у плода имелись в амбулаторных картах только у 178
(61,4%) беременных, у 112 (38,6%) беременных заключение отсутствовало.
Таким образом, ретроспективный анализ показал, что регламент проведения ПС
систематически нарушался и, поскольку им были охвачены только 59,3% и 61,4%
беременных женщин в I и II триместрах беременности соответственно, его нельзя
считать массовым.
Для оценки результатов ПС были использованы данные о 172 беременных женщинах,
в чьих амбулаторных картах имелись заключения лаборатории об индивидуальном
риске хромосомных аномалий у плода в I и II триместрах беременности. В табл. 5
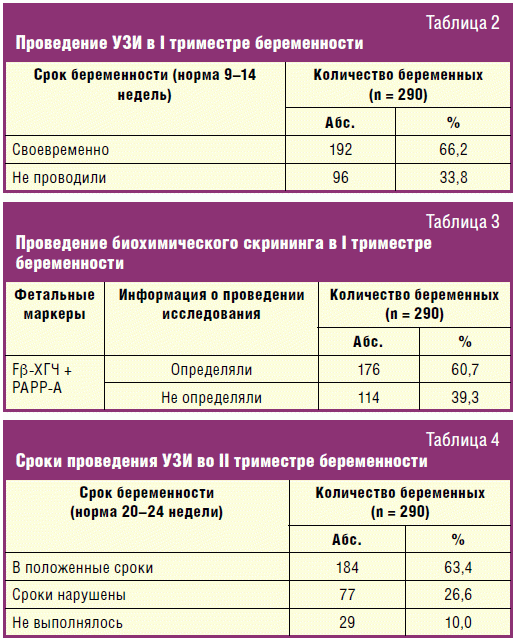
представлены результаты УЗ-скрининга в I триместре беременности, из которой
явствует, что КТР плода определен у 161 (93,6%) беременной (у всех в пределах
нормальных значений), у 11 (6,4%) беременных достоверная информация в
амбулаторных картах отсутствовала; толщина воротникового пространства ТВП плода
определена у 164 (95,3%) беременных (у 3 (1,8%) женщин ТВП составляла 3 мм и
более, что является маркером хромосомной патологии, у 1 (0,6%) беременной
определен порок развития плода — анэнцефалия). У 8 (4,7%) женщин достоверная
информация в амбулаторных картах отсутствовала.
Практически у всех женщин были получены образцы крови и своевременно
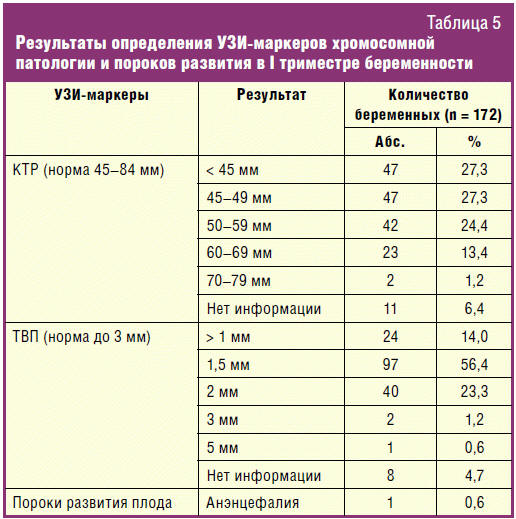
определены уровни β-ХГЧ и PAPP-A. В результате комбинированного скрининга в I
триместре беременности из 172 беременных 18 (10,4%) женщин были отнесены к
группе риска: 9 (5,2%) с высоким риском ХА у плода и 9 (5,2%) — с пороговым
риском (рис.).
Все 18 (100,0%) беременных женщин, отнесенные к группе риска, были направлены
в медико-генетическую консультацию, однако в амбулаторных картах имелась
информация только о 2 (11,1%) из них — тех, кому проводилась биопсия хориона
(хромосомная патология ни у кого выявлена не была, обе беременности были
пролонгированы). Одна беременность с пороком развития плода (анэнцефалией) в I
триместре была обоснованно прервана. Что же касается других 16 (88,9%) женщин из
группы риска, то сведения о посещении и результатах медико-генетического
консультирования в их амбулаторных картах отсутствовали. Это обстоятельство
свидетельствует о недостаточной взаимосвязи между первым и вторым уровнем ПД.
Во II триместре беременности ПС подвергались 177 беременных женщин, при этом
УЗИ в положенные сроки было выполнено только 99 (55,9%) из них, у 71 (40,1%)
женщины сроки проведения УЗИ были нарушены. В результате УЗИ у 31 (17,5%)
беременной была выявлена патология плода: внутриутробная задержка развития — у 3
(1,7%) женщин, многоводие — у 3 (1,7%) женщин, патология плаценты — у 24 (13,6%)
женщин и множественные пороки развития у 1 (0,6%) женщины.
Биохимический скрининг во втором триместре беременности был проведен 172
(97,2%) беременным в надлежащие сроки, у 5 (2,8%) женщин срок взятия образцов
крови был нарушен. Фетальные маркеры АФП и β-ХГЧ были определены у всех
беременных.
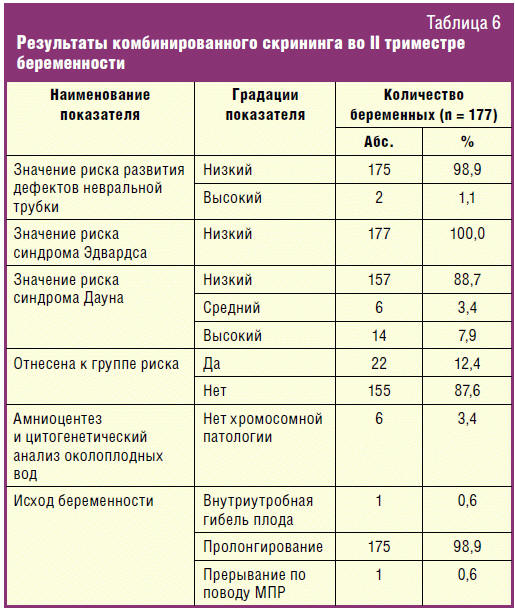
В табл. 6 представлены результаты комбинированного скрининга 177 беременных,
выраженные в значениях индивидуального риска развития дефектов невральной трубки
(ДНТ) и ХА (синдромов Эдвардса и Дауна) у плода, рассчитанных с помощью
программы Life Cycle.
Как можно видеть в табл. 6, из 177 беременных, подвергавшихся
комбинированному скринингу во II триместре, к группе риска были отнесены 22
(12,4%) женщины: 2 (1,1%) с высоким риском развития ДНТ, 6 (3,4%) со средним и
14 (7,9%) с высоким риском развития синдрома Дауна. При этом если общее
количество женщин, отнесенных к группе риска (22 женщины), принять за 100%, то в
амбулаторных картах имелась информация только о 6 (27,8%) из них — тех, кто
подвергался инвазивной процедуре (амниоцентезу) с целью взятия околоплодных вод
для цитогенетического исследования (ни у кого хромосомная патология плода
выявлена не была). Информация о других 16 (72,7%) женщинах в амбулаторных картах
отсутствовала. Во II триместре у 1 (0,6%) женщины беременность была обоснованно
прервана, в связи с выявленными множественными пороками развития (МПР) у плода,
у 1 (0,6%) произошла внутриутробная гибель плода по причине фетофетального
синдрома 3-й степени, гестоза легкой степени и выраженного многоводия, 175
(98,9%) беременностей были пролонгированы.
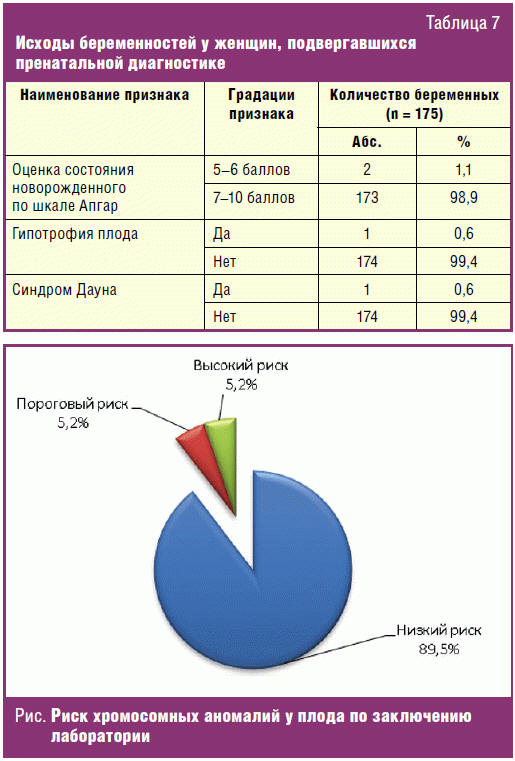
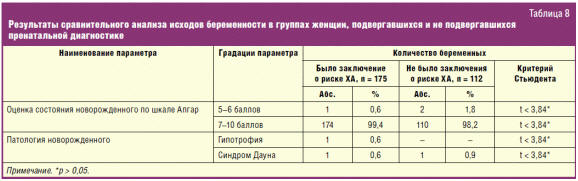
Данные об исходах беременностей у женщин, подвергавшихся пренатальной
диагностике, представлены в табл. 7, из которой явствует, что подавляющее
большинство новорожденных 173 (98,9%) были оценены по шкале Апгар на 7–10
баллов, 2 (1,1%) новорожденных — на 5–6 баллов, из 175 новорожденных 1 (0,6%)
ребенок родился с гипотрофией и еще 1 (0,6%) ребенок родился с пропущенным
синдромом Дауна.
С целью оценки эффективности ПД проведен сравнительный анализ исходов
беременностей в двух группах женщин: 1) первая группа — беременные,
подвергавшиеся ПД; 2) вторая группа — беременные, не подвергавшиеся ПД (табл.
8). Из табл. 8 явствует, что в обеих группах все показатели не имеют
статистически значимых различий. Так, состояние подавляющего количества
новорожденных (около 99,0%) в той и другой группе было оценено по шкале Апгар на
7–10 баллов. В той и другой группе родилось по одному ребенку с синдромом Дауна.
Полученные результаты свидетельствуют о низкой эффективности проводимой ПД.
Учитывая то обстоятельство, что ПД врожденных и наследственных болезней
является областью медицинской генетики, реализация которой на первом уровне
находится в компетенции акушеров-гинекологов, была предпринята попытка выяснить
степень осознанности врачами акушерами-гинекологами сущности и принципов
организации этого вида деятельности. С этой целью были использованы тестовые
задания (31 вопрос) по основным разделам ПД, позаимствованные из сборника
тестовых заданий по специальности «Генетика» [9]. В инкогнито-тестировании
участвовали 7 врачей-гинекологов. В среднем количество правильных ответов
составило 17,7 (56,2%), что свидетельствует о недостатке знаний у врачей
акушеров-гинекологов, касающихся медико-генетических аспектов ПД.
Обсуждение полученных результатов
Во всех странах мира каждый 20-й ребенок рождается с врожденной патологией
генетической природы. При этом 2–3 из 100 новорожденных, появляются на свет с
несовместимыми с жизнью или тяжелыми пороками развития, которые можно было бы
выявить в период беременности. Поскольку 95% ВПР, включая ХА, как правило,
являются спорадическими, то в группе риска находится каждая беременная женщина.
Поэтому ПД носит массовый характер [1, 2, 3, 6, 10]. Все большее распространение
в практике работы медико-генетических учреждений в мире находит обследование
беременных в I триместре. Выявление патологии во II триместре беременности
сопряжено с моральными проблемами и рядом акушерских осложнений, связанных с
прерыванием беременности в поздние сроки [7, 11–16].
Ретроспективный анализ нашего исследования показал, что как раз массовый
характер скрининга беременных в I триместре женская консультация не
обеспечивает. Из общего количества женщин, состоявших на учете по беременности с
2007 по 2011 год, в I триместре встали на учет 69,3%, а ПС подверглись 59,3%
беременных женщин. Эти данные свидетельствуют, что организация исполнения
приказа МЗ РФ № 457 и других приказов, регламентировавших ПД с 2007 по 2011 год,
является неудовлетворительной и свидетельствуют о недостаточной готовности
амбулаторного звена акушерско-гинекологической службы к переходу на ПС только в
I триместре.
Практическая эффективность и целесообразность трехкратного ультразвукового
скринингового обследования беременных на сроках 11–14, 20–22, 32–34 недели
беременности научно доказана [1, 11, 13]. Судя по данным нашего исследования и,
несмотря на то, что во II триместре беременности сроки проведения УЗИ у 47,5%
женщин были нарушены, этот вид скрининга позволил выявить патологию плода у
17,5% беременных. Полученные данные подтверждают актуальность УЗ-скрининга во II
триместре беременности, особенно для тех женщин, кто не проходили обследование в
I триместре.
Однако сравнительный анализ исходов беременности у женщин, подвергавшихся и
не подвергавшихся ПД, не выявил никаких достоверных различий по всем тестируемым
параметрам. В той и другой группе родилось по одному ребенку с пропущенным
синдромом Дауна, что свидетельствует о низкой эффективности ПД.
Проведенное тестирование врачей акушеров-гинекологов на знания основ ПД
свидетельствует о недостатке их знаний. По-видимому, было бы целесообразно
ввести в учебный процесс кафедр акушерства и гинекологии специальный курс ПД
врожденных и наследственных болезней с основами медицинской генетики.
Выводы
- Главной причиной низкой эффективности ПД врожденных и наследственных
заболеваний является систематическое несоблюдение регламента проведения
пренатального скрининга на уровне амбулаторного звена
акушерско-гинекологической службы, нарушающее его основные принципы —
массовость, своевременность и полноценность. - Для повышения эффективности ПД врожденных и наследственных болезней
требуются меры по совершенствованию деятельности амбулаторного звена
акушерско-гинекологической службы, направленные на: 1) повышение
компетентности акушеров-гинекологов в проведении ПД согласно регламенту; 2)
обеспечение информационной и мотивационной готовности беременных женщин к
перинатальной профилактике; 3) оптимизацию взаимодействия между врачами
акушерами-гинекологами и генетиками.
Литература
- Пренатальная диагностика наследственных и врожденных болезней / Под ред.
Э. К. Айламазяна, В. С. Баранова. М.: МЕДпресс-информ, 2006. 415 с. -
Акуленко Л. В., Золотухина Т. В., Манухин И. Б. Дородовая
профилактика генетической патологии плода. М.: ГЭОТАР-Медиа, 2013. 292 с. -
Жученко Л. А., Андреева Е. Н., Калашникова Е. А., Лагкуева Ф. К.,
Отарян К. К., Одегова Н. О., Степнова С. В., Юдина Е. В. Основные итоги и
современное состояние программы комбинированного пренатального скрининга I
триместра в Российской Федерации // Журнал акушерства и женских болезней.
2013. Т. LXI. Вып. 3. С. 20–25. - Приказ Минздрава РФ от 28.12.2000 N 457 о совершенствовании пренатальной
диагностики в профилактике наследственных и врожденных заболеваний у детей.
http://www.bestpravo.ru/fed2000/data01/tex10191.htm. -
Жученко Л. А., Андреева Е. Н., Одегова Н. О., Степнова С. В., Лагкуева
Ф. К., Леонова В. Ю. Современная концепция и инновационные алгоритмы
пренатальной диагностики в рамках нового национального проекта Министерства
здравоохранения и социального развития Российской Федерации «Дородовая (пренатальная)
диагностика нарушений развития ребенка» // Российский вестник
акушера-гинеколога. 2011, 1, с. 8–12. -
Жученко Л. А., Склянкина И. В., Мельникова Е. Н. Эффективность
пренатальной диагностики в выявлении хромосомной патологии у плодов беременных
— жительниц Московской области // Рос. вестн. акуш. гин. 2006; 6: 2: 31–34. -
Кащеева Т. К., Николаева Ю. А., Карпов К. П., Вохмянина Н. В.,
Романенко О. П., Баранов В. С. Ранний пренатальный скрининг — состояние,
трудности, новые возможности // /Журнал акушерства и женских болезней. 2012.
Т. 61. С. 69–74. - Приказ Министерства здравоохранения и социального развития РФ от
02.10.2009 г. № 808 н «Об утверждении Порядка оказания
акушерско-гинекологической помощи», зарегистрировано в Минюсте РФ 31.11.2009
г., http://www.garant.ru/products/ipo/prime/doc/12072455/#ixzz3GMRqj1J7. -
Гинтер Е. К., Козлова С. И., Прытков А. Н., Немцова М. В., Ермакова М.
А., Жулева Л. Ю. Тестовые задания по специальности «Генетика». М., 2013. -
Манухин И. Б., Акуленко Л. В., Кузнецов М. И. Пропедевтика
пренатальной медицины. М.: ГЭОТАР-Медиа, 2015, 319 с. -
Каретникова Н. А., Гончарова Е. А., Стыгар А. М., Гурьев С. О.,
Турсунова Д. Т., Бахарев В. А., Колодько В. Г. Современные возможности
пренатальной диагностики генетической патологии в ранние сроки беременности //
Проблемы репродукции. 2010. Т. 16. № 2. С. 82–86. -
Некрасова Е. С., Николаева Ю. А., Кащеева Т. К. и др. Внедрение
алгоритма комбинированного скрининга хромосомной патологии плода в I триместре
беременности. Опыт работы за 4 года // Журн. акушерства и женских болезней.
2007. Т. LVI, вып. 1. С. 28–34. -
Турсунова Д. Т. Сравнительный анализ скринирующих программ в I и
II триместре беременности // Проблемы репродукции. 2011. № 2. С. 76–80. -
Evans M. I., Van Decruyes H., Nikolaides K. H. Nuchal
translucency measurements for first trimester screening: the «price» of
inaccuracy // Fetal Diag. Ther. 2007. Vol. 22. P. 401–404. -
Hernandez-Andrade E., Guzman Huerta N., Garcia Cavazos R., Ahued-Ahued
J. R. Prenatal diagnosis in the first trimester, whom and how? //
Gynecology Obstetric Mex. 2002. Vol. 70. P. 607– 612. -
Nicolaides K. H., Spencer K., Avgidou K. et al. Multicenter study
of first-trimester screening for trisomy 21 in 75 821 pregnancies: results and
estimation of the potential impact of individual risk-orientated two-stage first-trimester
screening // Ultrasound Obstet Gynecol. 2005; 25: 221–226.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru


