Содержание статьи
Препараты висмута – фармакологические основы клинического
эффекта
С. В. Оковитый, доктор медицинских наук, профессор
Д. Ю. Ивкин, кандидат биологических наук
ГОУ ВПО СПХФА МЗ РФ, Санкт-Петербург
Висмут (Bi) — относительно редкий элемент, обладающий не только
металлическими свойствами, но и характеристиками, близкими к полупроводникам и
изоляторам, поэтому иногда классифицируется как полуметалл или металлоид.
Bi (III) легко гидролизуется в водных растворах и имеет высокое сродство к
кислороду, азоту и серосодержащими лигандам, Bi (V) является мощным окислителем
в водном растворе и неустойчив в биологических системах [1].
Препараты висмута
Соединения висмута вошли в медицинскую практику со времен средневековья, а
первый научный доклад о содержащем висмут препарате для лечения диспепсии был
сделан в 1786 г. [1]. На сегодняшний день самое широкое применение соединения
висмута нашли в гастроэнтерологии, а наиболее часто используемыми среди них
являются висмута субсалицилат и коллоидный субцитрат (висмута трикалия дицитрат,
ВТД) [2, 3] (табл. 1).
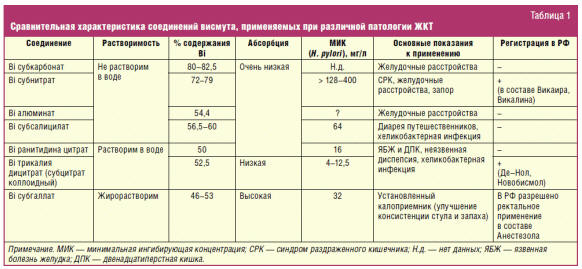
Висмута субсалицилат во многих странах используется в качестве
безрецептурного препарата для быстрого купирования изжоги, тошноты и диареи.
Коллоидный висмута субцитрат нашел применение в первую очередь для лечения
заболеваний, ассоциированных с хеликобактерной инфекцией, а также как
пленкообразующий гастропротектор. Именно этот препарат представляет наибольший
интерес с точки зрения фармакологических свойств и клинического применения.
Перспективным представляется применение радионуклидов висмута (например,
213Bi) для диагностики и лечения различных опухолей — лимфом, лейкемии [4,
5].
Висмута трикалия дицитрат
Взаимодействие со слизистой
На поверхности слизистой ВТД образует гликопротеин-висмутовые комплексы, по
сути представляющие собой диффузионный барьер для HCl, который усиливается за
счет дополнительного повышения вязкости пристеночной слизи [6, 7]. Этот процесс
является рН-зависимым и ослабевает по мере повышения рН [8]. Если при
нейтральном рН ВТД преимущественно находится в коллоидном состоянии, формируя
структуры [Bi6O4(cit)4]6- и [Bi12O8(cit)8]12-,
то при рН < 5 он быстро образует трехмерные полимерные преципитаты оксихлорида
и цитрата висмута, оптимум образования которых наблюдается при рН ≈ 3,5 [6, 9].
Распределение ВТД по слизистой желудка является неравномерным — значительная
часть его обнаруживается в области дна язвы, а остальная распределяется по
неповрежденной слизистой [l0]. В области поврежденной слизистой преципитаты
имеют значительно большие размеры и формируют своеобразную «полимерную пленку»,
что, как предполагается, обеспечивает более выраженный защитный эффект [4].
Считается, что благодаря отрицательному заряду микропреципитаты висмута особенно
активно осаждаются на пораженных участках слизистой, имеющих из-за большого
количества белков положительный заряд. Образующиеся микропреципитаты могут
проникать в микроворсинки и путем эндоцитоза попадать в клетки эпителия [11].
Одновременно под влиянием ВТД происходит перераспределение продукции муцинов
— уровень кислых муцинов, повышенный в пораженном эпителии, снижается при
одновременном возрастании количества нейтральных муцинов [12].
Влияние на активность пепсина
Исследования in vitro показали, что ВТД присуща антипепсиновая
активность. В концентрации 25 и 50 г/л препарат (после преинкубации с желудочным
соком при рН = 4) ингибировал протеолитическую активность пепсина (при рН = 2)
соответственно на 29% и 39% [13]. У пациентов с язвой двенадцатиперстной кишки
ВТД (120 мг 4 раза/день) уменьшал как базальную, так и стимулированную продукцию
пепсина более чем на 30% [14].
Предполагается, что эти эффекты опосредованы как непосредственной
инактивацией пепсина вследствие образования комплексов с висмутом, так и
снижением активности главных клеток [15].
Связывание желчных кислот
Феномен связывания желчных кислот ВТД был описан после исследований in
vitro, и до настоящего времени его клиническая значимость до конца не
определена. Тем не менее, при рН = 2 ВТД связывает различные желчные кислоты,
особенно гликохенодеоксихолевую (до 50%), резко теряя эту активность при рН = 4
[16].
Влияние на продукцию простагландинов и бикарбоната
Этот компонент механизма действия рассматривается как важный в реализации
гастропротекторного действия ВТД и ускорении заживления язвенного дефекта.
Дозозависимое увеличение продукции простагландина Е2 было показано в
экспериментальных и клинических исследованиях [17, 18]. Так, у больных с
язвенным поражением слизистой желудка после трех недель терапии ВТД концентрация
простагландина Е2 в слизистой антрального отдела желудка
увеличивалась на 54%, а в слизистой двенадцатиперстной кишки на 47% [18].
Одновременно с секрецией простагландинов возрастает и простагландинзависимая
продукция бикарбоната, что увеличивает буферную емкость слизи [19, 20]. Этот
эффект значительно снижается под влиянием нестероидных противовоспалительных
средств.
Влияние на ультраструктуру слизистой
В исследовании M. G. Moshal и соавт. (1979) у больных с язвой
двенадцатиперстной кишки применение ВТД в течение шести недель приводило к
эпителизации дефекта с формированием нормального эпителия без изменения
структуры микроворсинок (в отличие от циметидина) [21]. Предполагается, что
наряду с действием классически описываемых фармакологических эффектов висмута,
обеспечивающих защиту и восстановление слизистой, ускорению репарации эпителия в
зоне язвенного дефекта способствует предохранение висмутом эпидермального
фактора роста от гидролитического разрушения [17].
Наряду с этим обсуждается способность ВТД стимулировать мембранный Са2+-чувствительный
рецептор (CaSR), активируемый в норме внеклеточным Са2+ и
обеспечивающий повышение внутриклеточного Са2+, MAP-киназной
активности и, в итоге, пролиферацию эпителиальных клеток слизистой желудка [22].
В экспериментальных исследованиях на слизистой толстой кишки мышей показана
способность ионов Bi (III) за счет антагонизма с ионами Fe (III) подавлять
активность неамидированного гастрина и, таким образом, возможность снижения
избыточной гастрин-обусловленной пролиферации клеток [23].
Антихеликобактерная активность
Бактерицидное действие ВТД имеет очень важное значение. Под действием ионов
висмута H. pylori теряет способность к адгезии, снижается подвижность
микроорганизма, происходит вакуолизация и фрагментация клеточной стенки,
подавление ферментных системы бактерий, т. е. достигается бактерицидный эффект
(в отношении как вегетативных, так и кокковых форм H. pylori) [24–26].
Этот эффект при монотерапии ВТД хотя и незначителен (находится в пределах
14–40%), но не подвержен развитию резистентности и резко потенцируется при
одновременном назначении с антибиотиками.
Висмут проникает в H. pylori, преимущественно локализуясь в области
клеточной стенки микроорганизма. Он активно взаимодействует с нуклеотидами и
аминокислотами, пептидами и белками H. pylori. Хотя молекулярные
механизмы антихеликобактерного действия соединений висмута изучены не полностью,
ясно, что основными мишенями в микроорганизме все же являются белковые молекулы
(в том числе ферменты). Экспрессия примерно восьми белков подвергается up-
или down-регуляции при действии ионов висмута [27, 28].
J. R. Lambert и Р. Midolo сформулировали основные молекулярные механизмы
антихеликобактерного действия препаратов висмута [29], впоследствии дополненные
другими исследователями [27]:
1) блокада адгезии H. pylori к
поверхности эпителиальных клеток;
2) подавление различных ферментов, продуцируемых H. pylori (уреаза,
каталаза, липаза/фосфолипаза, алкилгидропероксидредуктаза и др.), и
трансляционного фактора (Ef-Tu);
3) прямое взаимодействие с белками теплового шока (HspA, HspB),
нейтрофил-активирующим белком (NapA), нарушение структуры и функции других
белков;
4) нарушение синтеза АТФ и других макроэргов;
5) нарушение синтеза, структуры и функции клеточной стенки и функции мембраны;
6) индукция свободнорадикальных процессов.
Одним из механизмов антибактериального действия ионов висмута является их
взаимодействие с комплексом клеточной стенки/гликокаликса, имеющимся у некоторых
микроорганизмов (в том числе у H. pylori), с вытеснением двухвалентных
катионов Mg2+ и Ca2+, необходимых для построения
полисахаридных цепочек. При этом происходит локальное ослабление участков
гликокаликса и выпирание клеточной стенки/мембраны через образовавшиеся «окна»,
что приводит к нарушению функционирования микроорганизма и может активировать
аутолитические процессы, приводящие к его гибели [30].
Предполагается, что попадание висмута в H. pylori опосредуется через
железотранспортные пути, а проникнув, он взаимодействует с участками связывания
Zn (II), Ni (II) и Fe (III) белков и ферментов, нарушая их функцию [31, 32].
Например, связывание ионов висмута с малыми цитоплазматическими белками Hpn и
Hpnl приводит к резкому нарушению их детоксицирующей и аккумулирующей функции
«хранилища» для ионов Ni [33].
H. pylori характеризуется необычной версией шаперонина GroES (т. е.
HpGroES), который обладает уникальным C-концом, богатым гистидином, цистеином и
имеющим три металл-связывающих остатка (с Zn (II)), что обеспечивает
сворачивание полипептидных цепей с формированием четвертичной структуры белка.
Висмут-содержащие препараты прочно прикрепляются на этом сайте, вытесняя
связанный цинк и, следовательно, вызывая резкое нарушение функции шаперонина
HpGroES [34].
Препараты висмута, проникая в H. pylori, способны индуцировать
мощный окислительный стресс в микроорганизме, что приводит к торможению
деятельности многих ферментов в целом. Потенцируется прооксидантное действие
подавлением активности тиоредоксина и алкилгидропероксидредуктазы (TsaA)
микроорганизма [27, 28].
Ингибирование таких важных для микроорганизма ферментов, как протеаза и
уреаза, является доказанным фактом в развитии антихеликобактерного эффекта ВТД
[4]. В минимальной ингибирующей концентрации ВТД подавляет общую протеазную
активность микроорганизма примерно на 87% [28].
Большое внимание привлекает взаимодействие висмута с ферментами цикла
трикарбоновых кислот микроорганизма (фумаратредуктазы, фумаразы),
обеспечивающего образование ряда биохимических прекурсоров (α-кетоглутарат,
сукцинил-КоА, оксалоацетат) и работающего как источник образования АТФ. В
результате уменьшается продукция макроэргов и подавляются многие энергозависимые
процессы (в том числе репаративные, двигательные), что отражается, например, на
скорости колонизации микроорганизмом различных отделов желудка [35, 36].
Потенцируется этот эффект блокадой локализованного в микробной стенке/мембране
дитиольного фермента Na+/K+-АТФазы, с которым ионы Bi
образуют стабильный комплекс [24].
В качестве еще одной ферментной мишени препаратов висмута рассматривается
алкогольдегидрогеназа, участвующая в продукции ацетальдегида, который,
секретируясь микроорганизмом, оказывает подавляющее действие на локальные
защитные факторы слизистой, ингибируя секрецию белка и нарушая связывание
пиридоксальфосфата с зависимыми ферментами [37].
Важное значение имеет также подавление висмутом активности фосфолипаз С и А2H. pylori [38, 39]. В качестве новых мишеней для антихеликобактерного
действия ВТД обсуждаются S-аденозилметионинсинтаза, альдолаза, фруктозобисфосфат
и протеин S6 30S-субъединицы рибосомы [39].
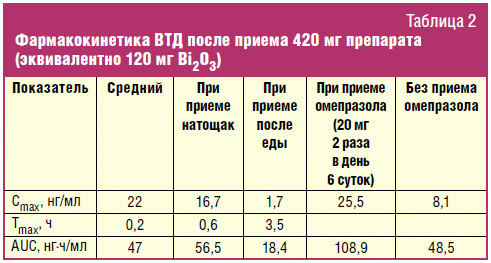
Фармакокинетика ВТД
После перорального приема ВТД концентрация висмута в слизи желудка и
слизистой сохраняется в пределах трех часов, после чего резко падает вследствие
нормального обновления слизи [40]. Несмотря на то, что небольшая часть
микропреципитатов ВТД может проникать в микроворсинки и путем эндоцитоза
попадать в клетки эпителия, точные механизмы транспорта висмута в системный
кровоток до настоящего времени неизвестны. Однако очевидно, что этот процесс
происходит преимущественно в верхнем отделе тонкой кишки [41].
Биодоступность препаратов висмута низкая и у ВТД составляет 0,2–0,5% от
введенной дозы [42, 43]. Н2-гистаминоблокаторы и ингибиторы протонной
помпы могут увеличивать этот показатель [44]. После попадания в кровь препарат
больше чем на 90% связывается с белками плазмы.
Измерение концентрации висмута в крови и моче после курсового применения ВТД
в дозе 360 мг/сут в течение 4–6 недель показало большую вариабельность этого
показателя. Так, концентрация висмута в крови варьировала от 9,3 до 17,7 мкг/л и
выходила на плато примерно к 4-й неделе применения препарата [45]. В отдельных
исследованиях были зафиксированы более высокие уровни препарата в крови (33–51
мкг/л), однако это не сопровождалось развитием побочных эффектов [46, 47].
Концентрация висмута в крови, как и площадь под фармакокинетической кривой, выше
в том случае, если препарат принимается утром, по сравнению с ранним вечерним
приемом [48].
В исследованиях на животных показано, что преимущественное накопление
препарата происходит в почках и в значительно меньшей концентрации он
обнаруживается в легких, печени, мозге, сердце и скелетной мускулатуре [49].
Особенности метаболизма и элиминации висмута изучены недостаточно. Период
полувыведения висмута из крови и мочи у пациентов с интоксикацией составляет
соответственно 5,2 и 4,5 дня [50]. У здоровых добровольцев и пациентов с
гастритом клиренс составляет примерно 22–102 мл/мин (медиана 55 мл/мин) и Т1/2
около 5 дней (Т1/2 β до 21 дня), что свидетельствует о тканевом депонировании
препарата и его медленной мобилизации оттуда [51]. На выведение препарата
оказывает влияние функция почек, и при ее ухудшении почечный клиренс препарата
может снижаться. Некоторые фармакокинетические показатели ВТД приведены в табл.
2.
Клиническая эффективность ВТД
ВТД является важным компонентом клинических схем антихеликобактерной терапии
либо в составе традиционной квадротерапии, либо в качестве дополнительного
компонента тройной терапии первой линии, что дает прирост эффективности
эрадикации на 15–20% [52, 53, 54]. В первую очередь, это обусловлено
способностью ВТД преодолевать резистентность H. pylori к антибиотикам
(особенно к кларитромицину), а не собственной бактерицидной активностью
препарата висмута [55–57]. Интерес представляет также включение ВТД в схемы
последовательной антихеликобактерной терапии [58].
Безопасность ВТД
Несмотря на статус тяжелого металла, висмут и его соединения считаются
нетоксичными, в отличие от расположенных рядом в периодической таблице мышьяка,
сурьмы, свинца и олова. Нетоксичность соединений висмута объясняется
преимущественно за счет их нерастворимости в нейтральных водных растворах и
биологических жидкостях и крайне низкой биодоступностью. Большинство соединений
висмута являются даже менее токсичными, чем хлорид натрия [59].
A. C. Ford и соавт. в рамках метаанализа, проведенного по публикациям баз
MEDLINE и EMBASE, включающего 35 рандомизированных контролируемых исследований и
4763 пациента, пришли к выводу, что терапия язвенной болезни желудка с
использованием препаратов висмута безопасна и хорошо переносится. Наиболее часто
встречающимся побочным эффектом является потемнение стула за счет образования
сульфида висмута [60].
У очень небольшой части больных может встречаться легкое кратковременное
повышение уровня трансаминаз, однако оно исчезает после окончания курса терапии.
Высокие дозы ВТД, применяемые длительное время, теоретически могут быть причиной
развития энцефалопатии, однако зафиксировано очень небольшое число таких
поражений центральной нервной системы. Наиболее манифестное, но обратимое
проявление висмутовой энцефалопатии описано у мужчины, получившего два
28-дневных курса ВТД с приемом 600 мг препарата 4 раза в день и принимавшего
периодически по 240 мг/сут в течение двух лет [61].
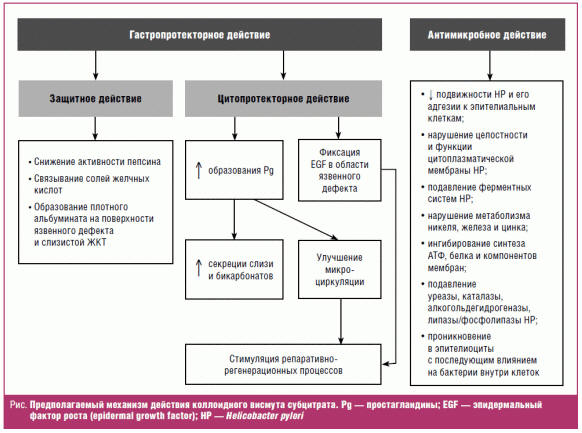
Заключение
Уникальность ВТД состоит в том, что он сочетает в себе свойства
гастропротекторного и антибактериального препарата. Его многокомпонентный
механизм действия обеспечивает защиту слизистой от воздействия различных
повреждающих факторов, а антихеликобактерная активность позволяет преодолевать
устойчивость H. pylori к антибиотикам, повышая эффективность
фармакотерапии. В общем виде совокупность отдельных компонентов механизма
действия препарата представлена на рис.
Новые направления создания препаратов висмута для лечения
гастроэнтерологических заболеваний включают разработку висмут-содержащих
наноструктур (bismuth-containing nanoparticles, Bi NPs). Так, созданный препарат
нанотрубок висмута субкарбоната обладает мощным действием в отношении H.
pylori (50% ингибирование в концентрации 10 мкг/мл) [62], а Bi NPs
потенциально активен против грамотрицательных микроорганизмов, включая P.
aeruginosa [63].
Наночастицы висмута в МИК 0,5 ммоль/л способны полностью подавлять
формирование биопленки S. mutans, что сравнимо с эффектом применения
хлоргексидина [64]. В работе тех же авторов водный коллоид наночастиц Bi2O3
со средним размером 77 нм эффективно угнетал рост и образование биопленок C.
albicans, не проявляя цитотоксичности [65]. Делаются попытки синтеза
висмут-фторхинолоновых комплексов, активных в отношении фторхинолон-резистентых
штаммов микроорганизмов [66].
Исчерпывающие сведения по современным направлениям медицинской химии
соединений висмута можно найти в обзоре J. A. Salvador и соавт. [67].
Литература
-
Yang N., Sun H. Biological chemistry of antimony and bismuth /
Biological chemistry of arsenic, antimony and bismuth/Sun H. (Ed.). Singapore:
John Wiley & Sons Ltd., 2011. 400 р. -
Li W., Jin L., Zhu N. et al. Structure of colloidal bismuth
subcitrate (CBS) in dilute HCl: unique assembly of bismuth citrate dinuclear
units ([Bi(cit)2Bi]2-) // J Am Chem Soc. 2003. Vol. 125, № 4. P. 2408–12409. -
Andrews P. C., Deacon G. B., Forsyth C. M. et al. Towards a
structural understanding of the anti-ulcer and anti-gastritis drug bismuth
subsalicylate // Angew Chem Int Ed Engl. 2006. Vol. 45, № 34. P. 5638–5642. -
Mendis A. H. W., Marshall B. J. Helicobacter pylori and bismuth /
Biological chemistry of arsenic, antimony and bismuth / Sun H (Ed.). Singapore:
John Wiley & Sons Ltd., 2011. 400 р. -
Morgenstern A., Bruchertseifer F., Apostolidis C. Bismuth-213 and
Actinium-225 — generator performance and evolving therapeutic applications of
two generator-derived alpha-emitting radioisotopes // Current
Radiopharmaceuticals. 2012. Vol. 5, № 3. P. 221–227. -
Lee S. P. A potential mechanism of action of colloidal bismuth
subcitrate; diffusion barrier to hydrochloric acid // Scand J Gastroenterol.
1982. Vol. 17, Suppl. 80. P. 17–21. -
Turner N. C., Martin G. P., Marriott C. The influence of native
porcine gastric mucus gel on hydrogen ion diffusion: the effect of potentially
ulcerogenic agents // J Pharm Pharmacol. 1985. Vol. 37, № 11. P. 776–780. -
Tasman-Jones C., Maher C., Thomsen L. et al. Mucosal defences and
gastroduodenal disease // Digestion. 1987. Vol. 37, Suppl. 2. P. 1–7. -
Williams D. R. Analytical and computer simulation studies of a
colloidal bismuth citrate system used as an ulcer treatment // J Inorg Nucl
Chem. 1977. Vol. 39, № 4. P. 711–714. -
Soutar R. L, Coghill S. B. Interaction of tripotassium dicitrato
bismuthate with macrophages in the rat and in vitro // Gastroenterology. 1986.
Vol. 91, № 1. P. 84–93. -
Coghill S. B., Hopwood D., McPherson S., Hislop S. The
ultrastructural localisation of De-Nol (colloidal tripotassium
dicitrato-bismuthate — TDB) in the upper gastrointestinal tract of man and
rodents following oral and instrumental administration // J Pathol. 1983. Vol.
139, № 2. P. 105–114. -
Hollanders D., Morrissey S. M., Mehta J. Mucus secretion in
gastric ulcer patients treated with tripotassium dicitrato bismuthate (De-Nol)
// Br J Clin Pract. 1983. Vol. 37, № 3. P. 112–114. -
Roberts N. B., Taylor W. H., Westcott C. Effect of cyclo-alkyl
lactamimides upon amylase, lipase, trypsin and chymotrypsin // J Pharm
Pharmacol. 1982. Vol. 34, № 6. P. 397–400. -
Baron J. H., Barr J., Batten J. et al. Acid, pepsin, and mucus
secretion in patients with gastric and duodenal ulcer before and after
colloidal bismuth subcitrate (De-Nol) // Gut. 1986. Vol. 27, № 5. P. 486–490. -
Wieriks J., Hespe W., Jaitly K. D. et al. Pharmacological
properties of colloidal bismuth subcitrate (CBS, De-Nol) // Scand J
Gastroenterol. 1982. Vol. 17, Suppl.80. P. 11–16. -
Stiel D., Murray D. J., Peters T. J. Uptake and subcellular
localisation of bismuth in the gastrointestinal mucosa of rats after short
term administration of colloidal bismuth subcitrate // Gut. 1985. Vol. 26, №
4. P. 364–368. -
Hall D. W.R., van de Hoven W. E. Protective properties of
colloidal bismuth subcitrate on the gastric mucosa // Scand J Gastroenterol.
1986. Vol. 21, Suppl. 122. P. 11–13. -
Estela R., Feller A., Backhouse C. et al. Effects of colloidal
bismuth subcitrate and aluminum hydroxide on gastric and duodenal levels of
prostaglandin E2 // Rev Med Chil. 1984. Vol. 112, № 10. P. 975–981. -
Konturek S. J., Bilski J., Kwiecien N. et al. De-Nol stimulates
gastric and duodenal alkaline secretion through prostaglandin dependent
mechanism // Gut. 1987. Vol. 28, № 12. P. 1557–1563. -
Crampton J. R., Gibbons L. C., Rees W. D. Effect of certain
ulcer-healing agents on amphibian gastroduodenal bicarbonate secretion //
Scand J Gastroenterol. 1986. Vol. 21, Suppl. 125. P. 113–118. -
Moshal M. G., Gregory M. A., Pillay C., Spitaels J. M. Does the
duodenal cell ever return to normal? A comparison between treatment with
cimetidine and denol // Scand J Gastroenterol. 1979. Vol. 14, Suppl. 54. P.
48–51. -
Gilster J., Bacon K., Marlink K. et al. Bismuth subsalicylate
increases intracellular Ca2+, MAP-kinase activity, and cell proliferation in
normal human gastric mucous epithelial cells // Dig Dis Sci. 2004. Vol. 49, №
3. P. 370–378. -
Kovac S., Loh S. W., Lachal S. et al. Bismuth ions inhibit the
biological activity of non-amidated gastrins in vivo // Biochem Pharmacol.
2012. Vol. 83, № 4. P. 524–530. -
Beil W., Bierbaum S., Sewing K. F. Studies on the mechanism of
action of colloidal bismuth subcitrate. I. Interaction with sulfhydryls //
Pharmacology. 1993. Vol. 47, № 2. P. 135–140. -
Wagner S., Beil W., Mai U. E. et al. Interaction between
Helicobacter pylori and human gastric epithelial cells in culture: effect of
antiulcer drugs // Pharmacology. 1994. Vol. 49, № 4. P. 226–237. -
Stratton C. W., Warner R. R., Coudron P. E., Lilly N. A.
Bismuth-mediated disruption of the glycocalyx-cell wall of Helicobacter pylori:
ultrastructural evidence for a mechanism of action for bismuth salts // J
Antimicrob Chemother. 1999. Vol. 43, № 5. P. 659–666. -
Ge R. G., Sun H. Z. Bioinorganic chemistry of bismuth and
antimony: target sites of metallodrugs // Acc Chem Res. 2007. Vol. 40, № 4. P.
267–274. -
Ge R. G., Sun X, Gu Q. et al. A proteomic approach for the
identification of bismuth-binding proteins in Helicobacter pylori // J Biol
Inorg Chem. 2007. Vol. 12, № 6. P. 831–842. -
Lambert J. R., Midolo P. The actions of bismuth in the treatment
of Helicobacter pylori infection // Aliment Pharmacol Ther. 1997. Vol. 11,
Suppl. 1. P. 27–33. -
Stratton C. W., Warner R. R., Coudron P. E., Lilly N. A.
Bismuth-mediated disruption of the glycocalyx-cell wall of Helicobacter pylori:
ultrastructural evidence for a mechanism of action for bismuth salts // J
Antimicrob Chemother. 1999. Vol. 43, № 5. P. 659–666. -
Tsang C. N., Ho K. S., Sun H., Chan W. T. Tracking Bismuth
anti-ulcer drug uptake in single Helicobacter pylori cells // J Am Chem Soc.
2011. Vol. 133, № 19. P. 7355–7357. -
Xia W., Li H., Sun H. Functional disruption of HypB, a GTPase of
Helicobacter pylori, by bismuth // Chem Commun (Camb). 2014. Vol. 50, № 13. P.
1611–1614. -
Li H., Sun H. Recent advances in bioinorganic chemistry of
bismuth // Curr Opin Chem Biol. 2012. Vol. 16, № 1–2. P. 74–83. -
Cun S, Sun H. A zinc-binding site by negative selection induces
metallodrug susceptibility in an essential chaperonin // Proc Natl Acad Sci
USA. 2010. Vol. 107, № 11. P. 4943–4948. -
Baer W., Koopmann H., Wagner S. Effects of substances inhibiting
or uncoupling respiratory-chain phosphorylation of Helicobacter pylori //
Zentralbl Bakteriol. 1993. Vol. 280, № 1. P. 253–258. -
Pitson S. M., Mendz G. L., Srinivasan S., Hazell S. L. The
tricarboxylic acid cycle of Helicobacter pylori // Eur J Biochem. 1999. Vol.
260, № 1. P. 258–267. -
Jin L., Szeto K. Y., Zhang L. et al. Inhibition of alcohol
dehydrogenase by bismuth // J Inorg Biochem. 2004. Vol. 98, № 8. P. 1331–1337. -
Ottlecz A., Romero J. J., Lichtenberger L. M. Effect of
ranitidine bismuth citrate on the phospholipase A2 activity of Naja naja venom
and Helicobacter pylori: a biochemical analysis // Aliment Pharmacol Ther.
1999. Vol. 13, № 7. P. 875–881. -
Tsang C. N., Bianga J., Sun H. et al. Probing of bismuth
antiulcer drug targets in H. pylori by laser ablation-inductively coupled
plasma mass spectrometry // Metallomics. 2012. Vol. 4, № 3. 277–283. -
Lambert J. R., Yeomans N. D. Campylobacter pylori —
gastroduodenal pathogen or opportunistic bystander? // Aust N Z J Med. 1988.
Vol. 18, № 4. P. 555–556. -
Coghill S. B., Hopwood D., McPherson S., Hislop S. The
ultrastructural localisation of De-Nol (colloidal tripotassium
dicitrato-bismuthate-TDB) in the upper gastrointestinal tract of man and
rodents following oral and instrumental administration // J Pathol. 1983. Vol.
139, № 2. P. 105–114. -
Treiber G., Gladziwa U., Ittel T. H. et al. Tripotassium
dicitrato bismuthate: absorption and urinary excretion of bismuth in patients
with normal and impaired renal function // Aliment Pharmacol Ther. 1991. Vol.
5, № 5. 491–502. -
Phillips R. H., Whitehead M. W., Lacey S. et al. Solubility,
absorption, and anti-Helicobacter pylori activity of bismuth subnitrate and
colloidal bismuth subcitrate: In vitro data do not predict In vivo efficacy //
Helicobacter. 2000. Vol. 5, № 3. P. 176–182. -
Nwokolo C. U., Prewett E. J., Sawyerr A. M. et al. The effect of
histamine H2-receptor blockade on bismuth absorption from three ulcer-healing
compounds // Gastroenterology. 1991. Vol. 101, № 4. P. 889–894. -
Lee S. P. Studies on the absorption and excretion of tripotassium
dicitrato-bismuthate in man // Res Commun Chem Pathol Pharmacol. 1981. Vol.
34, № 2. 359–364. -
Hamilton I., Worsley B. W., O’Connor H. J., Axon A. T. R. Effects
of tripotassium dicitrato bismuthate (TDB) tablets or cimetidine in the
treatment of duodenal ulcer // Gut. 1983. Vol. 24, № 12. P. 1148–1151. -
Dekker W., Dal Monte P. R., Bianchi Porro G. et al. An
international multi-clinic study comparing the therapeutic efficacy of
colloidal bismuth subcitrate coated tablets with chewing tablets in the
treatment of duodenal ulceration // Scand J Gastroenterol. 1986. Vol. 21,
Suppl.122. P. 46–50. -
Nwokolo C. U., Gavey C. J., Smith J. T. et al. The absorption of
bismuth from oral doses of tripotassium dicitrato bismuthate // Aliment
Pharmacol Ther. 1989. Vol. 3, № 1. P. 29–39. -
Wieriks J., Hespe W., Jaitly K. et al. Pharmacological properties
of colloidal bismuth subcitrate (CBS, DE-NOL) // Scand J Gastroenterol. 1982.
Vol. 17, Suppl.80. P. 11–16. -
Allain P., Chaleil D., Emile J. L’elevation des concentrations de
bismuth dans les tissus des malades intoxiques // Therapie. 1980. Vol. 35, №
3. P. 303–304. -
Froomes P. R., Wan A. T., Keech A. C. et al. Absorption and
eliminationof bismuth from oral doses of tripotassium dicitratobismuthate //
Eur J Clin Pharmacol. 1989. Vol. 37, № 5. P. 533–536. -
Ивашкин В. Т., Маев И. В., Лапина Т. Л. и др. Рекомендации
Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции
Helicobacter pylori у взрослых // Рос. журн. гастроэнтеролии гепатологии,
колопроктологии. 2012. № 1. C. 87–89. - Стандарты диагностики и лечения кислотозависимых и ассоциированных с
Helicobacter pylori заболеваний (Пятое московское соглашение) // Эксперимент.
клин. гастроэнтерол. 2013. № 5. С. 3–11. -
Маев И. В., Самсонов А. А., Коровина Т. И. и др. Висмута трикалия
дицитрат повышает эффективность антихеликобактерной терапии первой линии //
Эксперимент. клин. гастроэнтерол. 2012. № 8. C. 92–97. -
Williamson R., Pipkin G. A. Does bismuth prevent antimicrobial
resistance of Helicobacter pylori?/Helicobacter pylori. Basic Mechanisms to
Clinical Cure 1998/Ed. by R. H. Hunt, G. N. J. Tytgat. Dordrecht; Boston;
London: Kluwer Acad. Publ., 1998. P. 416–425. -
Yoon J. H., Baik G. H., Kim Y. S. et al. Comparison of the
eradication rate between 1-nd 2-week bismuth-containing quadruple rescue
therapies for Helicobacter pylori eradication // Gut Liver. 2012. Vol. 6, № 4.
P. 434–439. -
Sun Q., Liang X., Zheng Q. et al. High efficacy of 14-ay triple
therapy-based, bismuth-containing quadruple therapy for initial Helicobacter
pylori eradication // Helicobacter. 2010. Vol. 15, № 3. P. 233–238. -
Uygun A., Ozel A. M., Sivri B. et al. Efficacy of a modified
sequential therapy including bismuth subcitrate as first-line therapy to
eradicate Helicobacter pylori in a Turkish population // Helicobacter. 2012.
Vol. 17, № 6. P. 486–490. -
Salvador J. A., Figueiredo S. A., Pinto R. M., Silvestre S. M.
Bismuth compounds in medicinal chemistry // Future Med Chem. 2012. Vol. 4, №
11. P. 1495–1523. -
Ford A. C., Malfertheiner P., Giguere M. et al. Adverse events
with bismuth salts for Helicobacter pylori eradication: systematic review and
meta-analysis // World J Gastroenterol. 2008. Vol. 14, № 48. 7361–7370. -
Weller M. P. I. Neuropsychiatric symptoms following bismuth
intoxication // Postgraduate Medical Journal.
1988. Vol. 64, № 750. P. 308–310. -
Chen R., So M. H., Yang J. et al. Fabrication of bismuth
subcarbonate nanotube arrays from bismuth citrate // Chem Commun. 2006. Vol.
21. P. 2265–2267. -
Pelgrift R. Y., Friedman A. J. Nanotechnology as a therapeutic
tool to combat microbial resistance // Adv Drug Deliv Rev. 2013. Vol. 65, №
13–14. P. 1803–1815. -
Hernandez-Delgadillo R., Velasco-Arias D., Diaz D. et al.
Zerovalent bismuth nanoparticles inhibit Streptococcus mutans growth and
formation of biofilm // Int J Nanomedicine. 2012. Vol. 7. P. 2109–2113. -
Hernandez-Delgadillo R., Velasco-Arias D., Martinez-Sanmiguel J. J.
et al. Bismuth oxide aqueous colloidal nanoparticles inhibit Candida albicans
growth and biofilm formation // Int J Nanomedicine. 2013. Vol. 8. P.
1645–1652. -
Shaikh A. R., Giridhar R., Megraud F., Yadav M. R.
Metalloantibiotics: synthesis, characterization and antimicrobial evaluation
of bismuth-fluoroquinolone complexes against Helicobacter pylori. 2009. Acta
Pharm. 59, 259–271. -
Salvador J. A., Figueiredo S. A., Pinto R. M., Silvestre S. M.
Bismuth compounds in medicinal chemistry // Future Med Chem. 2012. Vol. 4, №
11. P. 1495–1523.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru




