Персонализированная медицина в педиатрии: перспективы и реалии
Е. Ю. Радциг, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова, Москва
Все чаще в последнее время в специальной литературе, на конгрессах и конференциях обсуждаются проблемы и причины развития неблагоприятной побочной реакции (НПР) на фоне приема различных лекарственных средств (ЛС) и способы избежать подобного. XX век, а точнее технологии, появившиеся в это время, значительно разнообразили количество и формы выпуска ЛС. Согласно регламенту, каждое оригинальное ЛС обязательно проходит целый ряд исследований, посвященных не только его эффективности, но и безопасности. Многочисленные отчеты содержат данные и о безопасности и переносимости обычных (указанных в инструкции) доз конкретного препарата в различных по численности популяционных выборках. Обязательным является описание переносимости оцениваемого препарата с указанием количества и описания НПР.
На практике же врач имеет дело с индивидуальным больным, т. е. он лечит конкретного пациента, который может достаточно разнообразно реагировать на стандартную лекарственную терапию. Более 75% ЛС разрешено к использованию у детей, но применение их продолжает вызывать интерес у специалистов.
Нeблагоприятные реакции на ЛС стоят на 5-м месте среди причин смертности в США [1]. По данным американской статистики более 2 млн неблагоприятных реакций приводят к госпитализации и более 100 тысяч летальных исходов из-за НПР наблюдается среди госпитализированных пациентов в год. Стоимость лечения неблагоприятных реакций составляет 78–117 биллионов долларов в год, что превышает ежегодную стоимость всех затрат на лечение. В 30% случаев НПР приводят к длительной и стойкой нетрудоспособности или смерти, ежегодно 26 тысяч детей умирают из-за НПР [1]. В Объединенном Королевстве неблагоприятные реакции на прием ЛС составляют 7% среди всех госпитализаций в стационар и в среднем встречаются у 15% (11–22%) госпитализированных пациентов.
У детей, особенно грудного и раннего возраста, повышен риск развития тяжелых НПР на прием ЛС. 11–15% детей госпитализируются в стационары. Этот процент выше среди детей с различными онкологическими заболеваниями. Несмотря на вышеприведенные данные, есть большой недостаток знаний о механизме и причинах развития НПР у детей. Одна из них — становление и дозревание различных систем, в том числе принимающих участие в метаболизме ЛС в организме, поэтому нельзя лечить ребенка как уменьшенную копию взрослого пациента. Самые юные пациенты не могут оценить или точно выразить оценку собственной переносимости ЛС. В ряде случаев отмечается недостаточность «детских» форм выпуска препарата [1, 2].
Вопросы эти актуальны, поэтому в ряде стран (Канада) формируются национальные сети «лекарственной безопасности» [1]. В основу их создания легла гипотеза, что значительную часть серьезных НПР вызывают наследственно детерминированные отличия в генах лекарственного метаболизма. Поэтому определение генетических факторов, вызывающих специфические НПР, и разработка специальных диагностических тестов позволят предотвратить и избежать подобных серьезных НПР, не препятствуя получению (приему) больными ЛС. На сегодняшний день существует несколько способов проспективного клинического генотипирования, причем быстрого (результат в пределах 24 часов). Авторы [1] полагают данный метод (названный фармакогеномикой) перспективным при проведении химиотерапии, изучении потенциальной ото- и кардиотоксичности. Способы достижения цели различны: назначение альтернативного препарата, изменение дозы стандартно назначаемого ЛС, усиление мониторинга за пациентами из групп риска по развитию НПР, превентивные меры (прием антидотов против продуктов обмена ЛС, вызывающих серьезные НПР). Таким образом, новые технологии дадут возможность уточнить причины НПР на генетическом уровне, предотвратить их, снизить затраты на лечение и существенно повысить его безопасность. Фармакогеномика предлагается как один из способов перехода к персонализированной медицине, своего рода прообразу (идеалу) медицины будущего. Данный путь интересен, но пока больше теоретически, так как не доступен широкому кругу врачей, особенно амбулаторного звена. Но на фармацевтическом рынке РФ есть целая группа ЛС, которая практически не вызывает развития НПР и подбирается строго индивидуально. Речь идет о гомеопатических препаратах.
В последние десятилетия ведущие профессиональные медицинские журналы регулярно публикуют статьи о гомеопатии, о ключе к новому пониманию человека и его взаимодействии с окружающей средой и о том, что в сочетании с современными медицинскими технологиями она принесет большую пользу пациентам. Разведения гомеопатических препаратов (высокие, «не материальные») противостоят общепринятым терапевтическим дозам (с макро- и микромолекулами). В результате запускается целый каскад реакций, которые приводят к саморегулированию функций как отдельных органов и систем, так и целостного организма. Поэтому классическим является подбор одного препарата, индивидуального для каждого конкретного больного во всей взаимосвязи его психических и физиологических проявлений. В то же время в практике врачей-гомеопатов использование двух и более простых лекарственных веществ стало обычным. Поочередное или одномоментное их назначение, в сущности, мало чем отличается от назначения комплексного гомеопатического препарата. Комплексные гомеопатические препараты, представленные в настоящее время на фармацевтическом рынке РФ, вне зависимости от места производства, проходят обязательную государственную регистрацию с выдачей номерного регистрационного удостоверения. В отличие от классических гомеопатических препаратов, часто они выпускаются в лекарственных формах, привычных для врачей-аллопатов, и имеют конкретные разовые и/или курсовые дозы.
Показания к применению комплексных гомеопатических препаратов различны, получили широкое распространение они и в педиатрической практике. Высокая эффективность и безопасность делают перспективным использование их в профилактике наиболее распространенной патологии — острой респираторной вирусной инфекции (ОРВИ). В отличие от гриппа, многообразие возбудителей делает невозможным проведение специфической профилактики данной патологии. Особую группу риска составляют дети в организованных детских коллективах, грудного и раннего возраста.
Оценка эффективности и безопасности одного из таких препаратов — Оциллококцинума проводилась неоднократно [3, 4] (рис. 1, 2). В отличие от других препаратов, для профилактики достаточно принимать препарат Оциллококцинум 1 раз в неделю, независимо от возраста. Если же появились симптомы ОРВИ, то в первые сутки болезни препарат принимают 3 раза, а в следующие трое суток — два раза в день (утром и вечером).
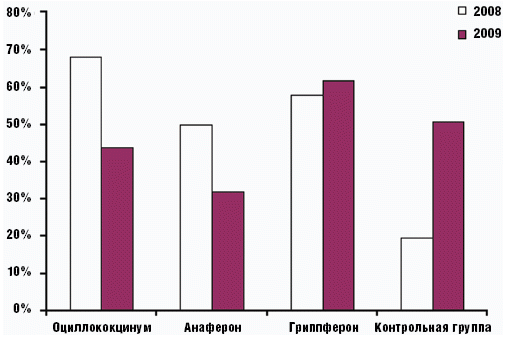
Рис. 1. Заболеваемость детей в организованных детских коллективах на фоне проводимых профилактических мероприятий
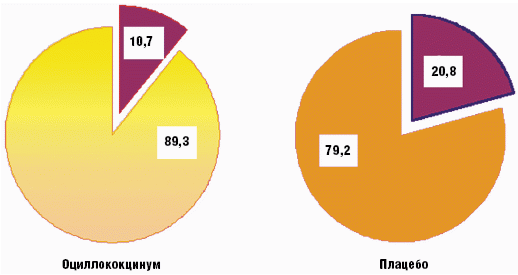
Рис. 2. Профилактическая эффективность препарата Оциллококцинум у детей грудного и раннего возраста
Многокомпонентность состава делает перспективным использование другого гомеопатического препарата, сиропа Стодаль, в лечении различных видов кашля, в том числе и в ситуациях, когда использование аллопатических ЛС не оказало должного эффекта. Чаще это встречается при терапии хронического кашля, который по данным литературы [5] наблюдается у 7–10% детей. В определенном проценте случаев такие пациенты уже принимали аллопатические противокашлевые препараты. Гомеопатические противокашлевые препараты в течение ряда лет присутствуют на фармацевтическом рынке РФ, но назначение их как стартового средства встречается не так часто, хотя проведено несколько исследований [6, 7], доказывающих их эффективность у разных групп пациентов (рис. 3, 4). Дозировки препарата стандартны (взрослым по 1 столовой ложке, детям до 12 лет по 1 чайной ложке 3–5 раз в день), а вот длительность курса различна. При остром кашле она составляет 5–7 дней, а в случае хронического кашля целесообразно пролонгировать прием препарата до 10–14 дня.
Интерес к гомеопатическому методу лечения растет из года в год. Комплексные гомеопатические препараты помогают более широкому кругу врачей использовать данный метод в своей повседневной деятельности.
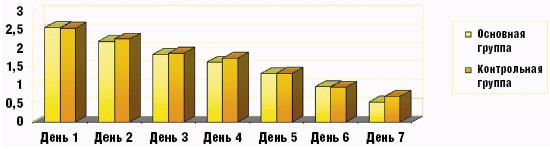
Рис. 3. Эффективность препарата Стодаль в терапии острого кашля у детей
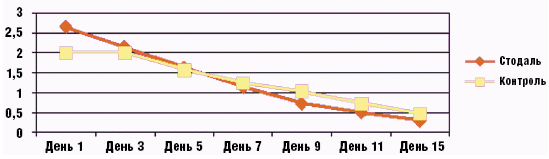
Рис. 4. Эффективность препарата Стодаль в терапии хронического кашля у детей
Литература
- Hayden M. R. Pharmacogenomics // Acta Paediatrica. Abstracts from II Excelence in Paediatrics conference. 2010, 2–4, 12, p. 21. London, UK.
- Napoleone E., Mele G. Medicines for children: the proactive approach of the FIMP-MCRN // Acta Paediatrica. Abstracts from II Excelence in Paediatrics conference. 2010, 2–4, 12, p. 113. London, UK.
- Селькова Е. П., Волчецкий А. П., Богомильский М. Р., Радциг Е. Ю., Лапицкая А. С. Влияние Оциллокоцинума на интерферонообразование у часто болеющих детей // Педиатрия. Consilium medicum. 2009, № 4, с. 3–7.
- Самсыгина Г. А., Казюкова Т. В., Радциг Е. Ю., Богомильский М. Р. Профилактика и терапия острых респираторных заболеваний с использованием гомеопатических средств // Педиатрия. 2008, т. 87, № 5, с. 24–28.
- Sczdding G. Interactions between upper and lower airway // Acta Paediatrica. Abstracts from II Excelence in Paediatrics conference. 2010, 2–4, 12, p. 36. London, UK.
- Селькова Е. П, Гренкова Т. А. Эффективность комплексных гомеопатических препаратов в период сезонного всплеска заболеваемости // Педиатрия. Consilium medicum. 2007, № 2, с. 13–18.
- Радциг Е. Ю. Кашель у детей: дифференциальный диагноз и лечение // Педиатрия. Приложение к Consilium medicum. 2010. № 1, с. 20–23.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru