Введение
Обильное менструальное кровотечение (ОМК) — это чрезмерная менструальная кровопотеря (меноррагия, полименорея) по длительности (более 8 дней), объему (более 80 мл) и частоте (менее 24 дней), оказывающая негативное влияние на физическое, социальное, эмоциональное, материальное благополучие женщины [1, 2]. Распространенность ОМК достигает 30% среди пациенток репродуктивного возраста на фоне гормонально-ассоциированных пролиферативных заболеваний (органическая патология) и/или овуляторных дисфункций (неорганическая патология) [3]. Сопровождаясь развитием анемии различной степени, синдром хронической ОМК усугубляет психосоматическое здоровье и адаптационный потенциал женщин на фоне сидеропении тканей [4]. В мире на фоне ОМК анемия диагностируется у полумиллиарда женщин. Анализ соотношений коморбидности между снижением качества жизни пациенток с хроническими ОМК и развивающейся в 25% случаев на этом фоне анемией в мировых и отечественных исследованиях продемонстрировал доминирующую роль в развитии анемии дефицита железа — жизненно необходимого микроэлемента для эритропоэза, окислительного метаболизма, клеточного иммунитета, каталитической активности ферментов, тканевого дыхания, что создало предпосылки патогенетически оправданного назначения ферротерапии при комплексном лечении данных пациенток [5, 6].
Необходимость адекватной коррекции и профилактики железодефицитных состояний регламентирована международными медицинскими организациями, в том числе ВОЗ, FIGO. В российских клинических рекомендациях по железодефицитной анемии (ЖДА) в качестве «золотого стандарта» патогенетической терапии указаны железосодержащие препараты, преимущественно в пероральной форме, в виде солей различной валентности, [7]. Однако низкая биодоступность этих солей, как органических (глюконат, фумарат), так и неорганических (сульфат, хлорид), а также побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ) ограничивают лечение [8]. В результате на фоне нежелательных органолептических свойств и диспепсических расстройств со стороны ЖКТ отмечается низкая приверженность пероральной ферротерапии в 21% случаев [9]. Важно учитывать, что пероральная терапия препаратами железа может оказаться не только неэффективной, но и опасной при продолжающейся кровопотере и особенно при наличии сопутствующей гинекологической и соматической патологии [10]. Сопутствующие воспалительные заболевания органов малого таза (ВЗОМТ) или кишечника (в 16–74% случаев) и онкологические заболевания способствуют экспрессии гепцидина, важнейшего селективного регулятора метаболизма железа, синтезируемого на фоне провоспалительных цитокинов, с последующим связыванием и распадом ферропортина [11]. Деградация ферропортина в гепатоцитах, энтероцитах и макрофагах препятствует транспорту железа в плазму, блокируя конкурентный доступ к железу. В результате происходит недостаточное насыщение трансферрина и уменьшается доставка железа к развивающемуся эритробласту. При этом лабораторное обследование демонстрирует формальные признаки повышения запасов железа (повышение уровня ферритина выше нормы) и одновременно его дефицит (снижение насыщения трансферрина железом до значений меньше 20%) [12]. Образуется значительное количество атомов железа, не связанного с трансферрином (NTBI). Это слабосвязанное трехвалентное железо (Fe3+) может нерегулируемым образом откладываться внутри клеток эндокринной системы, сердца и печени с образованием активных форм кислорода (ферроптоз), оказывающих угнетающее действие на лимфоидную систему с негативными последствиями. Следует учесть, что неабсорбированные соли железа при сопутствующей воспалительной патологии могут быть токсичными для слизистой оболочки кишечника и провоцировать избыточный бактериальный рост [13]. Нежелательные явления и последствия применения пероральных препаратов железа создали предпосылки для разработки инновационных форм пре-одоления желудочного барьера и таргетной доставки железа к эритроцитам с последующим изучением клинической эффективности таких препаратов.
В 2015 г. были представлены данные о клинической апробации инновационного перорального препарата пирофосфата железа (III) в сукросоме — сукросомального железа (СЖ) [14].
Сукросома представляет собой фосфолипидный бислой (липосому), поверх которого расположена оболочка из эфира сахарозы — сукрестор [15]. Сукросома обеспечивает защиту атомов железа от воздействия желудочного сока и осуществляет таргетную доставку пирофосфата Fe3+ путем эндоцитоза специфическими энтероцитами, М-клетками тонкого кишечника и затем макрофагами в печень, обусловливая гепцидин-независимый путь с высокой биодоступностью и минимальными побочными эффектами. Введение в состав аскорбиновой кислоты в количестве 70 мг позволило повысить стабильность сукросомы с дополнительной защитой клеток от свободных радикалов, поддержанием иммунитета и синтеза коллагена, . Сукросомальная технология обеспечила уникальные структурные физико-химические и фармакокинетические характеристики, благодаря которым достигаются высокая биодоступность железа и отличная переносимость при прохождении через ЖКТ. Апробированное в странах Западной Европы как in vitro [16], так и in vivo [17], продемонстрировавшее отличную переносимость и клиническую эффективность при небольших дозировках — 14 мг (СидерАЛ® Инт.) и 30 мг (СидерАЛ® Форте), СЖ показало высокую степень безопасности и эффективность, превышающую действенность классических препаратов, сопоставимую с внутривенными железосодержащими средствами [16, 18–21]. Так, применение СЖ оказалось высокоэффективным у пациенток с опухолями женской репродуктивной системы благодаря отсутствию побочных эффектов, высокой биодоступности и гепцидин-независимомому механизму всасывани [22]. Исследования, проведенные Н.И. Стукловым и соавт. [23, 24], подтвердили высокую приверженность ферротерапии с использованием СидерАЛ® Форте на фоне отличной терапевтической эффективности с минимумом побочных эффектов. M. Scardino et al. [25] показали целесообразность применения СЖ в период предоперационной подготовки для улучшения результатов оперативного лечения. Отечественные исследователи [24, 26] продемонстрировали более высокую терапевтическую эффективность СидерАЛ® Форте в сравнении с внутривенной ферротерапией у пациентов с воспалительными заболеваниями кишечника. Анализ имеющихся фактических данных подтверждает, что пероральный прием СЖ является обоснованным вариантом лечения ЖДА. СЖ более эффективно, переносится лучше, чем пероральные соли железа [27]. Также была продемонстрирована аналогичная эффективность СЖ при меньших рисках у пациентов, обычно получавших железо путем внутривенного введения (например, при хронических заболеваниях почек, злокачественных новообразованиях, после бариатрических операций) [28]. Таким образом, СЖ по праву занимает ведущее место в первой линии лечения ЖДА, особенно при непереносимости традиционных пероральных препаратов железа или их неэффективности (например, при ЖДА на фоне хронического воспаления). Кроме того, СЖ следует рассматривать в качестве альтернативы внутривенным препаратам железа для начального и/или поддерживающего лечения. Хорошая переносимость препарата без побочных явлений — залог высокой приверженности терапии.
Цель исследования: оценка клинической эффективности СЖ (СидерАЛ® Форте) при лечении ЖДА 1–2-й степени тяжести у пациенток c синдромом ОМК на фоне овуляторных дисфункций.
Материал и методы
Проведено проспективное рандомизированное многоцентровое клиническое наблюдательное исследование в медицинских учреждениях Москвы и Екатеринбурга. Исследование проводилось в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации, формулирующей этические принципы медицинских исследований с привлечением человека в качестве субъекта. Все пациентки подписали информированное добровольное согласие на участие в исследовании. Всего было отобрано 110 пациенток с верифицированной на основании гематологических и феррокинетических показателей периферической крови ЖДА 1–2-й степени тяжести, развившейся на фоне ОМК в результате овуляторных дисфункций (АМК-0 по классификации FIGO (PALM-COEN), версии 2018 г.) [29]. Обследование включало в себя сбор анамнеза, изучение течения заболевания, общеклиническое и гинекологическое обследование, УЗИ органов малого таза для верификации диагноза. Лабораторными методами исследовались эритроцитарные показатели: гемоглобин (Hb), гематокрит, эритроциты, средний объем эритроцитов, скорость оседания эритроцитов; показатели обмена железа: сывороточное железо, ферритин сыворотки, насыщение трансферрина железом, общая железосвязывающая способность; уровень гормонов в крови: фолликулостимулирующий гормон, лютеинизирующий гормон, эстрадиол, пролактин, прогестерон, тестостерон, тиреотропный гормон с оценкой по фазам менструального цикла для верификации диагноза; система гемостаза: коагулограмма для исключения коагулопатий. Все пациентки имели исходный уровень Hb от 80 до 120 г/л со снижением уровня ферритина ниже 15 нг/л, сывороточной концентрации железа — 12–30 мкмоль/л, общей железосвязывающей способности сыворотки — 30–85 мкмоль/л (согласно критериям ВОЗ), на основании чего был поставлен диагноз ЖДА 1–2-й степени тяжести.
Эритроцитарные показатели и показатели обмена железа исследовались в лаборатории «Ситилаб» до назначения ферротерапии и через 30 и 60 дней после начала лечения. Для оценки переносимости пероральной ферротерапии проводили анкетирование пациенток с фиксацией жалоб на нарушение функции ЖКТ.
Пациентки были включены в исследование в соответствии с критериями включения и невключения. Критерии включения: нозологическая форма заболевания: «ЖДА 1–2-й степени тяжести, ОМК на фоне овуляторных дисфункций (АМК-0)»; длительность заболевания от 1 мес. до 1 года; важные гемодинамические и феррокинетические показатели: Hb, ферритин, сывороточное железо, общая железосвязывающая способность сыворотки; гормоны крови; отсутствие терапии до отбора в исследование; возраст 18–45 лет; рост и масса тела без ограничений; раса, национальность, профессия, регион без ограничений; способность пациентки выполнять требования протокола. Критерии невключения: декомпенсированная экстрагенитальная патология; органические причины ОМК; анемия 3-й степени тяжести (Hb менее 80 г/л), терапия препаратами железа в течение последнего года; серьезное нарушение протокола.
В основную группу вошли 74 пациентки, которым с 1-го дня после установления диагноза ЖДА назначалось СЖ 30 мг (СидерАЛ® Форте) по 1 капсуле 2 р/сут 60 дней + комбинированные оральные контрацептивы (КОК) с биоидентичным эстрогеном (эстрадиола валерат) и диеногестом (Клайра) с 1-го дня менструального цикла по 1 таблетке 1 р/сут по схеме: прием 26 дней + перерыв 2 дня, с повторением лечения в течение еще двух менструальных циклов.
В контрольную группу вошли 36 пациенток, которым после установления диагноза ЖДА назначалось липосомальное железо (Железо липосомальное от «Эвалар») 30 мг по 1 капсуле 2 р/сут 60 дней + КОК с биоидентичным эстрогеном и диеногестом (Клайра) с 1-го дня менструального цикла по 1 таблетке 1 р/сут по схеме: прием 26 дней + перерыв 2 дня, с повторением лечения в течение еще двух менструальных циклов.
Отличие между препаратами для терапии ЖДА (СЖ и липосомальное железо) заключалось в инновационной оболочке вокруг пирофосфата железа (сукросома), обеспечивающей повышение биодоступности перорального железа и устойчивость к воздействию желудочного сока с одновременным снижением побочных эффектов. Комбинированная пероральная контрацепция в виде биоидентичного эстрогена/диеногеста назначалась с 1-го дня менструального цикла для гемостаза и патогенетической терапии овариальных дисфункций всем пациенткам. Выбор КОК был основан на Клинических рекомендациях по аномальным маточным кровотечениям и показаниях к применению биоидентичного эстрогена/диеногеста.
Для изучения оценки эффективности СЖ методом опроса изучали жалобы, переносимость препарата, наличие побочных эффектов, приверженность терапии через 30 и 60 дней после начала лечения.
Статистическую обработку данных проводили с помощью программного пакета SPSS Statistics, версия 23.0. Количественные и качественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка (при числе исследуемых менее 50) или критерия Колмогорова — Смирнова (при числе исследуемых более 50). Количественные данные, имеющие нормальное распределение, описаны как M±m, где M — средний показатель, m — ошибка репрезентативности среднего показателя. Достоверность различий проверяли с помощью параметрических и непараметрических методов статистики, критерия χ2 Пирсона с поправкой Йейтса. При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовали критерий Уилкоксона. Уровень значимости при проверке статистических гипотез в данном исследовании считали критическим при p<0,05.
Результаты и обсуждение
Обследованные и включенные в исследование пациентки основной и контрольной групп были сопоставимы по возрасту, паритету, клиническим проявлениям заболевания, тяжести анемии. Средний возраст пациенток в группах составил 38,9±4,7 и 37,4±4,2 года соответственно (χ2=1,347, р=0,867). Причинами развития ОМК у всех пациенток явились овуляторные дисфункции на фоне поликистоза яичников с персистенцией фолликулов, недостаточностью лютеиновой фазы цикла и относительной гиперэстрогенией, результатом которых была неравномерная пролиферация эндометрия с очагами гиперплазии, что и привело к ОМК и развитию ЖДА как крайней степени дефицита депонирования железа, нарушению образования Hb и развитию органической тканевой гипоксии.
Обследованные пациентки предъявляли жалобы на длительные менструации (более 8 дней) в 32 (29,1%) случаях, на обильные менструации в 63 (57,3%) случаях, на частые менструации с продолжительностью цикла 20–23 дня в 15 (13,6%) случаях, отмечаемые за последние 6 мес. — 1 год. Среди симптомов анемии отмечалось головокружение — 45 (40,9%) наблюдений, слабость — 58 (52,7%), снижение работоспособности — 62 (56,4%). Предъявляемые жалобы могли свидетельствовать о влиянии хронической кровопотери на гомеостаз железа со снижением качества жизни в результате нарушения митохондриального переноса электронов в тканях поперечно-полосатой мускулатуры на фоне железодефицитного состояния [30]. У 28 (25,5%) пациенток были жалобы на частые (более четырех раз за последний год) острые респираторные вирусные инфекции на фоне ОМК, что могло свидетельствовать о влиянии железодефицитного состояния на иммунный гомеостаз, активность нейтрофилов, Т-лимфоцитов, макрофагов [31]. При объективном обследовании обращала на себя внимание бледность кожных покровов и слизистых у 75 (68,3%) пациенток.
Через 30 дней после назначения ферротерапии 72 (97,3%) пациентки основной группы и 33 (91,7%) — контрольной отмечали снижение головокружения, слабости и повышение работоспособности (χ2=2,764, р=0,648). Через 60 дней после назначения ферротерапии практически все пациентки основной группы и 34 (94,4%) пациентки контрольной группы отмечали отсутствие слабости и головокружения, что свидетельствовало о высокой клинической эффективности инновационных форм железосодержащих продуктов.
Данные лабораторной оценки гематологических и феррокинетических показателей терапевтической эффективности сукросомального и липосомального железа до назначения ферротерапии и через 30 и 60 дней после проведенного лечения представлены в таблице.
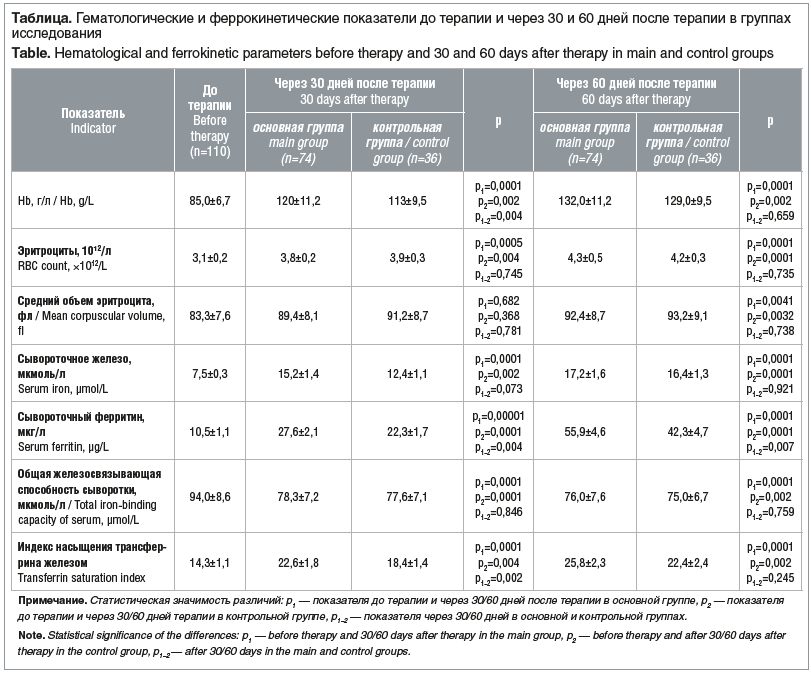
Как видно из данных, представленных в таблице, на фоне терапии СЖ уровень Hb восстановился уже после 30 дней лечения, что свидетельствует о значительно более высокой терапевтической эффективности в сравнении с липосомальным железом, прием которого привел к нормализации уровня Hb лишь спустя 60 дней после начала лечения. Если учесть, что хорошей терапевтической эффективностью перорального железа является повышение уровня Hb на 10 г/л за месяц, то данные инновационные формы (сукросомальное® и липосомальное железо) демонстрируют прекрасный эффект, но только сукросома позволяет практически полностью осуществить таргетную доставку Fe3+ в печень благодаря эндоцитозу. Практически у всех пациенток после приема СЖ констатировали коррекцию железодефицитного состояния уже через 30 дней, тогда как в контрольной группе результаты после приема липосомального железа были статистически незначимыми, и достигли они значений основной группы только через 60 дней терапии.
Наряду с Hb не менее значимым является показатель сывороточного ферритина, сниженный на фоне абсолютного дефицита железа у пациенток гинекологического профиля в результате ОМК. Следует обратить внимание на то, что сопутствующая патология в виде воспалительных или онкологических заболеваний способствует повышению уровней гепцидина и ферритина, ассоциированных с повышенным содержанием медиаторов воспаления. И в этом случае сывороточный ферритин не будет являться достоверным показателем железодефицитного состояния. В настоящем исследовании показатель сывороточного ферритина более значительно повысился после приема СЖ (через 30 дней ферротерапии) в сравнении с липосомальным железом, тогда как через 60 дней терапии значимых отличий между данными параметрами не выявлено. Также следует отметить значимое повышение показателей насыщения трансферрина железом и сывороточного железа в обеих группах уже после 30 дней ферротерапии, статистически значимых различий между данными показателями после приема сукросомального и липосомального железа не выявлено.
Учитывая положительную динамику гематологических и феррокинетических показателей и достижения нормативных значений уже после 30 дней приема СЖ, в последующие месяцы приема возможно снижение дозировки до 30 мг. Терапия показана до полного насыщения железом депо (печень, селезенка) и должна продолжаться не менее двух месяцев после нормализации уровня Hb.
Проведенное анкетирование пациенток для выявления жалоб и побочных эффектов ферротерапии сукросомальным и липосомальным железом выявило следующее. Пациентки, принимавшие СЖ, практически не ощущали побочных реакций со стороны ЖКТ, кроме окрашивания стула у 1 (1,4%) пациентки. В то же время липосомальное железо вызвало незначительные побочные эффекты (тошнота, диспепсия) у 2 (5,5%) пациенток, возможно связанные с дезинтеграцией липосомы под действием желудочного сока, тогда как сукросома более прочно сохраняет оболочку до поступления через лимфу в печень, где освобождается от оболочки и включается в метаболизм [32].
Таким образом, в результате ферротерапии СЖ у женщин с ЖДА 1–2-й степени на фоне ОМК наблюдалось повышение уровня Hb более 20 г/л через 30 дней приема у 65 (87%) пациенток, через 60 дней — у 73 (98,6%), что свидетельствовало о более высокой терапевтической эффективности в сравнении с липосомальным железом (69,4 и 88,8% соответственно, χ2=13,456, р=0,0001). Наблюдалась более высокая приверженность терапии при приеме СЖ (98,6%) в сравнении с липосомальным железом (86,1%, χ2=12,382, р=0,0001) ввиду минимальной частоты (1,4%) побочных эффектов в сравнении с группой контроля (5,5%, χ2=10,724, р=0,0002).
Полученные показатели применения СЖ у пациенток с ЖДА 1–2-й степени при ОМК оказались сопоставимы с результатами его использования при анемии, обусловленной другой соматической патологией. Так, в работе Н.И. Стуклова [33] демонстрируется подъем уровня Hb более чем на 20 г/л за 8 нед. лечения СЖ у 95% пациенток онкологического профиля, что сопоставимо с результатами парентерального применения препаратов железа. Возможности преодоления ферропортин-гепцидинового блока путем приема СЖ показаны при лечении 80 пациенток с ЖДА на фоне заболеваний ЖКТ. В течение 4 нед. приема СЖ отмечено значимое повышение содержания Hb (+37,5 г/л) и ферритина (+134 мкг/л) на фоне минимальных побочных эффектов, свидетельствующих о высокой приверженности терапии [34, 35].
Заключение
Таким образом, пероральная ферротерапия СЖ является обоснованным вариантом лечения ЖДА у пациенток с ОМК благодаря более высокой эффективности в сравнении с липосомальной формой железа. Статистически значимое повышение показателей железа у пациенток фиксируется уже через 30 дней лечения, при этом практически не наблюдается побочных эффектов, что обусловлено уникальными структурными, физико-химическими и фармакокинетическими характеристиками сукросомы, которые обеспечивают, с одной стороны, защиту СЖ от действия желудочного сока, исключая контакт со слизистой ЖКТ, с другой стороны — всасывание через специальные М-клетки слизистой тонкого кишечника с дальнейшим высвобождением железа в клетках печени.
Сведения об авторах:
Кононова Ирина Николаевна — д.м.н., доцент кафед-ры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; заместитель директора ООО «МЦДПО»; 125424, Россия, г. Москва, Волоколамское ш., д. 73; ORCID iD 0000-0003-3483-9464.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2786-6181.
Карева Елена Николаевна — д.м.н., профессор кафедры молекулярной фармакологии и радиобиологии им. П.В. Сергеева РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; профессор кафедры фармакологии лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0001-6861-6512.
Шмакова Надежда Александровна — врач акушер-гинеколог первой категории ООО МЦ «Ангио Лайн Плюс»; 620027, Россия, г. Екатеринбург, ул. Большакова, д. 95; ORCID iD 0000-0002-4797-3876.
Грабан Ирина Владимировна — врач акушер-гинеколог высшей категории ООО Медицинский центр «Эдельвейс»; 620144, Россия, г. Екатеринбург, ул. 8 Марта, д. 146.
Огурцова Татьяна Александровна — врач акушер-гинеколог высшей категории ГБУЗ СО «ЕКПЦ»; 620137, Россия, г. Екатеринбург, ул. Комсомольская, д. 9; ORCID iD 0000-0001-6180-0288.
Контактная информация: Кононова Ирина Николаевна, e-mail: irkonmed@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 19.10.2023.
Поступила после рецензирования 14.11.2023.
Принята в печать 30.11.2023.
About the authors:
Irina N. Kononova — Dr. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Deputy Director of Transregional Center for Continuing Professional Education LLC; 73, Volokolamskoe Road, Moscow, 125424, Russian Federation; ORCID iD 0000-0003-3483-9464.
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117321, Russian Federation; ORCID iD 0000-0003-2786-6181.
Elena N. Kareva — Dr. Sc. (Med.), Professor of the Department of Molecular Pharmacology and Radiobiology named after P.V. Sergeev, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117321, Russian Federation; Professor of the Department of Pharmacology of the Faculty of Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, bldg. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-6861-6512.
Nadezhda A. Shmakova — obstetrician-gynecologist of the first category, Medical Center «Angio Line Plus» LLC; 95, Bolshakova str., Yekaterinburg, 620027, Russian Federation; ORCID iD 0000-0002-4797-3876.
Irina V. Graban — obstetrician-gynecologist of superior category, Medical Center «Edelweiss» LLC; 146, 8 Marta str., Yekaterinburg, 620144, Russian Federation.
Tatiana A. Ogurtsova — obstetrician-gynecologist of superior category, Yekaterinburg Clinical Perinatal Center; 9, Komsomolskaya str., Yekaterinburg, 620137, Russian Federation; ORCID iD 0000-0001-6180-0288.
Contact information: Irina N. Kononova, e-mail: irkonmed@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 19.10.2023.
Revised 14.11.2023.
Accepted 30.11.2023.
Информация с rmj.ru





