Введение
Одной из важнейших и до сегодняшнего дня нерешенных проблем в урологической практике является нарушение репродуктивной функции у мужчин, ассоциированное с хроническим простатитом / синдромом хронической тазовой боли (ХП/СХТБ), или хронический абактериальный простатит (ХАП) [1–3]. При этом ХАП имеет характерную клиническую картину заболевания, как правило, связанную с наличием бактериального таксона, обусловливающего характерное течение патологического процесса в предстательной железе (ПЖ) [4–6]. В большинстве случаев ХАП проявляется различными нарушениями функции урогенитального тракта у мужчин, возникающими при патологических состояниях в ПЖ, от инфекционного домена до неврологического и психоэмоционального включительно [1].
Вопрос о таксономической структуре микробиоты ПЖ до сих пор остается недостаточно изученным, как и определение роли патогенных микроорганизмов (МО), ответственных за возникновение и развитие ХАП [4–7]. В. Lobel и А. Rodriguez [8] предложили классифицировать МО, ассоциированные с простатитом, на 5 категорий — в зависимости от их роли в этиопатогенезе этого заболевания, а также, возможно, в поддержании нормальной микробиоты ПЖ. Первая категория включает патогенные МО, такие как Escherichia coli, Klebsiella spp. и Pseudomonas spp., которые являются наиболее распространенными возбудителями бактериального простатита. Вторая категория включает другие патогенные МО, такие как Enterococcus faecalis и Staphylococcus aureus, которые нередко также ответственны за развитие простатита. Третья категория охватывает МО, которые могут быть ассоциированы с простатитом, но их роль менее ясна. Сюда входят коагулазонегативные стафилококки, Chlamydia trachomatis, Mycoplasma spp., анаэробные бактерии, дрожжи рода Candida и Trichomonas vaginalis. Четвертая категория объединяет непатогенные МО, такие как Lactobacillus spp. и Corynebacterium spp., которые могут играть роль в поддержании нормальной микробиоты ПЖ. Пятая категория состоит из латентных патогенов, включая бактериальные биопленки, вирусы и L-формы бактерий, которые требуют дальнейшего изучения для понимания их вклада в этиопатогенез простатита [9–14].
Идентификация МО III–V категорий в лабораторной практике часто ограничена из-за отсутствия надежных и простых лабораторных методов их выявления. Традиционные бактериологические методы имеют ряд недостатков: задержка доставки взятого у пациентов биоматериала в лабораторию, длительное время ожидания результатов исследования и ограниченный спектр МО, поддающихся культивированию. Так, к примеру, анаэробные МО требуют специальных лабораторных методов исследования для их идентификации, а с помощью традиционных бактериологических методов она невозможна. Это подчеркивает необходимость разработки более чувствительных и специфичных диагностических подходов для исследования микробиоты ПЖ. Метод полимеразной цепной реакции (ПЦР) в режиме реального времени представляет собой мощный инструмент для количественной оценки микробного сообщества в различных органах и системах организма и позволяет не только идентифицировать, но и количественно определить присутствие различных МО в исследуемых образцах. Его высокая чувствительность и быстрота получения результата исследования делают этот метод незаменимым во многих областях медицинской науки и практики. Тем не менее важно учитывать ограничения его применения и необходимость дальнейших исследований для улучшения методов идентификации и количественного анализа МО, ответственных за возникновение инфекционно-воспалительных заболеваний, в том числе и простатита [15–17].
Использование молекулярно-генетических методов у части пациентов с ХАП с отрицательным бактериологическим анализом секрета ПЖ (СПЖ) позволило выявить герпесвирусы, которые, по мнению А.А. Бреусова и соавт. [18], могут способствовать и поддерживать воспалительный процесс в ПЖ. Авторы рекомендуют исследование СПЖ на наличие внутриклеточных инфекционных агентов, включая вирусы.
В работе Е.Е. Брагина и соавт. [19] у инфертильных мужчин с помощью электронной микроскопии эякулята были обнаружены сперматозоиды, содержащие нуклеокапсиды вируса простого герпеса (ВПГ) различной степени зрелости. Среди супружеских пар с ВПГ была отмечена высокая частота невынашивания беременности по сравнению с парами, у которых этот вирус выявлен не был.
Вопрос о влиянии ВПГ на мужское бесплодие до настоящего времени остается дискутабельным. Имеются исследования, указывающие на возможное нарушение функций ПЖ и придатка яичка у мужчин с данной инфекцией, о чем свидетельствуют выявляемое у них снижение плотности и подвижности сперматозоидов и уменьшение их количества [20]. Однако другие аналогичные исследования не подтверждают этих выводов [21].
Таким образом, одной из актуальных проблем урологии остается неясная этиологическая роль вирусов в развитии ХП, что обусловлено трудностями диагностики вирусного простатита и достоверного выявления вирусов при использовании стандартных лабораторных методов для анализа СПЖ. Метод ПЦР позволяет выявлять ВПГ и вирус папилломы человека (ВПЧ), но в рутинной практической работе чаще используется для исключения инфекций, передающихся половым путем (ИППП) [5, 22, 23].
Таким образом, идентификация вирусов у пациентов с ХП представляет собой серьезную диагностическую проблему, связанную со сложностью определения вирусной этиологии данного заболевания, поскольку на сегодняшний день не существует надежных методов обнаружения вирусов в ПЖ, пригодных для повседневной практической работы [22,23].
В связи с вышеизложенным мы применили более доступный и практичный метод газовой хромато-масс-спектрометрии для идентификации микробных маркеров [15–17]. Данный некультуральный метод не имеет многих ограничений, присущих традиционным диагностическим подходам, так как он не требует сохранения жизнеспособности МО. Это существенно упрощает процесс отбора, транспортировки и хранения проб, а также позволяет достоверно выявлять присутствие МО, независимо от их способности к росту на искусственных питательных средах. Метод обладает широким диагностическим диапазоном: один анализ предоставляет информацию о количественном присутствии 57 МО, включая анаэробы, актинобактерии, вирусы и грибы. Полный цикл анализа от момента поступления пробы в лабораторию до получения отчета составляет всего 2 ч. Экспресс-скрининг биоматериалов с использованием масс-спектрометрии микробных маркеров (МСММ), наряду с другими методами, способствует углубленному пониманию роли структуры микробиоты СПЖ в этиопатогенезе заболеваний урогенитальной системы [15–17].
Цель исследования: изучить микробиоту СПЖ у пациентов с ХАП, ассоциированным с герпесвирусами, с помощью МСММ.
Содержание статьи
Материал и методы
Исследование проведено при участии 61 пациента с ХАП (исследуемая группа), ассоциированным с герпесвирусами, и 70 здоровых мужчин (контрольная группа), обратившихся с целью скринингового обследования, не предъявлявших жалобы, в возрасте от 25 до 50 лет. Здоровые участники была приняты в исследование для определения нормативных показателей МО. Отдельно были выделены подгруппы в соответствии с наличием МО или вирусов. Показатели МО с помощью МСММ сравнивали между больными ХАП и здоровыми участниками, также отдельно сравнивали данные пациентов с ХАП категории IIIА (количество лейкоцитов в СПЖ ≥10) и категории IIIБ (количество лейкоцитов в СПЖ <10).
Участники были отобраны согласно критериям включения (возраст 25–50 лет; отсутствие ИППП и бактериального простатита, а также и условно-патогенных МО по данным традиционного бактериологического анализа СПЖ и ПЦР, включая Ureaplasma urealyticum, C. trachomatis, наличие герпесвирусов в анализах МСММ и клинических симптомов ХП; добровольное информированное согласие) и критериям невключения (острые воспалительные заболевания любых органов, психические заболевания, прием антибиотиков и противовирусных препаратов за последние 3 мес.).
У всех участников проводили исследование СПЖ методом МСММ с использованием газового хроматографа «Маэстро» (ООО «Интерлаб», Россия) (для анализа собирали 2 или 3 порции СПЖ).
Симптомы ХАП оценивали с помощью анкеты NIH-CPSI (National Institute of Health Chronic Prostatitis Symptom Index, 1999 г.).
Статистическую обработку данных проводили с использованием программного обеспечения Excel 2019 (Microsoft, США) и JMP Pro 17 (SAS, США). Для проверки распределения количественных показателей на нормальность применяли критерий Колмогорова — Смирнова с коррекцией Лиллиефорса. Во всех случаях гипотеза о нормальности была отклонена. Количественные признаки представлены в виде медианы и 1-го и 3-го квартиля (Me (Q1; Q3)). Сопоставление двух независимых групп по количественным показателям осуществляли с помощью непараметрического критерия U Манна — Уитни. Для сравнения трех независимых групп применяли непараметрический аналог дисперсионного анализа — Н-критерий Краскела — Уоллиса. Уровень значимости при проверке статистических гипотез был зафиксирован на уровне p<0,05. Для коррекции уровня ошибки рода при проведении множественных попарных межгрупповых сравнений учитывали поправку Бонферрони.
Результаты исследования
У всех обследованных больных ХАП в момент осмотра или в анамнезе отмечались симптомы, характерные для ХП, а у 29 (51,8%) пациентов при первичном осмотре и в анамнезе имелись герпетические высыпания на наружных половых органах.
Согласно результатам МСММ СПЖ группы статистически значимо различались по содержанию ВПГ 1-го и 2-го типа, цитомегаловируса (ЦМВ) и вируса Эпштейна — Барр (ВЭБ) (табл. 1).
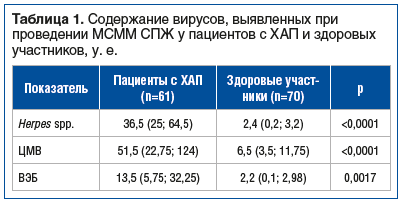
У пациентов с ХАП, ассоциированным с герпесвирусами, зафиксированы более высокие уровни многих МО (включая кокки, бациллы, анаэробы, актинобактерии, грибы) и повышенные значения резидентных, транзиторных и не встречающихся в норме МО, а также увеличение общей суммы МО по сравнению с здоровыми участниками, что свидетельствует о наличии связи между уровнем герпесвирусов и повышением уровня МО, которые могут быть причиной воспалительных изменений у пациентов с ХАП (табл. 2).
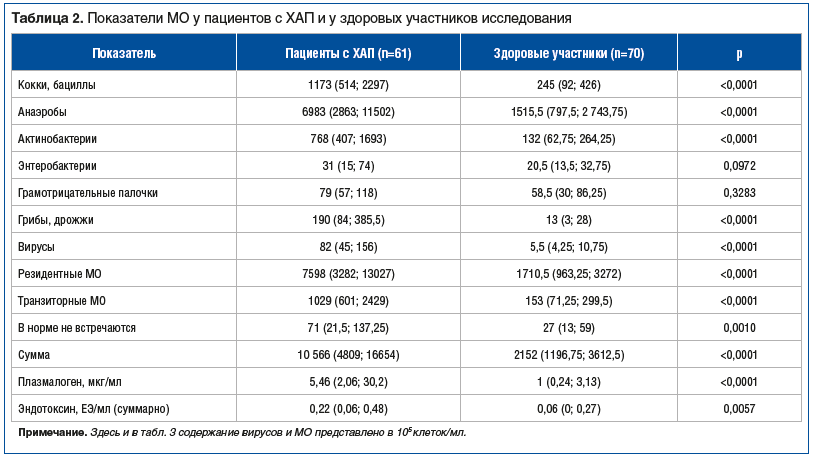
В подгруппе кокков, бацилл у пациентов с ХАП зафиксировано повышение значений выше нормы у Streptococcus mutans (анаэробные) и S. aureus (р<0,0001 и р=0,0004), которые относятся к условно-патогенным МО, повышение их уровня может способствовать поддержанию воспалительного процесса при ХАП.
В подгруппе анаэробов у пациентов с ХАП по сравнению со здоровыми были повышены показатели Clostridium difficile, Clostridium ramosum, Eggerthella lenta, Lactobacillus spp., Peptostreptococcus anaerobius (р<0,0001), для остальных анаэробных МО не было выявлено статистически значимых различий между группами пациентов (p>0,05).
В группе актинобактерий были повышены показатели Actinomyces viscosus и Rhodococcus spp. (р<0,0001), остальные виды актинобактерий статистически значимо не различались (р>0,05).
У здоровых участников представители Enterobacteriaceae spp. и Helicobacter pylori, а также грамотрицательные МО Alcaligenes spp., Flavobacterium spp., Porphyromonas spp., Pseudomonas aeruginosa и Stenotrophomonas maltophilia не выявлены (р>0,05).
Среди грибов и дрожжей у больных ХАП по сравнению с здоровыми участниками наблюдались только повышенные уровни Aspergillus spp. (р=0,0316) и Candida spp. (р=0,0002).
Общая сумма МО у пациентов с ХАП была достоверно выше по сравнению со здоровыми участниками: 10 566 (4809; 16 654) и 2152 (1196,75; 3612,5) 105 клеток/мл соответственно (р<0,0001); уровни плазмалогена и эндотоксина также были выше.
При сравнении показателей МСММ СПЖ у пациентов с ХАП категории IIIА (количество лейкоцитов в СПЖ ≥10 в поле зрения) и IIIБ (количество лейкоцитов в СПЖ <10) установлено, что чем больше лейкоцитов в СПЖ, тем выше уровень некоторых МО, особенно анаэробов, их транзиторных форм и общей суммы МО. Это еще раз подтверждает роль этих МО в развитии и поддержании воспалительного процесса у больных ХАП (табл. 3).
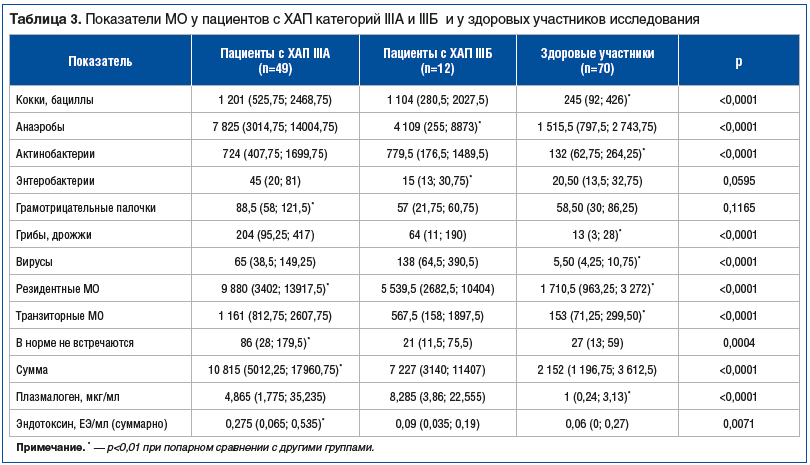
Было выявлено, что для пациентов с ХАП, ассоциированным с герпесвирусами, по сравнению со здоровыми участниками для многих МО были характерны более высокая микробная нагрузка, а также наличие взаимосвязи между абсолютным количеством МО в СПЖ с количеством лейкоцитов в нем; уровни плазмалогена и эндотоксина также были выше.
Обсуждение
В последние десятилетия в связи с появлением новых и усовершенствованием существующих лабораторных методов интерес к исследованию возможной роли герпесвирусов в поражении репродуктивных органов возрастает. В частности, по данным В.П. Ковалыка и соавт. [2, 24, 25], частота выявления герпесвирусов (ЦМВ, ВЭБ, вирус герпеса человека (ВГЧ) 6-го типа) и ВПЧ у мужчин с урогенитальными инфекционно-воспалительными заболеваниями составила 3,9, 6,4, 10,3 и 14,6% соответственно при их отсутствии у здоровых участников. Эти вирусы в 87,5% случаев были обнаружены в эякуляте, при этом отмечалось 1,5–2-кратное уменьшение доли морфологически нормальных форм сперматозоидов. Пациентам с клинической картиной ХАП, ассоциированного с ВГЧ 4–6-го типа и ВПЧ, часто требовалась курсовая терапия (36,9%), в анамнезе такие пациенты чаще имели ИППП (45,6%), депрессию (70,9%) и тревогу (28,1%). Противовирусная терапия приводила к достоверному снижению (минимум в 5 раз) уровня вирусов или уровня их эрадикации (в среднем на 69,5%), что приводило к значимому уменьшению выраженности симптомов заболевания. На основании своих исследований авторы высказали предположение о патогенетической связи между герпесвирусами, мужским бесплодием и ХП/СХТБ [2, 24–29].
В нашем исследовании при использовании МСММ был определен уровень герпесвирусов в СПЖ, которые при ПЦР в режиме реального времени не были выявлены, и проведен сравнительный анализ микробиоты СПЖ у больных ХАП категории III с характерными жалобами и повышенным уровнем герпесвирусов и здоровых мужчин, обратившихся к урологу для скринингового обследования.
Установлено, что у пациентов с ХАП, ассоциированным с герпесвирусами, были повышены уровни МО в подгруппе кокков, бацилл по количеству S. mutans (анаэробные) и S. aureus (р<0,0001 и р=0,0004), в подгруппе анаэробов значительные различия в количестве зафиксированы для нескольких видов (Clostridium difficile, Clostridium ramosum, E. lenta, Lactobacillus spp., Peptostreptococcus anaerobius), в подгруппе актинобактерий — для Actinomyces viscosus и Rhodococcus spp., в подгруппе грибов и дрожжей — для Aspergillus spp. (р=0,0316) и Candida spp. Кроме того, зафиксировано достоверное повышение уровня как транзиторных, так и резидентных МО и общей суммы МО в группе пациентов с ХАП. Таким образом, повышение уровня вирусов и отдельных условно-патогенных МО может вызывать воспалительные процессы в ПЖ. В частности, ранее были опубликованы сообщения о развитии абсцесса ПЖ, вызванного S. mutans и S. aureus [30, 31].
С другой стороны, в исследовании В.П. Ковалык и соавт. [29], где с помощью метода ПЦР в реальном времени в эякулятах и СПЖ определяли ДНК ВПГ-1, -2, ВЭБ, ЦМВ и ВГЧ-6, только у 20 из 65 пациентов выявлена ДНК ВПГ. Недостатком указанного исследования явилось то, что наиболее распространенные герпесвирусы, ассоциированные с генитальным герпесом и ХП, а именно ВПГ-1, -2, в СПЖ не были обнаружены ни до, ни после лечения. Авторы объясняют это либо низкой концентрацией ВПГ-1, -2, либо недостаточно высокой чувствительностью наборов для детекции вирусной ДНК, либо состоянием латенции ВПГ-1, -2, при котором вирус находится в нервных клетках в эписомном состоянии и не реплицируется [26–28]. В этой связи можно предполагать, что информативность метода МСММ при выявлении герпесвирусов, особенно ВПГ-1, -2, высокая.
На сегодняшний день роль ЦМВ и ВЭБ в развитии ХП не установлена. Согласно систематическому обзору Y. Guo et al. [32] одни авторы считают, что ЦМВ может привести к уменьшению количества и подвижности сперматозоидов, передаваться половым партнерам и инфицировать эндометрий, приводя к раннему выкидышу, другие — что ЦМВ не связан с бесплодием. В связи с этим в нашей работе наибольший интерес вызывал ВПГ, который способен поражать репродуктивные органы, включая ПЖ1 [26–28].
Доказательством вышесказанного являются данные систематического обзора А. Yas et al. [33], согласно которым вирусы герпеса (ВПГ-1, -2, вирус Varicella zoster, ЦМВ, ВЭБ и ВГЧ-6) нередко инфицируют урогенитальные пути, ухудшая качество спермы, а также являются маркерами дисфункции органов малого таза. Согласно метаанализу, проведенному R. Guiton et al. [34], в крупномасштабном когортном исследовании было показано, что дизурия, боль, зуд и выделения из уретры были основными местными симптомами, наблюдаемыми после первичной инфекции ВПГ-2. ДНК ВПГ-2 также была выявлена в СПЖ мужчин, страдающих ХП. В дополнение к вышесказанному В.П. Ковалык и соавт. [25, 29], данные ВОЗ1 указывают на то, что ВПГ-1, -2 в качестве потенциальных патогенов могут поражать многие органы, особенно органы половой системы, в частности ВПГ-2 поражает эти органы в 80% случаев, а ВПГ-1 — в 20%. Указанные вирусы, поражая репродуктивные органы (яички с придатками, семявыносящие протоки, семенные пузырьки, ПЖ), вызывают воспалительные изменения, а также нарушения в работе сенсорных ганглиев вегетативной нервной системы, ответственной за эрекцию и эякуляторную функцию, которые нередко становятся причинами бесплодия у мужчин [26, 27, 34, 35].
При сравнении результатов МСММ СПЖ нами зафиксировано, что в группе пациентов с ХАП категории IIIА, по сравнению с ХАП категории IIIБ, уровень некоторых МО, особенно анаэробов, грамотрицательных палочек, транзиторных МО и общей суммы МО, оказался выше. Таким образом, чем больше выражен воспалительный процесс в ПЖ, тем выше уровень условно-патогенных МО. Очевидно, при высокой вирусной нагрузке, на наш взгляд, повышение уровня условно-патогенных МО, скорее всего, связано, с одной стороны, со снижением иммунитета и активизацией условно-патогенных МО, с другой — с воздействием самого вируса как поддерживающего фактора воспалительного процесса в ПЖ.
Заключение
Исследование СПЖ методом МСММ у пациентов с ХАП, ассоциированным с герпесвирусами, с клиническими проявлениями заболевания, с одной стороны, позволило идентифицировать и провести количественную оценку микробиоты ПЖ, включая вирусы, с другой — продемонстрировать повышение уровня условно-патогенных МО у пациентов с ХАП, особенно категории IIIА, связанное со снижением иммунитета на фоне вирусной нагрузки, а также с воздействием самого вируса как фактора, поддерживающего воспалительный процесс в ПЖ.
Полученные нами данные диктуют необходимость исследования СПЖ у пациентов с симптоматическим ХАП на предмет выявления герпесвирусов, которые, возможно, нарушая работу иммунной системы и активизируя рост условно-патогенных МО, поддерживают воспалительный процесс. Изменение представлений о микробиоте в норме и при патологических состояниях требует от врачей принципиально новых подходов к лечению больных инфекционно-воспалительными заболеваниями, включая ХАП.
1Herpes simplex virus. WHO. 5 April 2023. (Электронный ресурс.) URL: https://www.who.int/news-room/fact-sheets/detail/herpes-simplex-virus (accessed: 15.11.2022).
Информация с rmj.ru






