Содержание статьи
Лечение мигренозного приступа: по рецепту или без
О. В. Косивцова, кандидат медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Мигрень является широко распространенным неврологическим заболеванием со
сложным патофизиологическим механизмом, которое проявляется как повторяющиеся
приступы пульсирующей односторонней головной боли, которая может быть тяжелой и
сопровождаться сопутствующими симптомами, такими как тошнота, фото- и фонофобия.
У трети пациентов развитию головной боли предшествуют преходящие неврологические
симптомы, которые чаще всего являются зрительными, но могут затрагивать и другие
органы чувств, а также речь (мигрень с аурой [1]). Мигрень встречается
исключительно часто и является очень «дорогим» заболеванием. Так, в европейской
популяции она встречается у 17% женщин и 8% мужчин [2], при этом затраты на
мигрень в Европе достигают 18 млрд долларов в год [3]. При этом, согласно данным
Всемирной организации здравоохранения (World Health Organization, WHO), мигрень
входит в двадцатку заболеваний, наиболее часто приводящих к утрате
трудоспособности [4].
В течение десятилетий большая часть пациентов с головной болью применяла
безрецептурные анальгетики, среди которых ацетаминофен (парацетамол),
ацетилсалициловая кислота, иные нестероидные противовоспалительные средства (НПВС),
а также фиксированные комбинации, такие как ацетилсалициловая кислота (АСК) +
ацетаминофен (ААФ) + кофеин (К) [5]. Известно, что более 90% пациентов, которые
пользовались безрецептурными комбинированными препаратами, применяли их именно
для лечения головной боли [6]. Все те годы, в течение которых рецептурные и
безрецептурные препараты использовались для лечения мигрени, не проводилось
исследований, которые бы напрямую сравнивали эти две категории препаратов.
Возможно, это происходило из-за того, что рецептурные препараты априори
считаются более эффективными [7]. Однако в последнее время появляется все больше
данных, как подтверждающих эффективность безрецептурных препаратов в лечении
мигренозных приступов, так и обосновывающих их применение с точки зрения
патогенеза заболевания.
Роль воспаления в патогенезе мигренозной головной боли
Считается, что развитие мигренозной головной боли связано с активацией и
сенситизацией (снижение порога возбудимости) тригемино-цервикальной системы
[8–11]. В связи с тем, что ее участие позволяет обосновать назначение ряда
препаратов, использующихся в терапии приступа, представляется небезынтересным
сделать небольшое отступление и остановиться на ней немного подробнее.
Согласно современным представлениям, развитие мигренозной головной боли
связано с активацией и сенситизацией афферентных сенсорных волокон тройничного
нерва, иннервирующих ткани головы, в том числе оболочки мозга и их крупные
кровеносные сосуды [9–11]. На сегодняшний день нет четкого представления, что
именно является источником ноцицептивных импульсов. Это могут быть мягкая или
твердая оболочки головного мозга, а также периартериальные сенсорные волокна.
Нельзя исключить также, что каждый из этих компонентов вносит свой вклад в
формирование болевого синдрома [10].
На основании большого количества косвенных данных, полученных как в
доклинических, так и в клинических исследованиях, стерильное воспаление оболочек
головного мозга рассматривается как ключевой механизм, который может лежать в
основе длительной активации и сенситизации периваскулярных менингеальных
афферентных волокон во время приступа мигрени [10, 12, 13]. Такими косвенными
данными являются повышение концентрации медиаторов воспаления в венозной крови
краниальных вен во время мигренозного приступа, а также эффективность
нестероидных противовоспалительных препаратов в лечении мигренозных приступов у
большинства пациентов [12, 13]. В исследованиях на животных активация
менингеальных ноцицепторов in vivo ведет к высвобождению вазоактивных
провоспалительных пептидов, таких как кальцитониногенсвязывающий пептид (КГСП) и
субстанция P из периферических нервных окончаний. Эти пептиды вызывают
вазодилатацию менингеальных кровеносных сосудов (преимущественно, благодаря КГСП),
выход плазмы за пределы сосудов, а также локальную активацию тучных клеток
твердой мозговой оболочки (ТМО) с последующим высвобождением цитокинов и других
медиаторов воспаления. Фактически, речь идет о развитии нейрогенного воспаления
в ТМО [11–13]. Дегрануляция тучных клеток ТМО может привести к длительной
активации и сенситизации ноцицепторов ТМО (данные получены на крысах), а также
цефалической тактильной гиперчувствительности [14]. Химическое воспаление ТМО у
бодрствующих животных приводит к развитию кожной аллодинии в лицевой области и в
области задних лап [15], при этом хронология развития этих симптомов аналогична
таковой у пациентов с мигренью [16]. Кроме того, фармакология аллодинии,
вызванной при помощи «воспалительного коктейля» (кислая смесь калия,
простагландинов, серотонина, брадикинина и гистамина, которая стимулирует и
сенситизирует болевые рецепторы, вызывая гипералгезию) у животных, позволяет
провести параллели с клинической фармакологией мигренозной боли [15]. Введение
тринитрата глицерина, который может спровоцировать у пациентов (но не у здоровых
людей!) отсроченный приступ мигрени, практически неотличимый от спонтанного
приступа, вызывает развитие отсроченного воспаления в ТМО крысы [17].
Однако эндогенные процессы, которые вызывают развитие менингеального
воспаления и периферическую сенситизацию во время спонтанного приступа мигрени,
остаются неясными. Многие исследователи считают, что нейрогенное воспаление и
является тем самым эндогенным воспалительным процессом, который поддерживает
активацию и вызывает сенситизацию менингеальных ноцицепторов во время
мигренозного приступа. В пользу гипотезы о нейрогенном воспалении
свидетельствует и то, что вещества, вызывающие развитие головной боли, такие как
этанол и умбеллулон (летучее вещество, содержащееся в калифорнийском лавре),
активируют пептидергические менингеальные тригеминальные афферентные волокна
(при помощи различных рецепторов: TRPV1 и TRPA1), что приводит к высвобождению
КГСП и развитию нейрогенного воспалительного ответа в ТМО экспериментальных
животных [18, 19].
Интересный факт: известно, что у значительного числа пациентов с мигренью
усиление головной боли происходит под воздействием света (фотофобия).
Относительно недавно был изучен нейрональный механизм этого явления [20].
Нейроны заднего отдела таламуса, иннервирующие ТМО, получают моносинаптические
проекции из ганглионарных клеток сетчатки (преимущественно внутренние
фоточувствительные клетки, не участвующие в построении изображения), при этом
свет повышает активность нейронов, иннервирующих ТМО. Гипотеза, что проводящий
путь от сетчатки, не участвующий в построении изображения, участвует в развитии
фотофобии, подтверждается и тем фактом, что усиление головной боли под
воздействием света сохраняется и у ослепших пациентов с мигренью, которые
ощущают свет, несмотря на тяжелую дегенерацию фоторецепторов палочек и колбочек
[20].
Таким образом, современная теория развития мигренозного приступа позволяет
говорить о том, что эффективность НПВС у таких пациентов связана с их
воздействием на одно из ключевых звеньев патогенетического процесса, приводящего
к развитию головной боли, а именно — стерильного воспалительного процесса в
оболочках головного мозга.
«Безрецептурная» терапия приступа
В настоящее время опубликовано большое количество крупных рандомизированных
плацебо-контролируемых исследований, посвященных лечению мигренозного приступа.
В большинстве этих исследований в качестве критериев успешной терапии
мигренозного приступа использовались следующие [21]:
1) купирование боли спустя 2 часа;
2) уменьшение интенсивности головной боли с тяжелой или умеренной до легкой или
ее отсутствие спустя 2 часа;
3) эффективность терапии сохраняется в двух случаях из трех;
4) отсутствие рецидива головной боли и отсутствие необходимости приема препарата
в течение 24 часов после успешного лечения.
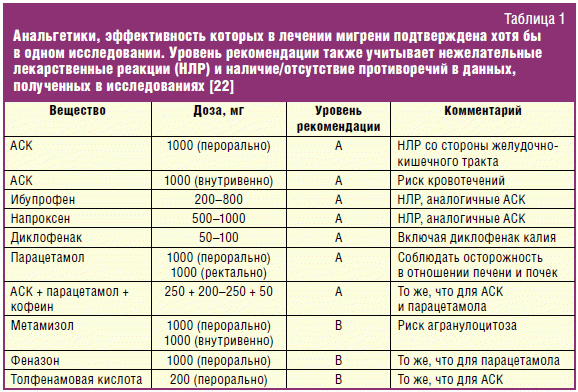
Анальгетики
Препаратами первого выбора для лечения легкой и умеренной мигрени являются
анальгетики. Эффективность в лечении мигрени была подтверждена хотя бы в одном
плацебо-контролируемом исследовании для следующих препаратов: ацетилсалициловая
кислота до 1000 мг, ибупрофен 200–800 мг, диклофенак 50–100 мг, феназон 100 мг,
метамизол 1000 мг, толфенамовая кислота 200 мг и парацетамол 1000 мг.
Селективные ингибиторы циклооксигеназы-2 (ЦОГ-2) также исследовались у пациентов
с мигренью и продемонстрировали свою эффективность. Анальгетики с доказанной
эффективностью представлены в табл. 1. Во избежание развития абузусной головной
боли, прием простых анальгетиков не должен продолжаться свыше 15 дней в месяц, а
прием комбинированных анальгетиков — свыше 10 дней в месяц [22].

Что же такое «уровень рекомендаций»? Как он оценивается? Что значит «А»? Само
понятие пришло к нам из доказательной медицины и является производным от уровня
доказательности, который, в свою очередь, есть ни что иное, как иерархия
вероятно наилучших доказательств, свидетельствующих об эффективности и
безопасности того или иного препарата (метода лечения, изделия медицинского
назначения и т. п.). Смысл его в том, чтобы максимально облегчить врачу
(исследователю, пациенту) поиск вероятно наилучшего доказательства эффективности
проводимой или планируемой терапии. В то же время нужно отдавать себе отчет, что
уровни доказательности никоим образом не заменяют систематические обзоры, не
позволяют судить о качестве имеющихся доказательств, не являются рекомендацией и
ничего не говорят о том, правильно ли вы формулируете вопрос. Например, если
вместо менингита пациенту поставлен диагноз «грипп», найдя наилучшее лекарство
от гриппа, вы вряд ли добьетесь клинического эффекта.
В табл. 2 представлены уровни доказательности для оценки эффективности
терапии, профилактики, этиологии, вреда здоровью.
Связь между уровнями доказательности и уровнями рекомендаций приведена в
табл. 3.

Комбинированные препараты
В 1993 г. Управление по контролю за качеством пищевых продуктов и
лекарственных средств США (Food and Drug Administration, FDA) рекомендовала
классифицировать кофеин (при добавлении его к комбинации АСК + ААФ) как
анальгетический адъювант 1-й категории, с «признанными эффективностью и
безопасностью» [23]. Наличие кофеина позволяет сдвинуть кривую доза/ответ влево,
усиливая анальгетический эффект на 40% [23, 24]. Синергичное действие АСК, ААФ и
кофеина, приводящее к подавлению синтеза простагландина E2, может частично
объяснить этот феномен. Кофеин сам по себе может оказывать анальгетическое
действие при определенных видах боли у человека [25], но в целом доказательства,
полученные в клинических исследованиях, недостаточны.
В 1998 году препарат, содержащий комбинацию 250 мг АСК, 250 мг ААФ и 65 мг
кофеина, стал первым безрецептурным препаратом, получившим одобрение FDA в
качестве средства для лечения мигрени, а позднее, в 1999 г., он был одобрен для
лечения не только мигрени, но и сопутствующих симптомов [7]. Похожая комбинация
получила одобрение и в Европе, она рекомендована Европейской федерацией
неврологических обществ (European Federation of Neurological Societies, EFNS)
как средство первой линии для лечения мигрени легкой и умеренной интенсивности
(табл. 1).
Данные, полученные в клинических исследованиях, свидетельствуют о
безопасности и эффективности фиксированных комбинаций анальгетиков со следующими
дозировками активных компонентов: АСК 250–265 мг, ААФ 200–265 мг и кофеина 50–65
мг в одной таблетке. Оптимальное соотношение активных компонентов 1,0:0,8:0,2 (АСК,
ААФ и кофеин соответственно) было найдено в ходе фармакологических и клинических
исследований по поиску оптимальной дозы [23], при этом минимальная
рекомендованная доза кофеина составляет 50 мг в таблетке. У пациентов с мигренью
с аурой или без фиксированная комбинация оказывается эффективнее плацебо не
только в уменьшении интенсивности головной боли, но также в уменьшении
выраженности тошноты, фото- и фонофобии [26].
Сравнительное исследование фиксированной комбинации (АСК 250 мг + ААФ 250 мг
+ кофеин 65 мг) и ибупрофена в лечении мигрени показало, что эффективность обоих
препаратов превышала таковую в группе плацебо, при этом тройная комбинация
оказалась достоверно эффективнее ибупрофена [7]. Превосходство фиксированной
комбинации над ибупрофеном было подтверждено как статистически, так и клинически
(снижение интенсивности боли, более раннее наступление значимого уменьшения
боли, а также частота пациентов с полным отсутствием боли и реакцией головной
боли на прием препарата), где в его пользу свидетельствовали наиболее значимые
для пациента показатели эффективности [27, 28]. Кроме того, в группе пациентов,
принимавших фиксированную комбинацию, препараты «скорой помощи» использовались
достоверно реже, а процент пациентов с полным купированием головной боли был
выше, чем в группе ибупрофена [7].
На фоне господствующего мнения о том, что наиболее эффективными всегда
являются рецептурные препараты, интересны данные, полученные в сравнительном
исследовании фиксированной комбинации (АСК 250 мг + ААФ 250 мг + кофеин 65 мг) с
суматриптаном в дозе 50 мг. Здесь эффективность комбинации оказалась выше в
отношении суммарной эффективности головной боли, купирования сопутствующих
симптомов, частоты использования препаратов «скорой помощи» и общей оценки
эффективности препарата [7].
Помимо преимуществ, связанных с эффективностью препарата, фиксированная
комбинация обладает и рядом других преимуществ по сравнению с суматриптаном, в
частности, у нее отсутствуют сердечно-сосудистые противопоказания, которые
ограничивают использование триптанов [29, 30].
Результаты исследования свидетельствуют о том, что пациенты с мигренью могут
использовать тройную комбинацию при первых признаках надвигающегося приступа,
тогда как рецептурные препараты можно отложить для случаев рефрактерности к
безрецептурной терапии, поскольку большинство пациентов пробуют принимать
безрецептурные препараты до визита к врачу. Предположение о том, что рецептурные
препараты, по определению, превосходят безрецептурные, можно оспорить.
Заключение
Таким образом, имеющиеся на сегодняшний день данные подтверждают, что
безрецептурные препараты, в частности НПВС и их комбинации, могут
рассматриваться как эффективные патогенетические средства лечения мигрени легкой
и умеренной интенсивности. Именно так они рекомендованы Европейской федерацией
неврологических обществ и Американским консорциумом по лечению головной боли (US
Headache Consorcium).
Отдельного упоминания заслуживает фиксированная комбинация АСК, ААФ и кофеина
в дозах 250, 250 и 65 мг соответственно. В России такая комбинация доступна под
названием Экседрин®. К достоинствам препарата следует отнести соответствие
состава европейским и американским рекомендациям, эффективность в отношении как
головной боли, так и сопутствующих симптомов мигрени (тошноты, фото- и фонофобии)
[26], а также благоприятный профиль переносимости препарата. Достоверное
уменьшение мигренозной головной боли наблюдается уже через 30 минут после приема
препарата. Данные клинических исследований подтверждают, что Экседрин® является
адекватным и рациональным выбором для лечения мигренозной головной боли легкой и
умеренной интенсивности, его эффективность превышает эффективность монотерапии
НПВС [31], а в ряде случаев не уступает триптанам [7].
Литература
-
Lipton R. B., Bigal M. E., Steiner T. J., Silberstein S. D., Olesen J.
Classification of primary headaches // Neurology. 2004. 63: 427–435. -
Stovner L. J., Hagen K. Prevalence, burden, and cost of headache
disorders // Curr. Opin. Neurol. 2006. 19: 281–285. -
Olesen J., Gustavsson A., Svensson M., Wittchen H. U., Jonsson B.
The economic cost of brain disorders in Europe // Eur. J. Neurol. 2012. 19:
155–162. -
Leonardi M., Steiner T. J., Scher A. T., Lipton R. B. The global
burden of migraine: measuring disability in headache disorders with WHO’s
Classification of Functioning, Disability and Health (ICF) // J. Headache Pain.
2005. 6: 429–440. -
Lipton R. B., Newman L. C., Solomon S. Over-the-counter
medication and treatment of migraine // Headache. 1994; 34: 547–548. -
Aicher B., Kraupp O. Effectiveness of fixed analgesic
combinations exemplified by Thomapyrin® // Wien Klin Wochenschr. 1996; 108:
219–233. -
Goldstein J. et al. Acetaminophen, Aspirin, and Caffeine versus
Sumatriptan Succinate in early treatment of migraine: results from the ASSET
trial // Headache. 2005; 45: 973–982. -
Moskowitz M. A. The neurobiology of vascular head pain. Ann.
Neurol. 1984. 16: 157–168. -
Pietrobon D., Striessnig J. Neurobiology of migraine. Nat. Rev.
Neurosci. 2003. 4: 386–398. -
Olesen J., Burstein R., Ashina M., Tfelt-Hansen P. Origin of pain
in migraine: evidence for peripheral sensitization // Lancet Neurol. 2009. 8:
679–690. -
Levy D. Migraine pain and nociceptor activation — where do we
stand? // Headache. 2010. 50: 909–916. -
Waeber C., Moskowitz M. A. Migraine as an inflammatory disorder
// Neurology. 2005. 64: S9–15. -
Levy D. Migraine pain, meningeal inflammation, and mast cells //
Curr. Pain Headache Rep. 2009. 13: 237–240. -
Levy D. Endogenous mechanisms underlying the activation and
sensitization of meningeal nociceptors: the role of immuno-vascular
interactions and cortical spreading depression. Curr. Pain Headache Rep. 2012.
16: 270–277. -
Edelmayer R. M., Vanderah T. W., Majuta L., Zhang E. T., Fioravanti B.
et al. Medullary pain facilitating neurons mediate allodynia in
headache-related pain // Ann. Neurol. 2009. 65: 184–193. -
Burstein R., Cutrer M. F., Yarnitsky D. The development of
cutaneous allodynia during a migraine attack: clinical evidence for the
sequential recruitment of spinal and supraspinal nociceptive neurons in
migraine // Brain. 2000. 123 (Pt. 8): 1703–1709. -
Reuter U., Bolay H., Jansen-Olesen I., Chiarugi A., Sanchez del Rio M.
et al. Delayed inflammation in rat meninges: implications for migraine
pathophysiology // Brain. 2001. 124: 2490–2502. -
Nicoletti P., Trevisani M., Manconi M., Gatti R., De Siena G. et
al. Ethanol causes neurogenic vasodilation by TRPV1 activation and CGRP
release in the trigeminovascular system of the guinea pig // Cephalalgia.
2008. 28: 9–17. -
Nassini R., Materazzi S., Vriens J., Prenen J., Benemei S. et al.
The ‘headache tree’ via umbellulone and TRPA1 activates the trigeminovascular
system // Brain. 2012. 135: 376–390. -
Noseda R., Kainz V., Jakubowski M., Gooley J. J., Saper C. B. et
al. A neural mechanism for exacerbation of headache by light // Nat. Neurosci.
2010. 13: 239–245. -
Tfelt-Hansen P., Block G., DahloЕf C. et al. Guidelines for
controlled trials of drugs in migraine: second edition // Cephalalgia. 2000;
20: 765–786. -
Evers S., Afra J., Frese A. et al. EFNS guideline on the drug
treatment of migraine — revised report of an EFNS task force // European
Journal of Neurology. 2009, 16: 968–981. -
Hersh E. V., Moore P. A., Ross G. L. Over-the-counter analgesics
and antipyretics: a critical assessment // Clin Ther. 2000; 22: 500–548. -
Laska E. M., Sunshine A., Mueller F., Elvers W. B., Siegel C., Rubin
A. Caffeine as an analgesic adjuvant // JAMA. 1984; 251: 1711–1718. -
Camann W. R., Murray R. S., Mushlin P. S., Lambert D. H. Effects
of oral caffeine on postdural puncture headache. A double-blind,
placebo-controlled trial // Anesth Analg. 1990; 70: 181–184. -
Lipton R. B., Stewart W. F., Ryan R. E., Saper J., Silberstein S.,
Sheftell F. Efficacy and safety of acetaminophen, aspirin, and caffeine
in alleviating migraine headache pain: three double-blind randomized, placebo
controlled trials // Arch Neurol. 1998; 55: 210–217. -
Silberstein S. D. Migraine symptoms: Results of a survey of
self-reported migraineurs // Headache. 1995; 35: 387–396. -
Dahlof C. How to assess patient preference of migraine treatments
// Cephalalgia. 1999; 19 (suppl 24): 2–5. -
Schoenen J. When should triptans be taken during a migraine
attack? // CNS Drugs. 2001; 15 (8): 583–587. - Headache Classification Committee of the International Headache Society.
Classification and diagnostic criteria for headache disorders, cranial
neuralgias, and facial pain // Cephalalgia. 1988; 8 (suppl 7): 1–96. -
Goldstein J., Silberstein S. D., Saper J. R. Acetaminophen,
Aspirin, and Caffeine in combination versus Ibuprofen for acute migraine:
results from a multicenter, double-blind, randomized, parallel-group,
single-dose, placebo-controlled study // Headache. 2006; 46: 444–453.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru