Введение
Остеомаляция (ОМ), или «болезнь мягких костей», — патология скелета, основу которой составляет несоответствие между образованием костного матрикса и его минерализацией [1–3]. Врожденные нарушения минерализации костей чаще всего проявляются в детском или подростковом возрасте клиникой рахита. Приобретенные формы имеют позднее начало и характеризуются у взрослых симптомами ОМ, к которым относятся диффузная боль в костях, мышечная слабость и патологические переломы [1–3]. ОМ у взрослых является широко распространенным заболеванием, обусловленным рядом причин, среди которых традиционными считаются дефицит витамина D и гипофосфатемия различной этиологии [2–4]. Синдром Фанкони, или генерализованная дисфункция проксимальных канальцев, является наиболее частой причиной, приводящей к гипофосфатемии у взрослых, и в большинстве случаев развивается при миеломной болезни, амилоидозе, приеме различных лекарственных средств, интоксикации тяжелыми металлами, мышьяком, или причины его развития остаются невыясненными [5, 6]. У детей, в отличие от взрослых, причиной синдрома Фанкони чаще являются редкие наследственные заболевания, такие как болезнь Вильсона — Коновалова, цистиноз, галактоземия, наследственная тирозинемия1 [6]. ОМ не имеет специфических клинических маркеров, поэтому начальные стадии заболевания долго не диагностируются, могут протекать под маской других скелетно-мышечных или ревматических заболеваний, что определило цель работы: повысить осведомленность практикующих врачей о том, что гипофосфатемическая ОМ у взрослых может быть не только приобретенной, но и генетической патологией, связанной с поражением почек у пациентов с наследственными заболеваниями, и требует тщательного диагностического подхода. В качестве иллюстрации приводим собственное клиническое наблюдение. На публикацию данных и фотографий от пациентки получено разрешение.
Содержание статьи
Клиническое наблюдение
Пациентка 2000 года рождения (23 года) поступила в отделение ревматологии ГБУЗ ТО «ОКБ № 1» г. Тюмени 27.02.2024 с жалобами на выраженную боль в области верхней трети бедер, костях таза, во всех отделах позвоночника постоянного характера (независимо от времени суток; как при движениях, так и в покое). Боль в правом коленном суставе и пальцах стоп, больше выраженная при ходьбе, прихрамывание. Периодически возникающая боль в локтевых, плечевых суставах неспецифического характера, потеря веса на 6 кг за последний до госпитализации год, снижение роста на 2 см примерно за 3–4 последних года.
Анамнез заболевания: считает себя больной с 2019 г. (с 19 лет). Заболевание началось с боли и незначительного отека области правого коленного сустава, боли в проекции тазобедренных суставов, костей таза. Обращалась к ревматологу в поликлинику, на основании проведенного обследования выставлен диагноз «ревматоидный артрит, неуточненный», назначены нестероидные противовоспалительные препараты, сульфасалазин 2 г/сут, которые пациентка принимала в течение 1 года. В дальнейшем в качестве базисной терапии назначен метотрексат 10 мг/нед., неоднократно внутрисуставно вводился бетаметазон. Несмотря на терапию комбинацией противоревматических препаратов, боли постепенно нарастали. В июле 2023 г. диагноз был изменен на «аксиальный спондилоартрит» на основании результатов дополнительных методов исследования: рентгенографии таза и МРТ крестцово-подвздошных суставов (КПС), описанных врачами-рентгенологами. Назначенная противовоспалительная терапия оказалась неэффективной, и пациентка госпитализируется для уточнения диагноза.
Объективный статус: обращает на себя внимание походка вперевалку, хромота при ходьбе. Локальная болезненность при пальпации верхних третей бедер, особенно справа. Боль по ВАШ 70 мм. Масса тела 45 кг. Рост 152 см. Кожный покров и слизистые чистые. Лимфоузлы не увеличены. Щитовидная железа обычных размеров. Число дыхательных движений 17 в 1 мин. Сатурация 98%. Аускультативно дыхание везикулярное. Пальпация грудной клетки безболезненная. Хрипов нет. Пульс ритмичный, частота сердечных сокращений 76 в 1 мин. АД 110/70 мм рт. ст., тоны сердца ясные, ритмичные, шумов нет. Пульсация на периферических артериях сохранена, хорошего наполнения. Живот не вздут, мягкий, безболезненный. Селезенка не пальпируется. Печень по краю реберной дуги, безболезненная. Стул оформленный. Мочеиспускание свободное. Диурез достаточный. Периферические отеки: нет. Внешних деформаций костей скелета не наблюдается. Периферические суставы интактны, движения в полном объеме.
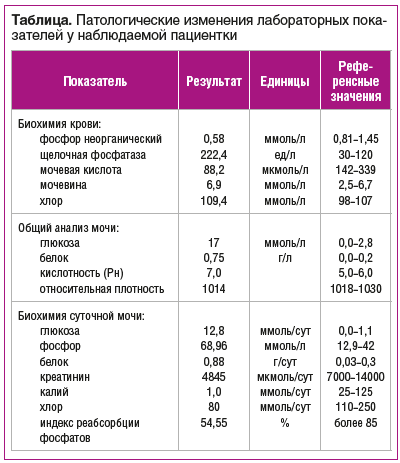
Было проведено комплексное лабораторное обследование с исследованием клинических, биохимических, иммунологических параметров, в том числе гормонального статуса. Были выявлены следующие патологические изменения (см. таблицу).
Инструментальное обследование. УЗИ органов грудной полости и малого таза, щитовидной железы, паращитовидных желез, ФГДС, ЭхоКГ, рентгенография легких — без патологии.
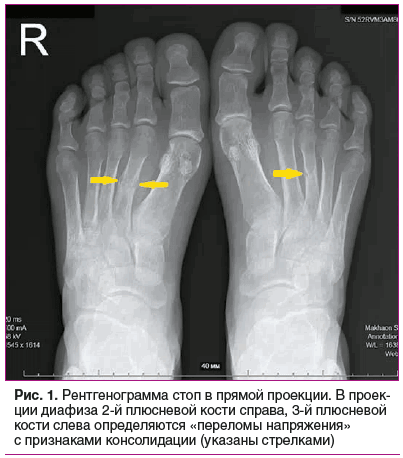
Рентгенография кистей — без патологии. Рентгенография стоп: определяются «переломы напряжения» 2-й плюсневой кости справа и 3-й слева (рис. 1).
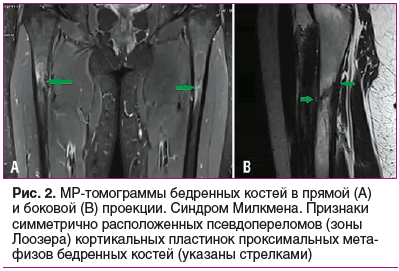
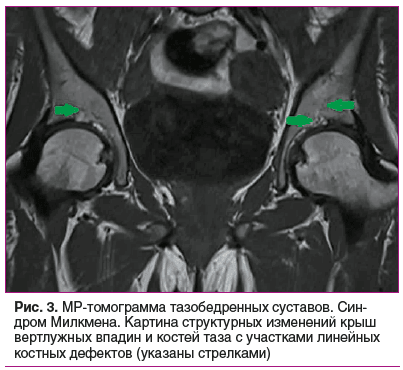
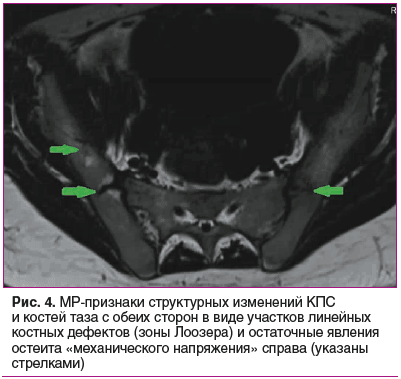
По данным МРТ бедренных костей, тазобедренных суставов: признаки симметрично расположенных псевдопереломов кортикальных пластинок проксимальных метафизов бедренных костей, крыш вертлужных впадин и костей таза с участками линейных костных дефектов по типу зон перестройки Лоозера (рис. 2, 3). МРТ КПС: признаки структурных изменений КПС и костей таза с обеих сторон в виде участков линейных костных дефектов (зоны Лоозера) и остаточные явления остеита «механического напряжения» (рис. 4).
МРТ грудного и поясничного отделов позвоночника: компрессионная деформация тел Th1, Th4, Th10 — 1-й степени; Th5, Th6, Th7, Th8, Th9 — 2-й степени; L5 — 1-й степени. КТ КПС — без структурных изменений. Двухэнергетическая рентгеновская абсорбциометрия (dual-energy X-rays absorptiometry, DXA): Z-критерий на уровне поясничного отдела позвоночника -3,2SD, Z-критерий на уровне шейки бедренной кости -2,8SD. Сцинтиграфия с тектротидом — объемных образований не выявлено.
На основе проведенного обследования выставлен предварительный клинический диагноз: остеомаляция, ассоциированная с гипофосфатемией, тяжелой степени. Тубулопатия неуточненная (синдром Фанкони?). Для уточнения диагноза пациентка направлена в ФГБУ «НМИЦ эндокринологии» Минздрава России (г. Москва), где проведено полноэкзомное секвенирование. По результатам выявлена компаунд-гетерозиготная мутация в гене FAH (NM_000137.4 c.374C>T/c.192G>T), на основании чего сформулирован окончательный клинический диагноз. Основной диагноз: тирозинемия I типа (компаунд-гетерозиготная мутация в гене FAH (NM 000137.4 c.374C>T/c.192G>T). Осложнение основного диагноза: гипофосфатемическая остеомаляция, ассоциированная с синдромом Фанкони.
Обсуждение
В рутинной врачебной практике из системных заболеваний скелета чаще всего встречаются два основных: остеопороз (ОП) и ОМ, которые многие специалисты путают. Оба состояния характеризуются изменением качества кости, приводят к снижению ее прочности и патологическим переломам. Но существует принципиальная разница в костном метаболизме при данных остеопатиях, которая заключается в отношении минерального компонента к костному матриксу. ОМ — это патология, характеризующаяся накоплением в поверхностных слоях кости остеоида (органический костный матрикс), который по разным причинам не подвергается минерализации. При этом общий объем кости (минерализованной и неминерализованной) остается нормальным, но только за счет органического компонента, минеральный же компонент резко снижен, в результате чего кости становятся излишне «гибкими», «пластичными» [1–3]. ОП же характеризуется уменьшением объема как органического, так и неорганического компонента костной ткани при нормальном их соотношении. В результате уменьшается общий объем костной массы, изменяется микроархитектоника костей (уменьшение количества и толщины костных балок), кости становятся «хрупкими» [7]. ОМ и ОП могут сочетаться у одного и того же пациента [7].
С учетом клинических признаков принято различать две формы ОМ — бессимптомную и манифестную. При бессимптомной форме признаки патологии отсутствуют, но регистрируется снижение минеральной плотности кости (МПК) по результатам денситометрии [7]. При манифестной форме большинство взрослых пациентов жалуются на генерализованную или локализованную боль, которая обычно возникает в осевом скелете, грудной клетке, плечевом/тазовом поясе и в костях нижних конечностей. При осмотре выявляется болезненная пальпация в зонах проекций пораженных костей. Боли при ОМ носят неспецифический характер, могут встречаться при абсолютном большинстве скелетно-мышечных заболеваний и являться причиной поздней диагностики.
У представленной пациентки наблюдалась манифестная форма болезни с дебютом в 19 лет, но ведущим синдромом являлся синовит коленного сустава, который расценивался как признак хронического артрита. Боли в области таза присоединились несколько позднее и, с учетом данных инструментального обследования, были интерпретированы как проявления анкилозирующего спондилита (АСп). «Утиная» походка, обусловленная мышечной слабостью, прихрамывание, связанное с произошедшими переломами бедренных костей, и «стресс-переломы» плюсневых костей вовремя не диагностированы и не были учтены при постановке диагноза АСп. Стоит отметить, что первичное описание результатов МРТ КПС было сделано без учета принятых протоколов описания [8, 9], что повлекло за собой ошибочный клинический диагноз. При пересмотре МРТ-картины специалистами в стационаре изменения КПС расценены как вторичные, связанные с повышенным механическим напряжением [10]. При проведении КТ структурные изменения КПС не подтвердились. Патогномоничными рентгенологическими признаками ОМ являются псевдопереломы — рентгенопрозрачные поперечные полосы, перпендикулярные кортикальному слою. По сути, это стрессовые переломы, возникающие в результате отложения неминерализованного матрикса в местах нагрузки или сосудов, называемые зонами Лоозера. Псевдопереломы чаще всего возникают билатерально, симметрично и локализуются в несущих основную нагрузку костях: бедренных, плюсневых, костях таза, реже — в лопатках, ключицах, ребрах, костях верхних конечностей. Переломы провоцируются минимальной травмой или появляются без нее, являясь исходом поздней стадии заболевания [1–3, 10]. У представленной пациентки при обследовании на рентгенограмме стоп выявлены «переломы напряжения» плюсневых костей. На МРТ таза и бедренных костей регистрировались многочисленные двусторонние и симметричные зоны Лоозера, что объединяет данные признаки в синдром Милкмена. Помимо этого, при МРТ позвоночника выявлена компрессионная деформация тел грудных и поясничных позвонков, что является характерным признаком ОМ. DXA пациентки продемонстрировала снижение МПК до уровня ОП. При этом стоит отметить, что DXA демонстрирует лишь степень минерализации кости, не позволяя полноценно оценить костный объем и структуру костной ткани, а также провести дифференциальную диагностику и установить причину снижения костной массы, поскольку снижение показателей МПК может наблюдаться как при ОП, так и при ОМ [7]. Таким образом, в случае впервые выявленного ОП по результатам DXA, особенно у молодых людей, необходимо проведение тщательной дифференциальной диагностики и исключение других метаболических заболеваний скелета. Анализ полученных данных в условиях стационара позволил выставить предварительный диагноз «остеомаляция неуточненного генеза», проведен тщательный поиск причин данного патологического процесса.
Этиология ОМ чаще всего обусловлена дефицитом, аномальным метаболизмом или резистентностью к витамину D, недостатком кальция, гипофосфатемией, а также избытком ингибиторов минерализации [1–4]. У наблюдаемой пациентки при обследовании обнаружены гипофосфатемия среднетяжелой степени, повышение уровня щелочной фосфатазы, гиперфосфатурия в сочетании с глюкозурией, гипоурикемией, ацидозом и тубулярной протеинурией. Клинически значимая гипофосфатемия развивается вследствие влияния множества факторов.
Факторы, приводящие к гипофосфатемии у взрослых:
А. Наиболее частые:
Избыточная экскреция фосфатов с мочой:
-
первичные/вторичные тубулопатии (синдром Фанкони);
-
отравление тяжелыми металлами;
-
первичный гиперпаратиреоз;
-
«синдром голодных костей» после хирургического лечения первичного гиперпаратиреоза;
-
дефицит витамина D;
-
длительный прием мочегонных лекарственных средств.
Недостаточное экзогенное поступление:
-
длительное недоедание;
-
голодание при употреблении алкоголя и нервной анорексии.
Нарушение усвоения в ЖКТ:
-
прием антацидов (гидроокись алюминия, гидроксид магния);
-
длительная диарея и повторяющаяся рвота.
В. Редкие:
-
интенсивное парентеральное питание;
-
опухоли, секретирующие фосфатонины, фактор роста фибробластов 23 (FGF-23);
-
прием вальпроатов, противотуберкулезных лекарственных средств, глюкокортикостероидов;
-
состояние после трансплантации печени, почек;
-
гипофосфатемический рахит.
Комплексное обследование пациентки не выявило достоверных признаков гиперпаратиреоза, дефицита витамина D, приема лекарственных средств, нарушения питания и всасывания в кишечнике, новообразований. Изменения лабораторных показателей, характерные для наследственной/приобретенной тубулопатии, явились показанием для направления пациентки для уточнения диагноза в ФГБУ «НМИЦ эндокринологии» Минздрава России, где при проведении полноэкзомного секвенирования выявлена компаунд-гетерозиготная мутация в гене FAH (NM_000137.4 c.374C>T/c.192G>T), что является маркером тирозинемии I типа.
Тирозинемия I типа — аутосомно-рецессивное заболевание, обусловленное мутациями гена фумарилацетоацетат гидролазы (FAH), картированного на длинном плече хромосомы 15 (15q23‑q25)1 [11] и отвечающего за синтез фермента фумарилацетоацетазы, снижение активности которого в гепатоцитах и эпителиальных клетках почечных канальцев обусловливает тяжелые поражения печени, почек, осевого скелета и множества других органов и систем1 [11]. Тирозинемию подразделяют на острую и хроническую формы1 [11]. Острая форма развивается у детей первых месяцев жизни и характеризуется быстропрогрессирующей печеночной недостаточностью с летальным исходом в недиагностированных случаях. Хроническая форма болезни проявляется у детей более старшего возраста / подростков с развитием различной степени выраженности поражения печени, ренальной тубулопатии, гипофосфатемического рахита, острой периферической нейропатии, задержки умственного развития. Несмотря на то, что тирозинемия I типа — генетически гетерогенное заболевание более чем с 40 мутациями различного типа, возраст дебюта болезни колеблется от раннего неонатального до подросткового. Особенностью представленного случая явилось то, что тирозинемия I типа манифестировала с синдрома Фанкони и гипофосфатемической ОМ у взрослой пациентки, и в доступных литературных источниках мы не нашли описаний подобных клинических наблюдений: все опубликованные исследования описывают взрослых пациентов, у которых тирозинемия была диагностирована в младенчестве или раннем детском возрасте [12–14].
Заключение
Продемонстрирован уникальный случай тирозинемии I типа с дебютом клиники гипофосфатемической ОМ у взрослой пациентки, что указывает на необходимость дальнейшего изучения данной генетической патологии. Поздняя диагностика обусловлена не только особенностью манифестации заболевания у данной пациентки, но и отсутствием должных навыков диагностики ОМ у различных специалистов (ревматологов, рентгенологов). Врачу-ревматологу чрезвычайно важно помнить о возможности ревматологических масок множества заболеваний. Диагностический процесс всегда сосредоточен на конкретном пациенте, с внимательной и критической оценкой клинических, лабораторных и инструментальных показателей и исключением возможных дифференциальных диагнозов в динамике наблюдения. Врач-рентгенолог — специалист, на основании заключения которого формируется окончательный диагноз и тактика ведения пациента, что требует от него не только высокой профессиональной квалификации, но и соблюдения принятых, в том числе международных, протоколов исследования и тесного взаимодействия с клиницистом.
1Наследственная тирозинемия I типа. Клинические рекомендации. 2021 г. (Электронный ресурс.) URL: chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://pediatr-club.ru/upload/iblock/e91/e91e76714625260cee4b29d125b9db13.pdf (дата обращения: 01.10.2024).
Информация с rmj.ru






