Фотодинамическая терапия как перспективный метод лечения дистрофических заболеваний вульвы
О. В. Макаров*, доктор медицинских наук, профессор
А. З. Хашукоева*, доктор медицинских наук, профессор
О. Б. Отдельнова**, кандидат медицинских наук, доцент
Е. С. Купеева*
*РНИМУ им. Н. И. Пирогова, **Государственная классическая академия им. Маймонида, Москва
По определению Международного общества исследователей заболеваний вульвы, дистрофия вульвы — это нарушение роста и созревания эпителия, которое приводит к образованию белых пятен. Заболевание это в настоящее время недостаточно изучено и с трудом поддается лечению.
Дистрофические заболевания вульвы встречаются у 2–10% пациенток, обращающихся за медицинской помощью в женскую консультацию. Из них от 1/2 до 2/3 пациенток — это женщины, находящиеся в постменопаузе.
К дистрофическим заболеваниям вульвы относятся плоскоклеточная гиперплазия и склеротический лишай.
Плоскоклеточная гиперплазия встречается в основном у женщин в пременопаузальном периоде и менопаузе. Она характеризуется наличием утолщения кожи в области вульвы, имеющего белый или желтый цвет. Складки вульвы могут увеличиваться, но встречается и их сморщивание, при этом сужения входа во влагалище практически не наблюдается. При исследовании биоптата вульвы микроскопически выявляется утолщенный эпидермис за счет акантоза и гиперкератоза, сосочковый слой растянут, отек не выражен, в глубоких слоях кожи наблюдается картина хронического воспаления.
Склерозирующий лишай может встречаться в любой возрастной группе, хотя чаще всего бывает у женщин после наступления менопаузы. В отличие от плоскоклеточной гиперплазии, кожа в области вульвы становится тонкой, пергаментообразной, гладкой, блестящей и хрупкой, легко трескается. Складки уплотняются, клитор закрывается плотными рубцами, вход во влагалище резко суживается. При исследовании биоптата обнаруживается нормальный эпидермис, сосочковый слой сглажен, поверхностные слои кожи отечны, наблюдается гиалинизация в глубоких слоях кожи, как и при плоскоклеточной дистрофии, а также хроническое воспаление. Отмечается отсутствие подкожной жировой клетчатки.
Смешанная дистрофия встречается в 15% случаев и характеризуется наличием у пациенток как признаков плоскоклеточной гиперплазии, так и участков со склерозирующим лишаем [1, 2].
Длительное течение, способность к малигнизации с частыми рецидивами и неудовлетворительными результатами лечения ведет зачастую к социальной дезадаптации пациенток, а также к снижению качества их жизни.
Несмотря на свою актуальность, проблема лечения дистрофических заболеваний вульвы до сих пор не решена, что обусловлено недостаточной эффективностью существующих методов терапии, длительностью течения заболевания, тяжестью клинических проявлений, а также вероятностью злокачественной трансформации вульвы [3–5].
Увеличение частоты возникновения рака вульвы на фоне предшествующих дистрофических процессов поднимает значимость проблемы современной диагностики и профилактики развития злокачественной трансформации.
В последние годы отмечается увеличение числа дистрофических заболеваний вульвы, склеротического лишая и плоскоклеточной гиперплазии вульвы, на фоне которых по данным разных авторов в 9–49% случаев возникают злокачественные опухоли [6–8]. Возможность предотвратить развитие опухолевого процесса с помощью оптимизации лечения дистрофических заболеваний вульвы заставляет гинекологов прорабатывать новые методы диагностики и лечения данной патологии.
К сожалению, в настоящее время не существует абсолютного консервативного метода лечения дистрофических заболеваний наружных половых органов, который мог бы предотвратить рецидив заболевания и развитие злокачественной опухоли.
Более того, несмотря на широкий арсенал применяемых методов консервативного лечения этой патологии, эффективность их остается относительно невысокой [9]. Так, методы консервативного симптоматического лечения, включающие в себя также современные физиотерапевтические подходы, уменьшают основной клинический симптом — зуд наружных половых органов, не обеспечивая полного устранения местных морфологических изменений на слизистой вульвы, не дают длительных ремиссий и требуют продолжительных сроков лечения.
Хирургическое лечение, несмотря на более высокую эффективность в сравнении с другими методами, отличается травматичностью, высокой частотой послеоперационных осложнений, неудовлетворительными косметическими и функциональными результатами [10–13].
Вопрос эффективного лечения дистрофических заболеваний вульвы остается открытым, так как его отдаленные, а нередко и ближайшие результаты не удовлетворяют ни врачей, ни их пациентов.
Поэтому поиск новых методов лечения дистрофических заболеваний вульвы и внедрение их в клиническую практику имеет большое практическое значение.
Одним из новых высокотехнологических методов лечения является фотодинамическая терапия (ФДТ), которая показывает высокую эффективность при радикальном и паллиативном лечении онкологических новообразований различной локализации [14]. В настоящее время область применения ФДТ в медицине признана стандартным методом терапии не только злокачественных образований, но также и большого спектра заболеваний неопухолевой природы.
В гинекологии опыт применения ФДТ начался с использования ее в лечении злокачественных поражений шейки матки, а затем и вульвы [15–17].
Действие ФДТ основано на селективной деструкции патологических клеток, которая происходит в результате фотохимического воздействия при взаимодействии накапливающегося в клетках фотосенсибилизатора (ФС) и активирующего его света с определенной длиной волны, уникальной для каждого ФС. В результате фотохимической реакции происходит генерация синглетного кислорода внутри клеток и образование свободных радикалов, повреждающих мембраны и органеллы клеток, наиболее интенсивно накопивших ФС, вызывая их гибель по механизму некроза и апоптоза [18].
На протяжении полувековой истории использования ФДТ в различных областях медицины, развитие метода шло по пути создания «идеального» ФС, обладающего максимально высокой аффинностью и селективностью накопления в патологических клетках, имеющего стремительную фармакодинамику и низкую кожную фототоксичность, а также создания совершенной оптико-волоконной оптики для создания мощного источника света, доставляющего излучение к тканям. До настоящего времени остается актуальным вопрос об оптимизации этого метода и путях повышения эффективности действия ФС [19].
В нашей работе в качестве ФС использовался Фотодитазин — отечественный ФС второго поколения, на основе производных хлорофилла А. Он представляет собой N-диметилхлориновую соль хлорина Е6, полученного путем многоэтапной переработки хлорофилла водоросли Spirulina platensis Gom Geitleri. Фотодитазин имеет максимальное поглощение при длине волны излучения 662 нм, что обуславливает высокую проникающую способность излучения в ткани.
Фотодитазин обладает свойствами и характеристиками, которые существенно отличают его от остальных ФС. Хорошая растворимость препарата в воде без образования агрегированных форм отличает его от используемых ранее ФС порфиринового ряда. Фотодитазин обладает лучшими фармакокинетическими свойствами и минимальным риском развития кожной фототоксичности, так как уже 96% препарата выводится из организма в течение 24 часов.
Были проанализированы результаты лечения 30 пациенток с доброкачественными заболеваниями вульвы. По характеру выявленной патологии вульвы больные распределились таким образом: у 20 пациенток (66,7%) верифицирован склеротический лишай вульвы, у 8 (26,6%) — плоскоклеточная гиперплазия вульвы, у 2 пациенток (6,7%) — смешанная дистрофия. Возраст пациенток составлял от 33 до 80 лет, средний возраст — 56,5 лет. Как правило, пациентки страдали данной патологией от 2 до 20 лет. Длительность периода постменопаузы колебалась от 5 до 25 лет. У 16 пациенток был выявлен вирус папилломы человека (ВПЧ) 16-го, 18-го типа (53,3%), у 6 пациенток — ВПЧ 31-го, 33-го типа (20%), у 8 пациенток ВПЧ не выявлено (26,7%).
Методы. Для получения представления о характере патологического процесса нами был произведен подробный сбор анамнеза пациенток, гинекологический осмотр, комплексное клиническое обследование, включающее в себя также цитологическое исследование соскоба с вульвы, вульвоскопию, гистологическое исследование биопсийного материала, определение ВПЧ методом полимеразной цепной реакции (ПЦР) с ДНК-типированием с поверхности вульвы.
В качестве ФС при проведения ФДТ нами использовался Фотодитазин в виде раствора для внутривенного введения в дозе 1 мг/кг массы тела. Облучение вульвы осуществлялось с помощью лазерной установки «Аткус-2». Световое воздействие проводили в непрерывном или фракционном режиме. Длина волны излучения составляла 662 нм, мощность лазерного излучения на торце световода составила 2 мВт, плотность энергии 100–250 Дж/см2 для вульвы.
Для определения оптимальных временных параметров начала облучения, которые соответствуют максимуму накопления Фотодитазина в ткани вульвы, был использован метод локальной флуоресцентной спектороскопии с помощью спектральной флюоресцентной диагностической установки «Спектр-Кластер» спектроскопии.
Измерение проводилось до введения ФС для оценки эндогенной аутофлюоресценции и через 30, 60, 90, 120, 160 мин после внутривенного введения ФС для оценки экзогенного возбуждения флюоресцентных тканей. Максимальные значения флюоресценции, то есть накопления ФС в тканях вульвы, наблюдались через 1,5–2 часа после внутривенного введения ФС. Именно это время и было выбрано в качестве оптимального для начала проведения лазерного облучения.
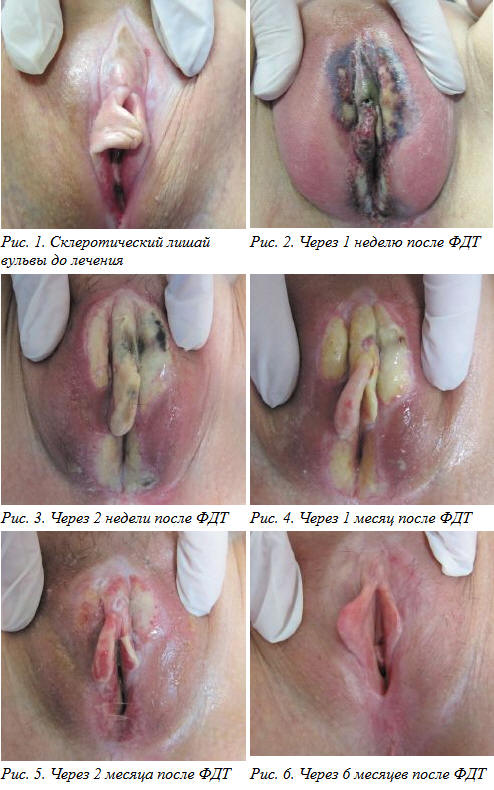
Результаты. Лечебный эффект оценивался визуально, на основании жалоб на наличие или отсутствие зуда в области вульвы, цитологического исследования соскоба с вульвы и вульвоскопии. При наблюдении в течение 6 месяцев было подтверждено, что лечебный эффект сохранялся, а рецидивы не наблюдались.
Так, исчезновение зуда в области вульвы отмечено у 17 из 20 больных склеротическим лишаем вульвы. У трех больных склеротическим лишаем вульвы потребовалось проведение повторного сеанса ФДТ из-за сохраняющихся клинических симптомов заболевания, после чего был достигнут положительный лечебный эффект. Больные наблюдались в течение 6 месяцев после процедуры.
Противовирусный эффект ФДТ оценивался после повторной ПЦР с ДНК-типированием ВПЧ с поверхности вульвы. По результатам полученных нами данных ВПЧ не был обнаружен ни у одной пациентки.
Побочные реакции были отмечены во всех случаях проведения ФДТ и заключались лишь в незначительном болевом синдроме после проведения процедуры ФДТ и подъеме температуры тела у четырех пациенток в первые 2–3 дня после процедуры максимально до 38 °C, которые купировались приемом нестероидных противовоспалительных средств. У одной пациентки отмечалась фототоксическая реакция в виде незначительного отека с присоединением зуда в области места введения Фотодитазина в связи с несоблюдением светового режима сразу после проведения сеанса ФДТ. Эта реакция была купирована приемом антигистаминного препарата.
Обсуждение. Анализ полученных результатов ФДТ с использованием ФС Фотодитазин при лечении дистрофических заболеваний вульвы показал высокую терапевтическую эффективность использования данного метода. Кроме того, отсутствие необходимости в применении анестезиологического пособия делает возможным его использование в амбулаторных условиях. Это особенно важно также для пациенток с тяжелой экстрагенитальной патологией, которая зачастую является противопоказанием для проведения анестезиологического пособия.
Во всех случаях был зафиксирован хороший косметический эффект, что особенно актуально для женщин репродуктивного возраста.
Выводы. Полная клиническая ремиссия в группе патологии вульвы отмечена у 27 (90%) из 30 больных. У 3 (10%) пациенток со склеротическим лишаем вульвы потребовалось проведение повторного сеанса ФДТ, после чего было диагностировано клиническое излечение.
Заключение. Метод ФДТ вульвы с использованием ФС Фотодитазин представляет собой новый перспективный способ лечения дистрофических заболеваний вульвы и может служить эффективной профилактикой развития рака вульвы. В целом, полученные результаты ФДТ с использованием ФС Фотодитазин при лечении женщин с дистрофическими заболеваниями вульвы показали его высокую лечебную активность, противовирусную активность, минимальное количество побочных эффектов и осложнений, методическую простоту исполнения, что делает возможным использование ФДТ для лечения дистрофических заболеваний вульвы и в амбулаторных условиях.
Литература
- Кауфман Р., Фаро С., Браун Д. Доброкачественные заболевания вульвы и влагалища. М., 2009, с. 320–343.
- Практическая гинекология. Под ред. акад. РАМН В. И. Кулакова, проф. В. Н. Прилепской. 4-е издание. М.: «МЕДпресс-информ», 2008, с. 69–74.
- Ашрафян Л. А., Харченко Н. В., Киселев В. И. и др. Рак вульвы: эпиопатогенетическая концепция. М., 2006, с. 192.
- Бохман Я. В. Руководство по онкогинекологии. СПб: «ООО Издательство Фолиант», 2002, с. 542.
- Штемберг М. И. Крауроз и лейкоплакия вульвы. Кишинев, 1980.
- Кривец Н. А., Позднякова А. П. Предрак и рак вульвы. 1999, с. 275.
- Нагуло С. А. Сравнительная оценка клинического течения эффективности лечения.
- Прозорова А. С., Торчинов А. М., Антохин В. М. и др. Фотодинамическая терапия с использованием лазерного излучения средней мощности на парах золота при лейкоплакии вульвы // Вестник российской ассоциации акушеров-гинекологов. 1998, № 4.
- Жаров А. В., Котляров Е. В. Реконструктивно-пластические операции при лечении предопухолевых заболеваний вульвы // Акушерство и гинекология. 2001, № 6, с. 39–43.
- Жаров А. В., Важенин А. В. Оптимизация лечения больных раком вульвы. Челябинск, 2005. 131 с.
- Манухин И. Б., Кондриков Н. И., Крапошина Т. П. Заболевания наружных половых органов у женщин. М.: МИА, 2002, 303 с.
- Rhodes C. A., Shaft M. L. The management of squamous cell vulvar cancer: Apopulation based retrospective study of 411 cases // Brit. J. Obstet. and Gynaecol. 1988. Vol. 105. № 2. Р. 200–205.
- Stucker M., Grape J., Bechara F. G. et al. The outcome after cryosurgery and intralesional steroid injection in vulvar lichen sclerosus corresponds to preoperative histopathological findings // Dermatology. 2005. Vol. 210. № 3. P. 218–222.
- Juarranz A., Jaen P., Sanz-Rodriguez F., Cuevas J., Gonzalez S. Photodynamic therapy of cancer. Basic principles and applications // Clin Transl Oncol. 2008, Mar; 10 (3): 148–154.
- Дадвани С. А., Зуев В. М., Харнас С. С. и др. Фотодинамическая терапия в гинекологии // Лазерная медицина. 2000. Т. 4, вып. 4, с. 72–79.
- Чулкова О. В., Новикова Е. Г., Соколов В. В., Чулкова Е. А. Диагностика и лечение фоновых и предраковых заболеваний вульвы // Практическая онкология. 2006. Т. 7. № 4, с. 197–204.
- Ascencio M., Collinet P., Cosson M., Vinatier D., Mordon S. The place of photodynamic therapy in gynecology // Gynecol Obstet Fertil. 2007, Nov; 35 (11): 1155–1165. Epub 2007, Oct 22.
- Wilson B. C., Patterson M. S. The physics, biophysics and technology of photodynamic therapy // Phys Med Biol. 2008, May 7; 53 (9): R61–109. Epub 2008, Apr 9.
- Странадко Е. Ф. Исторический очерк развития фотодинамической терапии // Лазерная медицина. 2002. Т. 6, № 6, с. 4–8.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






