Введение
Бронхолегочная дисплазия (БЛД) остается одним из ведущих хронических заболеваний дыхательной системы у глубоко недоношенных новорожденных. Ее развитие обусловлено незрелостью легочной ткани и воздействием факторов неонатальной интенсивной терапии, таких как кислородная поддержка, искусственная вентиляция легких (ИВЛ) и воспалительные процессы. У части пациентов помимо дыхательных нарушений формируются и сохраняются отдаленные сердечно-сосудистые последствия [1, 2].
Согласно сосудистой гипотезе у недоношенных детей с БЛД нарушается ангиогенез, что ведет к снижению капиллярной плотности, дезорганизации сосудов и раннему ремоделированию. Это связано с дефицитом сосудистого эндотелиального фактора роста (vascular endothelial growth factor — VEGF) и дисрегуляцией оксида азота и эндотелина 1 [3]. Развивается системная сосудистая дисфункция, повышается артериальная жесткость, формируются предпосылки для легочной гипертензии (ЛГ) и дисфункции правого желудочка (ПЖ) [4].
Хроническое воспаление и оксидативный стресс при БЛД вызывают активацию эндотелия, ремоделирование сосудов и фиброз через повышение уровней цитокинов и молекул адгезии [1]. Гипероксия и ИВЛ усиливают оксидативный стресс, нарушая эндотелий и снижая синтез оксида азота (NO), что ухудшает сосудистую реактивность и повышает сопротивление [1]. Активация ренин-ангиотензин-альдостероновой системы (РААС) ведет к вазоконстрикции, задержке жидкости, гипертрофии и прогрессированию гипертензии, способствуя раннему сосудистому старению [5].
Кардиоваскулярные изменения при БЛД включают повышение легочного сосудистого сопротивления и перегрузку ПЖ уже в раннем возрасте, приводящие к его ремоделированию и дисфункции [6]. С возрастом усиливаются сосудистые изменения: растет жесткость артерий, утолщается интима — медиа, повышается центральное артериальное давление (АД) [7–9]. У пациентов с БЛД выявляются диастолическая и систолическая дисфункции, гипертрофия, снижение резервов ПЖ и левого желудочка (ЛЖ). Изменения ЛЖ повышают риск ранней гипертензии, ишемической болезни сердца (ИБС) и сердечной недостаточности [10–12].
С конца 1990-х годов внимание исследователей переключилось с изучения респираторных осложнений на системные сердечно-сосудистые последствия БЛД. Термин «новая бронхолегочная дисплазия» (new bronchopulmonary dysplasia — new BPD) был предложен A.H. Jobe [13]. В последующих исследованиях показано, что нарушение ангиогенеза ассоциировано с развитием ЛГ и сосудистым ремоделированием [2, 4]. Современные данные свидетельствуют о том, что у пациентов с БЛД с раннего до подросткового возраста часто выявляются снижение эластичности сосудов, признаки преждевременного сосудистого старения и миокардиальные изменения [12, 14]. Особую значимость имеют субклинические дисфункции, протекающие бессимптомно и выявляемые лишь при расширенной диагностике [7, 8, 15].
Неинвазивная визуализация и биомаркеры улучшают раннюю диагностику сердечно-сосудистых изменений при БЛД. Современные методы эхокардиографии (ЭхоКГ) (тканевой допплер, спекл-трекинг, 3D/4D) выявляют даже минимальные нарушения функции миокарда [16]. Магнитно-резонансная томография (МРТ) с контрастом и динамической перфузией позволяет оценить сосудистое утоньшение, легочную перфузию и признаки ЛГ [17]. Биомаркеры — N-концевой фрагмент мозгового натрийуретического пептида (N-terminal pro-brain natriuretic peptide — NT-proBNP), тропонины, С-реактивный белок, интерлейкины, маркеры нитрозативного стресса позволяют оценить нагрузку на сердце и сосуды, воспалительный статус и риск неблагоприятных исходов [18].
Выявление снижения сосудистой реактивности и утолщения комплекса интима — медиа важно для оценки сердечно-сосудистого риска и персонализированной профилактики [7, 8, 19]. По данным метаанализов, БЛД и недоношенность ассоциированы с артериальной жесткостью, снижением сосудистой эластичности и стойкими нарушениями функции миокарда [1, 20]. У молодых взрослых с экстремально низкой массой тела при рождении (<1500 г) фиксируются повышение АД на 3–4 мм рт. ст., признаки ранней ЛГ и нарушения вегетативной регуляции ритма [21]. Эти данные подчеркивают необходимость раннего выявления сердечно-сосудистых нарушений у детей с БЛД с использованием ЭхоКГ, суточного мониторирования АД и оценки сосудистой функции. Перспективными направлениями остаются поиск генетических предикторов ЛГ и оценка биомаркеров кардиальной нагрузки (NT-proBNP, тропонины) у пациентов с БЛД [22].
Цель исследования: проанализировать кардиоваскулярные последствия у пациентов с БЛД в анамнезе — от младенческого возраста до зрелости.
Содержание статьи
Материал и методы
Настоящий обзор обобщает данные о состоянии сердечно-сосудистой системы у пациентов с БЛД в возрасте от младенчества до 30 лет, с акцентом на возрастную динамику изменений и их возможные механизмы. Рассмотрены показатели правых отделов сердца, АД, жесткости сосудов и эндотелиальной функции. Особое внимание уделено прогрессирующей дисфункции миокарда, нарушению сосудистого тонуса и снижению эластичности артерий. Поиск источников проводился в базах PubMed, Scopus и eLibrary за 2005–2025 гг. Из 63 работ в обзор включены 28 наиболее информативных. Для иллюстрации эволюции научного интереса к данной теме проанализирована публикационная активность, отражающая рост внимания к кардиоваскулярным аспектам БЛД.
Результаты и обсуждение
На рисунке 1 представлена динамика научного интереса к кардиоваскулярной системе у пациентов с БЛД за последние десятилетия.
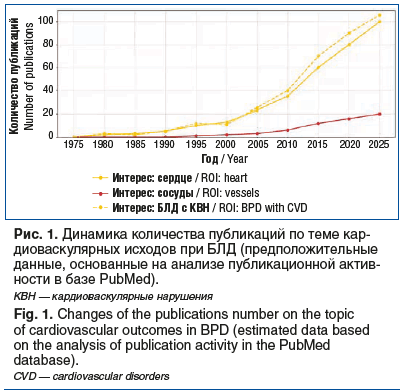
До 2000 г. исследования преимущественно фокусировались на респираторных осложнениях, перегрузке ПЖ и ЛГ как частых последствиях у недоношенных. Первоначально акцент делался на неонатальный период, однако с ростом выживаемости недоношенных детей, перенесших БЛД, внимание сместилось к системным сосудистым изменениям. С 2010-х годов активно изучаются артериальная жесткость, снижение эластичности и признаки преждевременного сосудистого старения, обусловленные гипоксией, воспалением и активацией РААС. Эти процессы приводят к эндотелиальной дисфункции и фиброзу сосудистой стенки. Развитие неинвазивных методов (пульсовая волна, индекс аугментации, толщина комплекса интима — медиа), усовершенствование ЭхоКГ (тканевой допплер, спекл-трекинг) и использование биомаркеров (NT-proBNP, тропонины) позволяют выявлять субклинические нарушения и проводить стратификацию риска. Смещение акцента на системные проявления подчеркивает мультиорганную природу БЛД и необходимость ранней профилактики.
Для систематизации данных была проведена выборка публикаций о кардиоваскулярных изменениях у пациентов с БЛД в анамнезе. Были проанализированы данные изучения кардиоваскулярных изменений у пациентов с БЛД в анамнезе, охватывающие возраст от первого года жизни до 30 лет, с указанием направлений исследований (кардиальные или сосудистые изменения) и применяемых методов диагностики, что позволило проследить эволюцию научного интереса и выявляемых нарушений в зависимости от возраста. Были рассмотрены исследования, посвященные изучению состояния сердца и сосудов у пациентов с БЛД на разных этапах жизни. Особое значение имеет период первых 5 лет, когда формируются адаптационные механизмы и закладываются долгосрочные кардиоваскулярные риски.
У младенцев первого года жизни (до 12 мес.) основное внимание уделяется ПЖ — наиболее чувствительному к повышенному легочному сопротивлению и хронической гипоксии при БЛД. С помощью МРТ было выявлено утолщение его стенок, уменьшение полости и снижение податливости миокарда, что отражает раннюю концентрическую гипертрофию в ответ на постнагрузку [23]. Эти изменения развиваются на фоне хронического воспаления и повышенных уровней интерлейкина 6 (interleukin-6 — IL-6) и фактора некроза опухоли α (tumor necrosis factor-alpha — TNF-α), что способствует фиброзу и снижению эластичности миокарда [24]. Спекл-трекинг ЭхоКГ позволяет выявлять нарушения торсии и скручивания ЛЖ, снижение координации волокон и механической эффективности при сохраненной фракции выброса (ФВ) [25]. Эти изменения рассматриваются как ранние проявления субклинической дисфункции ЛЖ, обусловленной постнагрузкой и воспалением. С помощью спекл-трекинг ЭхоКГ у детей было выявлено снижение продольной деформации ПЖ, что свидетельствует о начальных нарушениях его функции до развития явной дисфункции [26]. Указанные показатели являются чувствительными маркерами раннего снижения насосной функции сердца. Уже в младенческом возрасте стандартная ЭхоКГ позволяет выявить сопутствующие изменения со стороны сосудистого русла — признаки повышенной жесткости и снижения эластичности артериальной стенки, что отражает системный характер ремоделирования при БЛД [27]. Изменения связаны с дисфункцией эндотелия и нарушением синтеза NO, что способствует формированию неблагоприятного сосудистого фенотипа и повышению риска артериальной гипертензии в последующем.
У детей раннего возраста (2–5 лет) усиливается физическая активность и, как следствие, ускоряются метаболические процессы, что требует высокой адаптационной способности сердца. В этом возрасте у детей выявляются утолщение стенок, уменьшение полостей и снижение ударного объема как в ПЖ, так и в ЛЖ [4]. Эти изменения отражают ремоделирование миокарда на фоне хронических гемодинамических нарушений и воспаления. Даже при сохраненной ФВ могут присутствовать диастолическая дисфункция и снижение продольной сократимости, которые без применения специализированных методов ЭхоКГ остаются невыявленными [4].
Применение 2D, 3D и 4D ЭхоКГ у детей 2–5 лет позволило оценить не только морфологию, но и механику сердца [28]. У детей с БЛД уже в раннем возрасте выявляются утолщение стенок ЛЖ, снижение податливости и объема ЛП — признаки субклинической дисфункции с риском ЛГ. Ограничение резервной функции ЛП снижает адаптацию к нагрузке и повышает риск кардиальных осложнений. Современные методы визуализации (спекл-трекинг, тканевой допплер, многоплоскостная ЭхоКГ) позволяют выявлять минимальные изменения на доклиническом этапе.
В дошкольном возрасте (5–6 лет) у детей с БЛД на фоне роста повышается нагрузка на сердечно-сосудистую систему. С помощью ЭхоКГ выявляются утолщение стенок ЛЖ, снижение диастолической податливости и уменьшение объема ЛП — ранние признаки возможных КВН в будущем [29, 30]. Изменения отражают рост ригидности миокарда и нарушение наполнения на фоне хронической перегрузки и воспаления. Снижение резервной функции ЛП повышает давление в легочных венах и, как следствие, нагрузку на малый круг кровообращения. У детей около 7 лет сохраняются признаки нарушения функции ПЖ, особенно у перенесших ЛГ в младенчестве [31, 32]. У детей отмечается снижение сократимости и изменение геометрии ПЖ как адаптационный ответ на повышенное давление в легочной артерии. Эти отклонения часто бессимптомны и проявляются при нагрузке, что требует проведения функциональных проб. У детей 6–12 лет выявлены скрытые нарушения систолической функции ЛЖ и ПЖ при сохраненной ФВ, что подтверждается данными векторной визуализации миокарда [33]. Эти данные подтверждают, что у пациентов с БЛД уже в школьном возрасте возможно снижение насосной функции и формирование субклинической дисфункции миокарда.
В подгруппе подростков 11–14 лет акцент смещается на оценку легочных сосудов [34]. По данным ЭхоКГ, у подростков с БЛД выявлены признаки ЛГ, утолщение сосудистой стенки и перегрузка ПЖ, обусловленные хронической гипоксией и нарушением соотношения коллагена и эластина. Это усиливает жесткость сосудов, повышает нагрузку на ЛЖ, способствуя его гипертрофии и нарушению диастолического расслабления [35, 36]. Эти изменения в сочетании с повышением сосудистой ригидности формируют предпосылки к ранней артериальной гипертензии и снижению толерантности к нагрузке [37]. Также наблюдаются утолщение сосудистой стенки, снижение эластичности и повышение индекса аугментации (augmentation index — AIx) — маркера сосудистой жесткости и отражения пульсовых волн.
С помощью МРТ у пациентов 13–26 лет [35] выявлены уменьшение объема камер сердца, утолщение стенок и концентрическая перестройка миокарда, отражающие долговременное влияние гипоксии и воспаления. Уже с 5-летнего возраста формируются комплексные изменения сердца и сосудов. В дальнейшем у подростков 13–14 лет по данным ЭхоКГ определяются диастолическая дисфункция и повышение давления наполнения левых отделов сердца [36]. В возрасте 13–17 лет регистрируются повышение AIx и снижение сосудистой эластичности [37], что усиливает постнагрузку и прогрессирование гипертрофии ЛЖ.
У 18-летних пациентов выявлено снижение диастолического объема ЛЖ и увеличение индекса массы миокарда [21, 38]. При проведении нагрузочных кардиореспираторных тестов в возрасте 18–22 лет выявлены уменьшение максимального потребления кислорода и ударного объема сердца, что объясняет жалобы на утомляемость и снижение выносливости [39].
У молодых людей 18–25 лет при проведении нагрузочной ЭхоКГ выявлены скрытые ограничения сократимости ЛЖ, проявляющиеся только при физической нагрузке [40]. Исследования функции легочной артерии и сосудистой реактивности в этой возрастной группе подтверждают ригидность сосудов и снижение адаптации, что создает дополнительную нагрузку на ПЖ [41]. В возрасте 23–26 лет по данным ЭхоКГ выявлены ухудшение диастолической податливости ПЖ, замедление раннего наполнения и снижение ударного объема [42, 43], что повышает риск правожелудочковой недостаточности при физических нагрузках. В возрасте 26 лет отмечено нарушение согласованной работы ПЖ и легочной артерии, ухудшающее адаптацию к сосудистому сопротивлению и усиливающее перегрузку правых отделов сердца [44]. При комбинированном анализе данных МРТ и ЭхоКГ у пациентов 26–30 лет были показаны выраженное ремоделирование миокарда, утолщение сосудистой стенки и снижение сосудистой эластичности [45]. Эти находки указывают на формирование фенотипа преждевременного сердечно-сосудистого старения даже в молодом возрасте. Нагрузочная ЭхоКГ у пациентов 13–20 лет выявила снижение функционального резерва ЛЖ — ограничение ударного объема и ФВ при нагрузке [1]. В возрасте 20–25 лет при проведении совмещенных ЭхоКГ и МРТ были продемонстрированы дисфункция ПЖ, признаки ЛГ и ремоделирование сосудов легких [46]. У пациентов 26–27 лет по данным динамической контрастной МРТ выявлено снижение капиллярной плотности и ухудшение альвеолярного газообмена, обусловленные хроническим воспалением, нарушением ангиогенеза и интерстициальным фиброзом. Эти изменения указывают на скрытую сосудистую и респираторную недостаточность, часто не выявляемую стандартными методами [47].
У подростков и молодых взрослых, перенесших БЛД, формируется многокомпонентная перестройка сердечно-сосудистой системы: ремоделирование сердца, снижение резерва, сосудистая жесткость и ЛГ. Основные механизмы этих изменений — гипоксия, воспаление, эндотелиальная дисфункция и активация РААС. Ключевым звеном становится нарушение наполнения и функции ПЖ [42, 43]. Одновременно повышение жесткости легочной артерии и снижение функционального резерва сердца [40, 41] приводят к снижению толерантности к физической нагрузке и быстрому истощению компенсаторных механизмов. Эти изменения длительно остаются субклиническими, проявляясь только при нагрузке. Повышение сосудистой жесткости, характерное для подростков и молодых взрослых с БЛД в анамнезе, связано с хроническим воспалением, нарушением регуляции сосудистого тонуса (в том числе снижением продукции NO) и фиброзом сосудистой стенки [37, 38].
В детском возрасте с целью выявления ранних признаков субклинической дисфункции ПЖ и ЛЖ наиболее информативны спекл-трекинг ЭхоКГ и тканевой допплер. У подростков важна оценка сосудистой жесткости для определения степени перестройки и риска артериальной гипертензии. У молодых взрослых наибольшую ценность имеют данные МРТ сердца и нагрузочные тесты, позволяющие оценить объемы, геометрию камер, фиброз миокарда и легочную микроциркуляцию [47]. Субклинические кардиоваскулярные изменения при БЛД выявляются в разном возрасте, часто — только при углубленной диагностике. Это требует регулярного наблюдения даже без наличия клинических симптомов. С возрастом меняются мишени поражения сердца: в детстве — ПЖ и легочная артерия, в подростковом возрасте — артериальная жесткость и ЛЖ, в молодом — миокардиальная дисфункция и ЛГ. Ведение таких пациентов диктует необходимость применения функциональных тестов и проведения реабилитационных мероприятий. Перспективны лонгитудинальные исследования и определение биомаркеров поражения сердца для индивидуальной стратификации риска. На рисунке 2 показаны ключевые временные этапы формирования КВН у пациентов с БЛД. С учетом разнородности показателей (функция желудочков, АД, сосудистая жесткость) была введена интегральная оценка в условных единицах от 0 до 10, отражающая суммарную выраженность изменений.
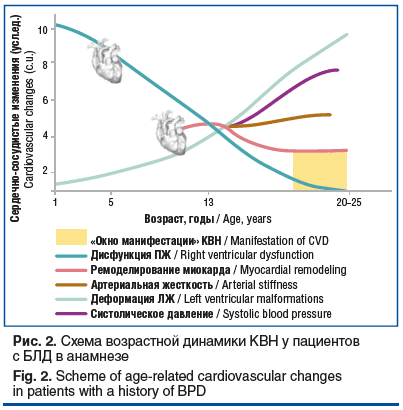
Уже в первый год жизни у пациентов с БЛД часто снижается функция ПЖ из-за повышенной нагрузки на легочное русло (ЛГ, гипоксия, нарушения сосудистой архитектуры). Развивается концентрическая гипертрофия с ухудшением сократимости и податливости. Хроническая гипоксия усиливает воспаление и вазоконстрикцию. Клинические проявления обычно скудны: тахипноэ, утомляемость при кормлении.
К 5 годам наступает переходный этап: нагрузка на ПЖ снижается за счет снижения давления в легочной артерии, созревания альвеол и сосудистой сети. При этом возрастает нагрузка на ЛЖ, который адаптируется через утолщение стенок, уменьшение объема полости и признаки диастолической дисфункции. Эти изменения отражают хронический стресс миокарда и начало фиброзных процессов, снижая резервные возможности сердца. У ребенка могут наблюдаться снижение толерантности к физической нагрузке, повышенная утомляемость при активной игре.
К 13 годам сердечно-сосудистая перестройка становится более выраженной: повышается артериальная жесткость, снижается эластичность сосудов, утолщается комплекс интима — медиа, появляются первые признаки диастолической дисфункции ЛЖ. Эти изменения связаны со стойкой эндотелиальной дисфункцией, хроническим воспалением, снижением синтеза NO и активацией РААС, которая усиливает вазоконстрикцию и способствует фиброзу сосудов и миокарда. Ремоделирование сосудистой стенки связано с дисбалансом коллагена и эластина, активацией металлопротеиназ и увеличением ригидности. Клинически возможны одышка при нагрузке, учащенный пульс, снижение выносливости.
К 25 годам у части пациентов с БЛД выявляются нарушения сосудистой эластичности, повышение АД, диастолическая и начальная систолическая дисфункция ЛЖ. Эти субклинические изменения повышают риск артериальной гипертензии, сердечной недостаточности и ишемических событий. Возможны одышка при нагрузке, сердцебиение, эпизоды подъема АД. Важно раннее выявление нарушений и проведение профилактики. Желтым цветом на схеме выделено «окно манифестации» КВН (20–25 лет) — период, когда сердечно-сосудистая патология может впервые проявиться. В дальнейшем, в возрасте до 30 лет, сохраняется высокая значимость углубленного кардиологического обследования (оценка функционального резерва, нагрузочные тесты, показатели сосудистой жесткости), что позволяет своевременно выявить прогрессирование изменений и снизить риск осложнений.
Заключение
Данный обзор показывает, что у пациентов с БЛД в анамнезе с возрастом постепенно формируются сердечно-сосудистые изменения. В раннем детстве чаще страдает ПЖ вследствие повышенной нагрузки на легочное русло (ЛГ, гипоксия, нарушения сосудистой архитектуры). В подростковом и молодом возрасте на первый план выходят артериальная жесткость и нарушения функции ЛЖ, связанные с воспалением и эндотелиальной дисфункцией. Это повышает риск гипертонии и сердечной недостаточности. Особенно важен период активного роста — с 13 до 25 лет, когда следует уделять особое внимание кардиоваскулярной системе и профилактике этих нарушений. Анализ динамики этих изменений подчеркивает необходимость долгосрочного наблюдения. Помимо сердечно-сосудистой системы, отдаленные последствия БЛД затрагивают качество жизни в целом: пациенты чаще жалуются на быструю утомляемость, избегают физической активности, могут испытывать тревожность и стресс [47, 48].
Результаты проведенного анализа демонстрируют необходимость раннего выявления риска формирования КВН у детей с БЛД для построения индивидуальной траектории наблюдения и профилактики атеросклероза и артериальной гипертензии во взрослом возрасте.
Сведения об авторах:
Царева Жанна Александровна — педиатр, пульмонолог, врач отделения пульмонологии ГАУЗ СО «ДГКБ № 9»; 620034, Россия, г. Екатеринбург, ул. Решетская, д. 51; ORCID iD 0009-0005-6459-763X
Царькова Софья Анатольевна — д.м.н., профессор, заведующая кафедрой поликлинической педиатрии института педиатрии и репродуктивной медицины ФГБОУ ВО УГМУ
Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; врач ГАУЗ СО «ДГКБ № 11»; 620028, Россия, г. Екатеринбург, ул. Нагорная, д. 48; ORCID iD 0000-0003-4588-5909
Лещенко Игорь Викторович — д.м.н., профессор, профессор кафедры инфекционных болезней, фтизиатрии и пульмонологии института клинической медицины ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; главный научный сотрудник УНИИФ — филиала ФГБУ «НМИЦ ФПИ» Минздрава России; 620039, Россия, г. Екатеринбург, ул. 22-го Партсъезда, д. 50; научный руководитель клиники, пульмонолог ООО МО «Новая больница»; 620109, Россия, г. Екатеринбург, ул. Заводская, д. 29; ORCID iD 0000-0002-1620-7159
Контактная информация: Царева Жанна Александровна, е-mail: dmb9zhanna@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.07.2025.
Поступила после рецензирования 11.08.2025.
Принята в печать 28.08.2025.
About the authors:
Zhanna A. Tsareva — pediatrician, pulmonologist, doctor of the Department of Pulmonology, Children City Clinical Hospital No. 9; 51, Reshetskaya str., Yekaterinburg, 620034, Russian Federation; ORCID iD 0009-0005-6459-763X
Sofia A. Tsarkova — Dr. Sc. (Med.), Professor, Head of the Department of Outpatient Pediatrics at the Institute of Pediatrics and Reproductive Medicine, Ural State Medical University; 3, Repina str., Yekaterinburg, 620028, Russian Federation; doctor of the Children City Clinical Hospital No. 11; 48, Nagornaya str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0003-4588-5909
Igor V. Leshchenko — Dr. Sc. (Med.), Professor, Professor of the Department of Infectious Diseases, Phthisiology and Pulmonology at the Institute of Clinical Medicine, Ural State Medical University; 3, Repina str., Yekaterinburg, 620028, Russian Federation; Chief Researcher at the Ural Research Institute of Phthisiopulmonology — Branch of the National Medical Research Center of Phtysiopulmonology; 50, 22nd Parts’ezda str., Yekaterinburg, 620039, Russian Federation; Scientific Director of the Clinic, pulmonologist, «New Hospital» Medical Association LLC; 29, Zavodskaya str., Yekaterinburg, 620109, Russian Federation; ORCID iD 0000-0002-1620-7159
Contact information: Zhanna A. Tsareva, e-mail: dmb9zhanna@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 23.07.2025.
Revised 11.08.2025.
Accepted 28.08.2025.
Информация с rmj.ru




