Введение
Течение интерстициальных заболеваний легких (ИЗЛ) достаточно вариабельно: от полной регрессии патологических изменений в легочной ткани до неуклонного прогрессирующего течения, преимущественно за счет нарастания фиброза и формирования дыхательной недостаточности (ДН) [1]. Такое течение ИЗЛ у ряда пациентов способствовало выделению отдельной формы, которая получила наименование «ИЗЛ с прогрессирующим фиброзным фенотипом (ПФФ)» [2]. Своевременное назначение антифибротических препаратов, обладающих прямым или опосредованным действием на процессы фиброобразования, влияет на прогноз течения ИЗЛ ПФФ, замедляет темпы утраты функции респираторной системы и позволяет сохранить приемлемое для пациента качество жизни [2]. В настоящее время применяются для лечения ИЗЛ ПФФ нинтеданиб и пирфенидон [3]. Наиболее неблагоприятный прогноз с развитием тяжелой ДН характерен для идиопатического легочного фиброза (ИЛФ) [1]. Оценка эффективности антифибротической терапии (АФТ) является необходимой мерой с точки зрения прогнозирования ожидаемой клинической пользы для пациента с учетом этиологии интерстициального заболевания.
Цель исследования: определить эффективность АФТ у пациентов с различными нозологиями ИЗЛ ПФФ на основании клинико-функциональных и рентгенологических данных.
Содержание статьи
Материал и методы
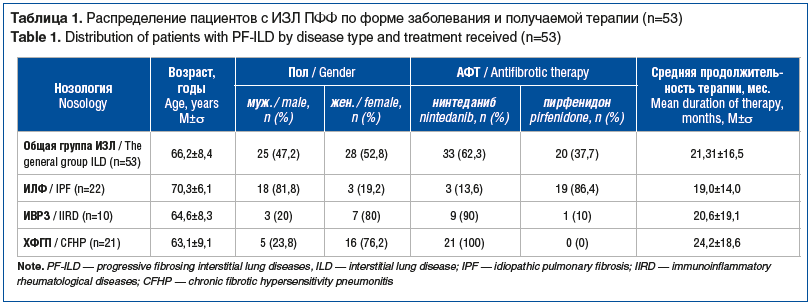
Проведен анализ регистра больных ИЗЛ, получающих АФТ в г. Екатеринбурге и Свердловской области. В регистр включен 131 пациент с ИЗЛ в течение 5-летнего наблюдения. Из них АФТ получали 53 (40,5%) пациента: нинтеданиб — 33 и пирфенидон — 20 пациентов. Под динамическим наблюдением в настоящее время находятся 54 (41,2%) пациента с ИЗЛ без ПФФ из включенных в регистр. За время наблюдения умерли 24 (18,3%) пациента. Диагноз ИЗЛ основывался на клинико-анамнестических, лабораторных, функциональных данных, результатах высокоразрешающей компьютерной томографии легких (КТВР), в 12 (9,1%) случаях — на данных гистологической картины при междисциплинарном обсуждении с участием пульмонолога и рентгенолога, в случаях аутоиммунных ИЗЛ (31 (23,7%) пациент) — с участием ревматолога. Протокол исследования одобрен локальным этическим комитетом ООО МО «Новая больница». У каждого пациента получено письменное информированное согласие на участие в исследовании.
Оценивали жалобы на кашель, выраженность одышки по шкале mMRC (Modified Medical Research Council). Всем пациентам проводили пульсоксиметрию, 6-минутный тест для определения ДН. Показатели легочной функции определяли по данным спирометрии (форсированная жизненная емкость легких, ФЖЕЛ) и исследованию диффузионной способности легких по монооксиду углерода методом однократного вдоха (DLco) [4]. Для исключения или подтверждения ревматологических заболеваний проводили серологический скрининг, включающий определение ревматоидного фактора, антиядерных антител, антител к циклическому цитруллинированному пептиду, при необходимости — других лабораторных маркеров.
Определены три наиболее многочисленные нозологические формы ИЗЛ ПФФ: идиопатический легочный фиброз, ИЗЛ при иммуновоспалительных ревматологических заболеваниях (ИВРЗ), хронический фибротический гиперчувствительный пневмонит (ХФГП), в соответствии с которыми были сформированы 3 группы. В каждой группе проведен анализ клинических, функциональных и рентгенологических данных в динамике на фоне АФТ в течение 24 мес., назначенной с момента установления окончательного диагноза. Распределение пациентов в зависимости от нозологической формы ИЗЛ ПФФ и терапии представлено в таблице 1.
Статистическая обработка результатов исследования проводилась с помощью программы Medstatistiс с расчетом показателей вариационного ряда (средняя (М), медиана (Ме), стандартное квадратичное отклонение (σ)).
Результаты исследования
Первая группа — ИЛФ (n=22). Из 22 больных 19 находились на лечении пирфенидоном и 2 человека получали нинтеданиб. Кашель отмечали 12 пациентов, из них у 4 кашель в результате АФТ регрессировал. Жалобы на одышку предъявляли все пациенты 1-й группы. При оценке выраженности одышки по шкале mMRC у 12 больных одышка соответствовала 2-й степени, у 7 — 3-й степени, у 3 — 4-й степени. На фоне АФТ один пациент отмечал усиление одышки, что не подтвердилось прогрессированием изменений при КТВР и не сопровождалось снижением функциональных показателей. Уменьшение одышки на фоне терапии отметили 2 человека. Характерная деформация концевых фаланг пальцев по типу «пальцев Гиппократа» выявлена у 7 пациентов. Феномен крепитации «Velcro» при аускультации легких определялся у 20 (90,9%) пациентов. Большинство (14 (63,6%)) пациентов страдали ДН II и III степени, и 2 больных находились на длительной кислородотерапии в домашних условиях. В течение 24-месячной терапии уровень ДН оставался прежним. Более половины пациентов с ИЛФ имели сочетанную патологию: 13 — сердечно-сосудистые заболевания, 7 — хроническую обструктивную болезнь легких (ХОБЛ), 6 — сахарный диабет, 4 мужчины — заболевания предстательной железы, 1 женщина — злокачественное новообразование молочной железы. По шкале Gender, Age, Physiology (GAP) 3 пациента с ИЛФ соответствовали I стадии, 11 и 8 — II и III стадиям соответственно. При анализе рентгенологической картины у половины больных определялся КТ-паттерн обычной интерстициальной пневмонии (ОИП), у 6 пациентов — вероятной ОИП, у 5 пациентов имелось сочетание ОИП с эмфиземой.
Вторая группа — ИЗЛ при ИВРЗ (n=10). Среди пациентов с ИЗЛ при ИВРЗ 9 больных получали нинтеданиб, 1 — пирфенидон. Пятеро больных наблюдались у ревматолога с диагнозом «прогрессирующий системный склероз» (ПСС), 2 человека — с ревматоидным артритом (РА), у 1 диагностирована болезнь Шегрена и у 2 — недифференцированное ИВРЗ. Кашель зарегистрирован у 5 пациентов, у 3 из них на фоне АФТ кашель регрессировал. При оценке выраженности одышки по шкале mMRC у 8 пациентов одышка соответствовала 2-й степени, у 2 — 3-й степени. На фоне терапии ни у одного пациента одышка не прогрессировала, у 1 пациента наблюдалось уменьшение одышки (по шкале mMRC от тяжелой до средней тяжести). Характерная деформация концевых фаланг пальцев по типу «барабанных палочек» выявлена у 4 пациентов. Феномен крепитации «Velcro» при аускультации легких определялся у 7 больных. Четверо больных имели ДН I степени, 6 — ДН II степени, у всех без динамики на фоне АФТ. Среди сопутствующих заболеваний выявлены сердечно-сосудистая патология, остеопороз, патология щитовидной железы (аутоиммунный тиреоидит, гипотиреоз), ХОБЛ, сахарный диабет, язвенная болезнь двенадцатиперстной кишки. По данным КТВР органов грудной клетки 4 больных относились к КТ-паттерну фибротической неспецифической интерстициальной пневмонии и ОИП соответственно. У 1 пациента определялась вероятная ОИП и у 1 пациента — сочетание ОИП с эмфиземой легких.
Третья группа — ХФГП (n=21). Согласно вопроснику воздействий в 90% случаев установлен потенциальный этио-тропный антиген (табл. 2) [5].

Всем больным 3-й группы был назначен нинтеданиб. Кашель установлен у 16 больных из 21. На фоне терапии 7 пациентов отметили регресс кашля. При оценке выраженности одышки по шкале mMRC у 13 больных одышка соответствовала 3-й степени, у 6 — 2-й степени и у 2 — 4-й степени. У 1 больной с ХФГП зарегистрированы усиление одышки, отрицательная динамика рентгенологической картины и снижение функциональных показателей, что можно объяснить продолжающимся воздействием потенциального этиологического фактора (проживание в квартире, где присутствует плесень), т. е. прогрессирование заболевания. У остальных пациентов выраженность одышки на фоне АФТ не менялась. Характерная деформация концевых фаланг пальцев по типу «пальцев Гиппократа» выявлена у 15 пациентов. Феномен крепитации «Velcro» при аускультации легких определялся у 20 пациентов. У 16 пациентов установлена ДН II степени, у 5 больных — III степени, не претерпевшая изменений в процессе АФТ. Одиннадцать больных страдали сердечно-сосудистыми заболеваниями, бронхиальная астма установлена у 6, ХОБЛ — у 3, сахарный диабет — у 3, злокачественные новообразования — у 1 пациента. При анализе рентгенологической картины у 14 больных регистрировался КТ-паттерн типичного гиперчувствительного пневмонита (ГП), у 7 пациентов — возможный ГП.
Динамика функциональных показателей респираторной системы на фоне приема АФТ у пациентов с ПФФ представлена в таблице 3.
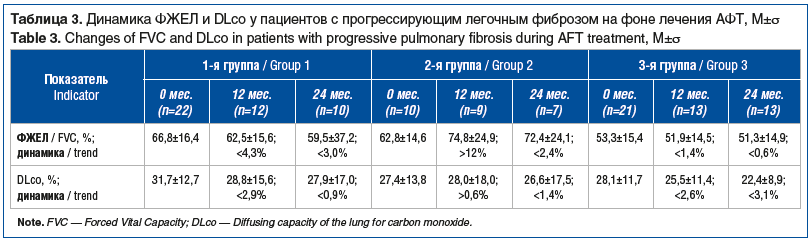
Таким образом, на фоне 24-месячной АФТ из 53 пациентов с ИЗЛ ПФФ у 14 (26,4%) больных произошел регресс кашля, характерного для ПФФ. Стабилизация уровня одышки, показателей ФЖЕЛ и DLco, рентгенологической картины установлена у 52 (98,1%) из 53 больных. Более чем у 80% больных выявлена сочетанная патология (от 1 до 3 сопутствующих заболеваний). Функциональные показатели респираторной системы были стабильными. Обострений заболевания не зарегистрировано. На фоне АФТ из-за серьезных нежелательных явлений (СНЯ) у 2 пациентов проведена замена нинтеданиба на пирфенидон и у 2 — пирфенидона на нинтеданиб. Нежелательные явления (НЯ) с медикаментозной коррекцией и/или кратковременным прекращением приема препарата зарегистрированы у 18 пациентов на фоне нинтеданиба и у 2 на фоне пирфенидона. В целом частота СНЯ и НЯ при лечении нинтеданибом составила 60,6%, при терапии пирфенидоном — 20%.
Обсуждение
Несомненно, что проведение междисциплинарных обсуждений способствует увеличению участия в них специалистов из регионов и расширяет охват больных ИЗЛ экспертами специализированных центров. Это обстоятельство напрямую влияет на эффективность лечения, так как доступность АФТ в специализированных и неспециализированных центрах составляет 91 и 60% соответственно [6]. Выделение в настоящей работе трех нозологических групп с высоким потенциалом прогрессирования фиброза соответствует результатам ретроспективного анализа, согласно которым признаки прогрессирования заболевания установлены в 91,1% случаев у больных с ИЛФ, в 71,4% — с ПСС и в 47,5% — с ГП [7]. Продолжают изучаться новые патогенетические звенья фиброобразования в респираторной ткани при ИЗЛ. Методом иммунологического анализа выявлена особая роль нейтрофилов и, в частности, внеклеточных ловушек нейтрофилов (NETs) у больных ИЗЛ при РА, за счет активации фибробластов и экспрессии интерлейкина 17 (ИЛ-17), ремоделирования внеклеточного матрикса, активации системы комплемента [8]. Биопсия ткани легкого у пациентов с РА подтверждает высокую экспрессию ИЛ-17 активированными фибробластами, что подтверждает роль медиатора в развитии интерстициального фиброза у данной категории больных. Оценен лабораторный эффект нинтеданиба на изучаемые концентрации активных веществ в сыворотке крови больных ИЗЛ при РА. Полученные результаты демонстрируют снижение уровня NETs и растворимого терминального комплекса комплемента (sC5b-9) у пациентов, получающих нинтеданиб, что подтверждает его позитивное влияние на иммунофиброгенез заболевания [8]. Цитируемое исследование подтверждается результатами настоящего исследования, свидетельствующими о повышении уровня ФЖЕЛ на 12% в первые 12 мес. лечения у пациентов с ИЗЛ при ИВРЗ и сохранении уровня ФЖЕЛ выше 70% при продолжении АФТ. Систематический обзор и метаанализ работ, посвященных изучению эффективности АФТ у пациентов с РА и ИЗЛ и ИЗЛ при ИВРЗ, показал, что назначенная терапия замедляет падение ФЖЕЛ по сравнению с плацебо [9]. Аналогичные результаты в виде замедления снижения ФЖЕЛ и падения проходимой дистанции представлены в другом исследовании, включающем 1816 пациентов с ПФФ, не ИЛФ [10]. Выделение ведущего КТ-паттерна у пациентов с ИЗЛ ПФФ позволяет получить представление о характеристике и прогнозе данной патологии. В частности, КТ-паттерны ОИП и вероятной ОИП преобладают у больных с прогрессирующим фиброзом согласно данным регистра Британского торакального общества, работ отечественных коллег и совпадают с результатами настоящего исследования, что требует особого внимания врачей первичного звена при маршрутизации больного в специализированный центр [7, 11]. У больных ИЛФ с ОИП отрицательная рентгенологическая динамика фиброза в первые 6 мес. АФТ регистрируется чаще, чем у больных ИЛФ с другими КТ-паттернами [11]. Длительное наблюдение демонстрирует отсутствие положительного влияния на симптомы заболевания, что является закономерным для патогенеза фиброза, принимая во внимание тот факт, что по данным КТВР паттерн ОИП определялся у 40–50% наблюдаемых больных. Динамика функциональных показателей в проведенном исследовании свидетельствует о достигнутом антифибротическом эффекте. В каждой из трех нозологических групп зафиксирована стабилизация уровней ФЖЕЛ и DLco или их заметное медленное снижение (у больных ИЛФ). Национальные клинические рекомендации, разработанные для больных ИЛФ и ГП, предлагают назначение АФТ с целью замедления процессов фиброобразования[1],[2]. Таким образом, можно считать обоснованным и эффективным назначенное лечение у больных, включенных в исследуемый регистр. В рамках настоящей работы установлена равнозначная эффективность нинтеданиба и пирфенидона у больных с ИЗЛ ПФФ при более благоприятной переносимости лечения пирфенидоном. Аналогичные результаты получены в многоцентровом проспективном исследовании с участием 232 пациентов с ИЛФ, получавших пирфенидон или нинтеданиб: прием нинтеданиба прекратили 36,5% пациентов, пирфенидона — 19,7%. Отношение рисков прекращения лечения пирфенидоном по сравнению с пациентами, начавшими принимать нинтеданиб, составило 0,65 (95% ДИ 0,46–0,94, p=0,002) [12]. Безусловно, необратимые нарушения функции респираторной системы и выраженные клинические симптомы побуждают к более тщательному выявлению больных и своевременному назначению АФТ.
Заключение
Ранняя диагностика ИЗЛ, направление в специализированные центры и междисциплинарное обсуждение — факторы, оказывающие существенное влияние на прогноз заболевания. АФТ у больных с различными нозологическими формами ИЗЛ ПФФ показала стабилизацию клинико-рентгенологических показателей, функциональных показателей и обеспечила замедление скорости прогрессирования процессов фиброобразования в легких.
Сведения об авторах:
Лещенко Игорь Викторович — д.м.н., профессор, профессор кафедры инфекционных болезней, фтизиатрии и пульмонологии института клинической медицины ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; главный научный сотрудник УНИИФ — филиала ФГБУ «НМИЦ ФПИ» Минздрава России; 620039, Россия, г. Екатеринбург, ул. 22-го Партсъезда, д. 50; научный руководитель клиники, пульмонолог ООО МО «Новая больница»; 620109, Россия, г. Екатеринбург, ул. Заводская, д. 29; ORCID iD 0000-0002-1620-7159
Трифанова Наталья Михайловна — к.м.н., врач-пульмонолог ООО МО «Новая больница»; 620109, Россия, г. Екатеринбург, ул. Заводская, д. 29; ORCID iD 0009-0007-5940-3532
Глушкова Татьяна Валерьевна — к.м.н., врач-пульмонолог УНИИФ — филиала ФГБУ «НМИЦ ФПИ» Минздрава России; 620039, Россия, г. Екатеринбург, ул. 22-го Партсъезда, д. 50; ORCID iD 0000-0002-5693-5097
Контактная информация: Трифанова Наталья Михайловна, е-mail: natashat77@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 08.07.2025.
Поступила после рецензирования 31.07.2025.
Принята в печать 25.08.2025.
About the authors:
Igor V. Leshchenko — Dr. Sc. (Med.), Professor of the Department of Infectious Diseases, Phthisiatry and Pulmonology of the Institute of Clinical Medicine, Ural State Medical University; 3, Repin str., Yekaterinburg, 620028, Russian Federation; Chief Laboratory Researcher, Ural Research Institute of Phthisiopulmonology — Branch of the National Medical Research Center of Phthisiopulmonology
and Infectious Diseases; 50, 22nd Parts’ezd str., Yekaterinburg, 620039, Russian Federation; Scientific Director of the Clinic, pulmonologist, Medical Association «Novaya Bolnitsa» (New Hospital) LLC; 29, Zavodskaya str., Yekaterinburg, 620109, Russian Federation; ORCID iD 0000-0002-1620-7159
Natalya M. Trifanova — C. Sc. (Med.), pulmonologist, Medical Association «Novaya Bolnitsa» (New Hospital) LLC; 29, Zavodskaya str., Yekaterinburg, 620109, Russian Federation; ORCID iD 0009-0007-5940-3532
Tatyana V. Glushkova — C. Sc. (Med.), pulmonologist, Ural Research Institute of Phthisiopulmonology — Branch of the National Medical Research Center of Phthisiopulmonology and Infectious Diseases; 50, 22nd Parts’ezd str., Yekaterinburg, 620039, Russian Federation; ORCID iD 0000-0002-5693-5097
Contact information: Natalya M. Trifanova, е-mail: natashat77@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 08.07.2025.
Revised 31.07.2025.
Accepted 25.08.2025.
[1] Клинические рекомендации. Идиопатический легочный фиброз. 2021. (Электронный ресурс.) URL: https://spulmo.ru/upload/kr/ILF_2021.pdf (дата обращения: 18.08.2025).
[2] Клинические рекомендации. Гиперчувствительный пневмонит. 2024. (Электронный ресурс.) URL: https://spulmo.ru/upload/KR-giperchuvstvitelnyj-pnevmonit-2024.pdf (дата обращения: 18.08.2025).
Информация с rmj.ru






